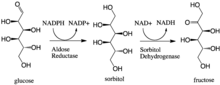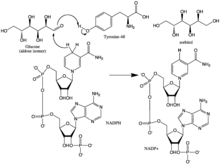Aldose réductase - Aldose reductase
| Aldose réductase | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Diagramme en ruban de l'aldose réductase humaine en complexe avec NADP + , citrate et IDD594, un inhibiteur de petite molécule . À partir de l' APB : 1us0 .
| |||||||||
| Identifiants | |||||||||
| Numéro CE | 1.1.1.21 | ||||||||
| Numero CAS | 9028-31-3 | ||||||||
| Bases de données | |||||||||
| IntEnz | Vue IntEnz | ||||||||
| BRENDA | Entrée BRENDA | ||||||||
| ExPASy | Vue NiceZyme | ||||||||
| KEGG | Entrée KEGG | ||||||||
| MetaCyc | voie métabolique | ||||||||
| PRIAM | profil | ||||||||
| Structures PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
En enzymologie , l' aldose réductase (ou aldéhyde réductase ) ( EC 1.1.1.21 ) est une oxydoréductase cytosolique dépendante du NADPH qui catalyse la réduction d'une variété d'aldéhydes et de carbonyles, y compris les monosaccharides. Il est principalement connu pour catalyser la réduction du glucose en sorbitol , la première étape de la voie polyol du métabolisme du glucose.
Réactions
L'aldose réductase catalyse la conversion dépendante du NADPH du glucose en sorbitol , la première étape de la voie polyol du métabolisme du glucose. La deuxième et dernière étape de la voie est catalysée par la sorbitol déshydrogénase , qui catalyse l'oxydation liée au NAD du sorbitol en fructose. Ainsi, la voie des polyols entraîne la conversion du glucose en fructose avec une utilisation stoechiométrique du NADPH et la production de NADH.
Le galactose est également un substrat pour la voie des polyols, mais le sucre céto correspondant n'est pas produit car la sorbitol déshydrogénase est incapable d'oxyder le galactitol. Néanmoins, l'aldose réductase peut catalyser la réduction du galactose en galactitol
- galactose + NADPH + H + galactitol + NADP +
Fonction
La réaction d'aldose réductase, en particulier le sorbitol produit, est importante pour le fonctionnement de divers organes du corps. Par exemple, il est généralement utilisé comme première étape dans une synthèse de fructose à partir de glucose; la deuxième étape est l'oxydation du sorbitol en fructose catalysée par la sorbitol déshydrogénase . La voie principale du glucose au fructose ( glycolyse ) implique la phosphorylation du glucose par l' hexokinase pour former le glucose 6-phosphate , suivie d'une isomérisation en fructose 6-phosphate et de l' hydrolyse du phosphate, mais la voie du sorbitol est utile car elle ne nécessite pas d'entrée d' énergie sous forme d' ATP :
- Vésicules séminales : Le fructose produit à partir du sorbitol est utilisé par les spermatozoïdes .
- Foie : Le fructose produit à partir du sorbitol peut être utilisé comme source d'énergie pour la glycolyse et la glyconéogenèse .
L'aldose réductase est également présente dans le cristallin , la rétine , les cellules de Schwann des nerfs périphériques, le placenta et les globules rouges .
Chez la drosophile , CG6084 codait pour une protéine hautement conservée de l'aldo-céto réductase 1B humaine. dAKR1B dans les hémocytes, est nécessaire et suffisant pour l'augmentation des alcools de sucre plasmatique après une infection intestinale. Une augmentation du sorbitol a ensuite activé la métalloprotéase 2, qui clive le PGRP-LC pour activer la réponse immunitaire systémique dans les corps adipeux. Ainsi, l'aldose réductase fournit un point de contrôle métabolique critique dans la réponse inflammatoire globale.
Structure enzymatique
L'aldose réductase peut être considérée comme une enzyme prototypique de la superfamille des enzymes aldo-céto réductase. L'enzyme comprend 315 résidus d'acides aminés et se replie en un motif structurel en barillet β / α composé de huit brins β parallèles. Les brins adjacents sont reliés par huit segments a-hélicoïdaux périphériques s'étendant de manière anti-parallèle à la feuille β. Le site actif catalytique situé dans le noyau du fût. Le cofacteur NADPH est situé au sommet du barillet β / α, avec l'anneau nicotinamide fait saillie vers le bas au centre du canon et le pyrophosphate chevauchant la lèvre du canon.


Mécanisme enzymatique
Le mécanisme de réaction de l'aldose réductase dans le sens de la réduction de l'aldéhyde suit un chemin ordonné séquentiel où le NADPH se lie, suivi du substrat. La liaison du NADPH induit un changement de conformation (Enzyme • NADPH → Enzyme * • NADPH) qui implique un mouvement de type charnière d'une boucle de surface (résidus 213-217) de manière à couvrir une partie du NADPH d'une manière similaire à celle d'un Ceinture de sécurité. Le produit alcoolique est formé via un transfert de l'hydrure pro-R de NADPH à la face du carbone carbonyle du substrat. Suite à la libération du produit alcoolisé, un autre changement de conformation se produit (E * • NADP + → E • NADP + ) afin de libérer NADP + . Des études cinétiques ont montré que la réorientation de cette boucle pour permettre la libération de NADP + semble représenter l'étape limitant la vitesse dans le sens de la réduction de l'aldéhyde. Comme la vitesse de libération de la coenzyme limite la vitesse catalytique, on peut voir que la perturbation des interactions qui stabilisent la liaison de la coenzyme peut avoir des effets dramatiques sur la vitesse maximale (Vmax).
L'hydrure transféré du NADP + au glucose provient du C-4 du cycle nicotinamide à la base de la cavité hydrophobe. Ainsi, la position de ce carbone définit le site actif de l'enzyme. Il existe trois résidus dans l'enzyme à une distance appropriée du C-4 qui pourraient être des donneurs potentiels de protons: Tyr-48, His-110 et Cys-298. Les preuves de modélisation évolutive, thermodynamique et moléculaire ont prédit Tyr-48 comme donneur de protons. Cette prédiction a été confirmée par les résultats des études de mutagenèse. Ainsi, on pense qu'une interaction [de liaison hydrogène] entre le groupe hydroxyle phénolique de Tyr-48 et la chaîne latérale ammonium de Lys-77 aide à faciliter le transfert d'hydrure.
Rôle dans le diabète
Le diabète sucré est reconnu comme l'une des principales causes de nouveaux cas de cécité et est associé à un risque accru de neuropathie douloureuse, de maladie cardiaque et d'insuffisance rénale. De nombreuses théories ont été avancées pour expliquer les mécanismes menant à des complications diabétiques, y compris la stimulation du métabolisme du glucose par la voie des polyols. En outre, l'enzyme est localisée dans l'œil ( cornée , rétine , cristallin ), les reins et la gaine de myéline - des tissus souvent impliqués dans les complications du diabète. Dans des conditions glycémiques normales, seule une petite fraction du glucose est métabolisée par la voie des polyols, la majorité étant phosphorylée par l'hexokinase, et le produit résultant, le glucose-6-phosphate, est utilisé comme substrat pour la glycolyse ou le métabolisme du pentose phosphate. Cependant, en réponse à l' hyperglycémie chronique observée chez les diabétiques, le flux de glucose à travers la voie des polyols est considérablement augmenté. Jusqu'à 33% de l'utilisation totale du glucose dans certains tissus peut se faire par la voie des polyols. Les concentrations de glucose sont souvent élevées chez les diabétiques et on a longtemps cru que l'aldose réductase était responsable de complications diabétiques impliquant un certain nombre d'organes. De nombreux inhibiteurs de l'aldose réductase ont été développés en tant que médicaments candidats, mais pratiquement tous ont échoué bien que certains tels que l' epalrestat soient disponibles dans le commerce dans plusieurs pays. Des inhibiteurs supplémentaires de la réductase tels que le ranirestat , le ponalrestat , le rinalrestat , le risarestat , le sorbinil et la berbérine font actuellement l'objet d'essais cliniques.
Voir également
Références
Lectures complémentaires
- Denise R., PhD. Ferrier (2005). Revues illustrées de Lippincott: Biochimie (Revues illustrées de Lippincott) . Hagerstown, Maryland: Lippincott Williams et Wilkins. p. 319. ISBN 0-7817-2265-9 .
- Attwood MA, Doughty CC (décembre 1974). "Purification et propriétés de l'aldose réductase de foie de veau". Biochim. Biophys. Acta . 370 (2): 358–68. doi : 10.1016 / 0005-2744 (74) 90097-7 . PMID 4216364 .
- Boghosian RA, McGuinness ET (avril 1979). "Purification d'affinité et propriétés de l'aldose réductase de cerveau porcin". Biochim. Biophys. Acta . 567 (2): 278–86. doi : 10.1016 / 0005-2744 (79) 90113-x . PMID 36151 .