Pentoxyde d'arsenic - Arsenic pentoxide

|
|
| Des noms | |
|---|---|
| Autres noms
Oxyde d'arsenic (V) Oxyde d'
arsenic Anhydride d' arsenic |
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChemSpider | |
| Carte Info ECHA |
100.013.743 |
| Numéro CE | |
|
PubChem CID
|
|
| Numéro RTECS | |
| UNII | |
| Numéro UN | 1559 |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| Comme 2 O 5 | |
| Masse molaire | 229,8402 g/mol |
| Apparence | blanc hygroscopique poudre |
| Densité | 4,32 g / cm 3 |
| Point de fusion | 315 °C (599 °F; 588 K) (se décompose) |
| 59,5 g / 100 ml (0 ° C) 65,8 g / 100 ml (20 ° C) 8,20 g / 100 ml (100 ° C) |
|
| Solubilité | soluble dans l' alcool |
| Acidité (p K a ) | 7 |
| Dangers | |
| Pictogrammes SGH |
  
|
| Mot de signalisation SGH | Danger |
| H301 , H331 , H350 , H400 , H410 | |
| P201 , P202 , P261 , P264 , P270 , P271 , P273 , P281 , P301+310 , P304+340 , P308+313 , P311 , P321 , P330 , P391 , P403+233 , P405 , P501 | |
| NFPA 704 (diamant de feu) | |
| Dose ou concentration létale (LD, LC) : | |
|
DL 50 ( dose médiane )
|
8 mg / kg (rat, oral) |
| NIOSH (limites d'exposition pour la santé aux États-Unis): | |
|
PEL (autorisé)
|
[1910.1018] TWA 0,010 mg / m 3 |
|
REL (recommandé)
|
Ca C 0,002 mg / m 3 [15 minutes] |
|
IDLH (danger immédiat)
|
Ca [5 mg/m 3 (en As)] |
| Composés apparentés | |
|
Autres cations
|
Pentoxyde de phosphore Pentoxyde d' antimoine |
|
Composés apparentés
|
Trioxyde d' arsenic Acide d'arsenic |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Références Infobox | |
Le pentoxyde d'arsenic est le composé inorganique de formule As 2 O 5 . Ce solide vitreux, blanc, déliquescent est relativement instable, compatible avec la rareté de l'état d'oxydation As(V). L' oxyde d'arsenic (III) (As 2 O 3 ) est plus courant et bien plus important commercialement . Tous les composés de l'arsenic sont hautement toxiques et ne trouvent donc que des applications commerciales limitées.
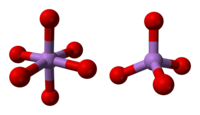
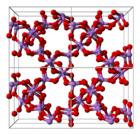
Structure
La structure est constituée de centres tétraédriques {AsO 4 } et octaédriques {AsO 6 } reliés par des coins partagés. La structure diffère de celle de l' oxyde de phosphore (V) correspondant ; par conséquent, bien qu'il existe encore une solution solide avec cet oxyde, il ne progresse qu'au point équimolaire, point auquel le phosphore a remplacé l'arsenic dans tous ses sites tétraédriques. De même, le pentoxyde d'arsenic peut également se dissoudre jusqu'à une quantité équimolaire de pentoxyde d'antimoine , en tant que substitut de l'antimoine à l'arsenic uniquement dans ses sites octaédriques.
 |
 |
|
| Comme coordination | cellule unitaire | emballage de cellule |
La synthèse
Historique
Paracelsus Macquer a trouvé un sel cristallisable qu'il a appelé «sel neutre arsenical». Ce sel était le résidu obtenu après distillation d' acide nitrique à partir d'un mélange de nitrate de potassium et de trioxyde d'arsenic . Auparavant, Paracelsus chauffait un mélange de trioxyde d'arsenic et de nitrate de potassium. Il a appliqué le terme « arsenicum fixum » au produit. A. Libavius a appelé le même produit «butyrum arsenici» (beurre d'arsenic), bien que ce terme soit en fait utilisé pour le trichlorure d'arsenic. Les produits trouvés par Paracelse et Libavius étaient tous des arsénates alcalins impurs. Scheele a préparé un certain nombre d'arséniates par l'action de l'acide arsénique sur les alcalis. L'un des arséniats qu'il préparait était le pentoxyde d'arsenic. L'eau contenue dans les alcalis s'est évaporée à 180 ° C et le pentoxyde d'arsenic était stable en dessous de 400 ° C.
Méthodes modernes
Le pentoxyde d'arsenic peut être cristallisé par chauffage de As 2 O 3 sous oxygène. Cette réaction est réversible:
- As 2 O 5 ⇌ As 2 O 3 + O 2
Des agents oxydants puissants tels que l' ozone , le peroxyde d'hydrogène et l'acide nitrique transforment le trioxyde d'arsenic en pentoxyde.
L'acide arsenical peut être généré par le traitement de routine des composés de l'arsenic, y compris l'oxydation de l'arsenic et des minéraux contenant de l'arsenic dans l'air. Un exemple est le grillage d' orpiment , un minerai de sulfure d'arsenic typique:
- 2 As 2 S 3 + 11 O 2 → 2 As 2 O 5 + 6 SO 2
Sécurité
Comme tous les composés de l'arsenic, le pentoxyde est hautement toxique. Son arsénite dérivé réduit, qui est un composé As (III), est encore plus toxique car il a une forte affinité pour les groupes thiol des résidus cystéine dans les protéines.
Il est classé comme substance extrêmement dangereuse aux États-Unis, tel que défini dans la section 302 de la loi américaine sur la planification d'urgence et le droit à la connaissance (42 USC 11002), et est soumis à des exigences strictes de déclaration par les installations qui produisent, stockent, ou utilisez-le en quantités importantes.
Les références
- ^ A b c NIOSH Pocket Guide de dangers des produits chimiques. "# 0038" . Institut national pour la sécurité et la santé au travail (NIOSH).
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Chimie des éléments (2e éd.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ un b Martin Jansen (1977). "Structure cristalline d'As 2 O 5 ". Angewandte Chemie International Edition en anglais . 16 (5): 314–315. doi : 10.1002 / anie.197703142 .
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Chimie des éléments (2e éd.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ un b J. W. Mellor. "Traité complet sur la chimie inorganique et théorique" . Archivé de l'original le 2012-05-11 . Récupéré 30/03/2013 .
- ^ CW Zenger; et coll. «Arsenic 149» . Archivé de l'original le 2013-04-09.
- ^ Grund, SC; Hanusch, K.; Wolf, HU "Composés d'arsenic et d'arsenic". Encyclopédie Ullmann de chimie industrielle . Weinheim: Wiley-VCH. doi : 10.1002 / 14356007.a03_113.pub2 .
-
^ "40 CFR: Appendice A à la Partie 355 - La Liste des Substances Extrêmement Dangereuses et Leurs Quantités de Planification Seuil" (PDF) (1 juillet 2008 éd.). Bureau d'impression du gouvernement . Archivé de l'original (PDF) le 25 février 2012 . Récupéré le 29 octobre 2011 . Citer le journal nécessite
|journal=( aide )
Liens externes
- Guide de poche du NIOSH sur les dangers chimiques
- Monographie du CIRC - Arsenic et composés d'arsenic
- Rapport du NTP sur les cancérogènes - Composés inorganiques de l'arsenic
- ESIS: Système européen d'information sur les substances chimiques
- Linstrom, Peter J.; Mallard, William G. (éd.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69 , National Institute of Standards and Technology, Gaithersburg (MD), http://webbook.nist.gov

