Désoxygénation Barton–McCombie - Barton–McCombie deoxygenation
| Désoxygénation Barton-McCombie | |
|---|---|
| Nommé après |
Derek Harold Richard Barton Stuart W. McCombie |
| Type de réaction | Réaction d'oxydoréduction organique |
| Identifiants | |
| Portail de la chimie organique | Barton-mccombie-réaction |
| ID d'ontologie RSC | RXNO:0000134 |
La désoxygénation de Barton-McCombie est une réaction organique dans laquelle un groupe fonctionnel hydroxy dans un composé organique est remplacé par un hydrogène pour donner un groupe alkyle . Il porte le nom des chimistes britanniques Sir Derek Harold Richard Barton et Stuart W. McCombie.
Cette réaction de désoxygénation est une substitution radicalaire . Dans la décarboxylation de Barton apparentée, le réactif est un acide carboxylique .
Mécanisme
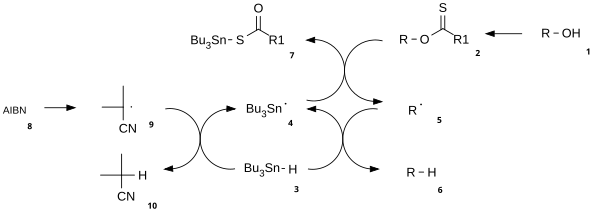
Le mécanisme réactionnel consiste en une étape d'initiation radicalaire catalytique et une étape de propagation. L' alcool ( 1 ) est d' abord converti en un intermédiaire carbonothioyle réactif tel qu'un thionoester ou un xanthate 2 . Le chauffage de l' AIBN entraîne son clivage homolytique, générant deux radicaux 2-cyanoprop-2-yle 9 qui soustrait chacun un proton du tributylstannane 3 pour générer des radicaux tributylstannyle 4 et inactifs 10 . Le radical tributylétain soustrait le groupe xanthate de 2 par attaque de 4 sur l'atome de soufre avec clivage homolytique concomitant de la liaison CS . Cela laisse un radical centré sur le carbone qui forme une liaison CO par clivage homolytique de la liaison RO , donnant le radical alkyle 5 et le xanthate de tributylétain 7 . La liaison soufre étain dans ce composé est très stable et fournit la force motrice de cette réaction. Le radical alkyle 5 soustrait alors un atome d'hydrogène à une nouvelle molécule de tributylstannane générant le produit désoxygéné désiré ( 6 ) et une nouvelle espèce radicalaire prête à se propager.
Variantes
Sources d'hydrogène alternatives
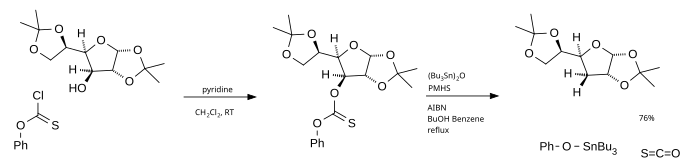
Le principal inconvénient de cette réaction est l'utilisation de tributylstannane qui est toxique, coûteux et difficile à éliminer du mélange réactionnel. Une alternative est l'utilisation d' oxyde de tributylétain comme source de radicaux et de poly(méthylhydridesiloxane) (PMHS) comme source d' hydrogène . Le chlorothionoformiate de phényle utilisé comme matériau de départ génère finalement du sulfure de carbonyle .
Trialkylboranes
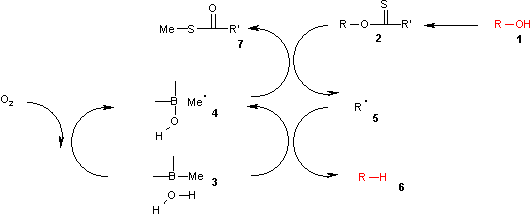
Un donneur d'hydrogène encore plus pratique est fourni par des complexes trialkylborane- eau tels que le triméthylborane contaminé par de petites quantités d'eau.
Dans ce cycle catalytique, la réaction est initiée par oxydation à l' air du trialkylborane 3 par l'air en radical méthyle 4 . Ce radical réagit avec le xanthate 2 en S-méthyl-S-méthyl dithiocarbonate 7 et le radical intermédiaire 5 . Le complexe (CH 3 ) 3 B.H 2 O 3 fournit un hydrogène pour se recombiner avec ce radical à l'alcane 6 laissant derrière lui l'acide diéthylborinique et un nouveau radical méthyle.
On trouve par des calculs théoriques qu'une réaction d' homolyse OH dans le complexe borane-eau est endothermique avec une énergie similaire à celle de la réaction d'homolyse dans le tributylstannane mais bien inférieure à la réaction d'homolyse de l'eau pure.
Portée
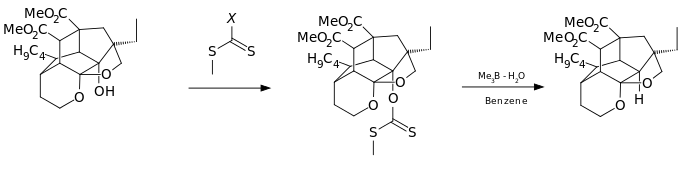
Une variante de cette réaction a été utilisée comme l'une des étapes de la synthèse totale de l' azadirachtine :
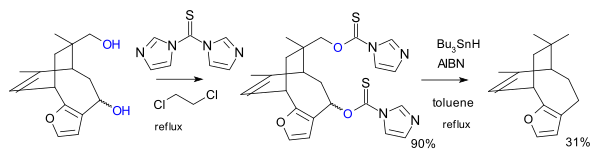
Dans une autre variante, le réactif est l' imidazole 1,1'-thiocarbonyldiimidazole (TCDI), par exemple dans la synthèse totale de la pallescensine B. Le TCDI est particulièrement bon pour les alcools primaires car il n'y a pas de stabilisation par résonance du xanthate car la paire isolée d'azote est impliquée dans le sextuor aromatique.
La réaction s'applique également aux S- alkylxanthates. Avec le triéthylborane comme nouveau réactif sans métal, les atomes d'hydrogène requis sont extraits des solvants protiques, de la paroi du réacteur ou même (dans des conditions strictement anhydres) du borane lui-même.