Bioélectricité - Bioelectricity
En biologie , la bioélectricité développementale fait référence à la régulation de la structuration et du comportement au niveau des cellules , des tissus et des organes à la suite d'une signalisation endogène à médiation électrique. Les cellules et les tissus de tous types utilisent des flux d'ions pour communiquer électriquement. Le porteur de charge en bioélectricité est l' ion (atome chargé), et un courant et un champ électriques sont générés chaque fois qu'un flux net d'ions se produit. Les courants et champs électriques endogènes , les flux d'ions et les différences de potentiel de repos à travers les tissus constituent un système de communication et de signalisation ancien et hautement conservé. Il fonctionne aux côtés (en série et en parallèle) de facteurs biochimiques, de réseaux transcriptionnels et d'autres forces physiques pour réguler le comportement cellulaire et la structuration à grande échelle au cours de l' embryogenèse , de la régénération , du cancer et de nombreux autres processus.
Contextualisation du terrain
La bioélectricité développementale est une sous-discipline de la biologie, liée à, mais distincte de, la neurophysiologie et la bioélectromagnétique . La bioélectricité développementale fait référence aux flux d'ions endogènes, aux gradients de tension transmembranaires et transépithéliaux, et aux courants et champs électriques produits et maintenus dans les cellules et les tissus vivants. Cette activité électrique est souvent utilisé au cours de l' embryogenèse, la régénération et le cancer - il est une couche de la matière complexe de signaux qui empiètent sur les cellules in vivo et de réguler leurs interactions au cours de la formation de motifs et d' entretien (figure 1). Ceci est distinct de la bioélectricité neuronale (classiquement appelée électrophysiologie), qui fait référence au pic rapide et transitoire dans les cellules excitables bien connues comme les neurones et les myocytes ; et du bioélectromagnétique, qui fait référence aux effets du rayonnement électromagnétique appliqué, et de l'électromagnétisme endogène comme l' émission de biophotons et la magnétite.
Aperçu du domaine : terminologie et définitions de base
La discontinuité intérieur/extérieur à la surface cellulaire permise par une membrane bicouche lipidique (condensateur) est au cœur de la bioélectricité. La membrane plasmique était une structure indispensable à l'origine et à l'évolution de la vie elle-même. Il a fourni une compartimentation permettant la mise en place d'un gradient différentiel tension/potentiel (batterie ou source de tension) à travers la membrane , permettant probablement une bioénergétique précoce et rudimentaire qui alimentait les mécanismes cellulaires. Au cours de l'évolution, la diffusion initialement purement passive des ions (porteurs de charge), devient progressivement contrôlée par l'acquisition de canaux ioniques , de pompes , d'échangeurs et de transporteurs. Ces translocateurs énergétiquement libres (résistances ou conducteurs, transport passif) ou coûteux (sources de courant, transport actif) fixent et ajustent avec précision les gradients de tension - potentiels de repos - qui sont omniprésents et essentiels à la physiologie de la vie, allant de la bioénergétique, le mouvement, la détection, le transport des nutriments. , l'élimination des toxines et la signalisation dans les conditions homéostatiques et pathologiques/blessures. Lors de stimuli ou de rupture de barrière (court-circuit) de la membrane, les ions alimentés par le gradient de tension (force électromotrice) diffusent ou fuient, respectivement, à travers le cytoplasme et les fluides interstitiels (conducteurs), générant des courants électriques mesurables - flux d'ions nets - et des champs. Certains ions (comme le calcium ) et molécules (comme le peroxyde d'hydrogène ) modulent des translocateurs ciblés pour produire un courant ou pour améliorer, atténuer ou même inverser un courant initial, étant des commutateurs.
Les signaux bioélectriques endogènes sont produits dans les cellules par l'action cumulative des canaux ioniques, des pompes et des transporteurs. Dans les cellules non excitables, le potentiel de repos à travers la membrane plasmique (Vmem) des cellules individuelles se propage sur des distances via des synapses électriques appelées jonctions communicantes (conducteurs), qui permettent aux cellules de partager leur potentiel de repos avec leurs voisins. Les cellules alignées et empilées (comme dans les épithéliums) génèrent des potentiels transépithéliaux (batterie en série) et des champs électriques (figures 2 et 3), qui se propagent également à travers les tissus. Les jonctions serrées (résistances) atténuent efficacement la diffusion et les fuites d'ions paracellulaires, empêchant le court-circuit de tension. Ensemble, ces tensions et champs électriques forment des modèles riches et dynamiques (Figure 5) à l'intérieur des corps vivants qui délimitent les caractéristiques anatomiques , agissant ainsi comme des modèles pour l'expression des gènes et la morphogenèse dans certains cas. Plus que des corrélations, ces distributions bioélectriques sont dynamiques, évoluant avec le temps et avec le microenvironnement et même des conditions à longue distance pour servir d'influences instructives sur le comportement cellulaire et la structuration à grande échelle pendant l'embryogenèse, la régénération et la suppression du cancer. Les mécanismes de contrôle bioélectrique sont une cible émergente importante pour les progrès de la médecine régénérative, des malformations congénitales , du cancer et de la bio-ingénierie synthétique .
Bref historique du domaine : les pionniers de la bioélectricité
Les racines modernes de la bioélectricité développementale remontent à tout le XVIIIe siècle. Plusieurs travaux fondateurs stimulant les contractions musculaires à l'aide de jarres de Leyde ont culminé avec la publication d'études classiques de Luigi Galvani en 1791 (De viribus electricitatis in motu musculairei) et 1794. Dans celles-ci, Galvani pensait avoir découvert la capacité intrinsèque de production d'électricité dans les tissus vivants ou " électricité animale ». Alessandro Volta a montré que les contractions musculaires de la jambe de la grenouille étaient dues à un générateur d'électricité statique et au contact de métaux différents . Galvani a montré, dans une étude de 1794, des contractions sans électricité métallique en touchant le muscle de la jambe avec un nerf sciatique déviant coupé , montrant définitivement «l'électricité animale». Sans le savoir, Galvani avec cela et des expériences connexes a découvert le courant de blessure (fuite d'ions entraînée par la membrane/le potentiel épithélial intact) et le potentiel de blessure (différence de potentiel entre la membrane/l'épithélium blessé et intact). Le potentiel de blessure était, en fait, la source électrique derrière la contraction de la jambe, comme cela a été réalisé au siècle suivant. Les travaux ultérieurs ont finalement étendu ce domaine largement au-delà des nerfs et des muscles à toutes les cellules, des bactéries aux cellules de mammifères non excitables.
S'appuyant sur des études antérieures, d'autres aperçus de la bioélectricité du développement se sont produits avec la découverte de courants et de champs électriques liés aux plaies dans les années 1840, lorsque l'un des pères fondateurs de l' électrophysiologie moderne - Emil du Bois-Reymond - a signalé des activités électriques au niveau macroscopique chez la grenouille, poissons et corps humains. Il a enregistré des courants électriques infimes dans des tissus et des organismes vivants avec un galvanomètre à la pointe de la technologie composé de bobines de fil de cuivre isolées. Il a dévoilé l'électricité en évolution rapide associée à la contraction musculaire et à l'excitation nerveuse - les potentiels d'action . Dans le même temps, du Bois-Reymond a également rapporté en détail une électricité moins fluctuante au niveau des blessures – blessures actuelles et potentielles – qu'il s'est faites.

Les travaux de bioélectricité ont commencé sérieusement au début du 20e siècle. Depuis, plusieurs vagues de recherche ont produit d'importantes données fonctionnelles montrant le rôle que joue la bioélectricité dans le contrôle de la croissance et de la forme. Dans les années 1920 et 1930, EJ Lund et HS Burr étaient parmi les auteurs les plus prolifiques dans ce domaine. Lund a mesuré les courants dans un grand nombre de systèmes modèles vivants, les corrélant aux changements de structuration. En revanche, Burr a utilisé un voltmètre pour mesurer les gradients de tension, en examinant les tissus embryonnaires et les tumeurs en développement, chez une gamme d'animaux et de plantes. Il a été démontré que les champs électriques appliqués modifient la régénération des planaires par Marsh et Beams dans les années 1940 et 1950, induisant la formation de têtes ou de queues sur les sites de coupe, inversant la polarité primaire du corps. L'introduction et le développement de la sonde vibrante, le premier dispositif de caractérisation quantitative non invasive des courants d'ions minuscules extracellulaires, par Lionel Jaffe et Richard Nuccittelli, ont revitalisé le domaine dans les années 1970. Ils ont été suivis par des chercheurs tels que Joseph Vanable, Richard Borgens , Ken Robinson et Colin McCaig, entre autres, qui ont montré les rôles de la signalisation bioélectrique endogène dans le développement et la régénération des membres, l'embryogenèse, la polarité des organes et la cicatrisation . CD Cone a étudié le rôle du potentiel de repos dans la régulation de la différenciation et de la prolifération cellulaires et des travaux ultérieurs ont identifié des régions spécifiques du spectre du potentiel de repos qui correspondent à des états cellulaires distincts tels que quiescent, souche, cancer et différenciés en phase terminale (Figure 5).
Bien que cet ensemble de travaux ait généré une quantité importante de données physiologiques de haute qualité, cette approche biophysique à grande échelle a toujours été sous les projecteurs des gradients biochimiques et des réseaux génétiques dans l'enseignement de la biologie, le financement et la popularité globale parmi les biologistes. Un facteur clé qui a contribué à ce que ce domaine soit à la traîne de la génétique moléculaire et de la biochimie est que la bioélectricité est intrinsèquement un phénomène vivant - elle ne peut pas être étudiée dans des spécimens fixes. Travailler avec la bioélectricité est plus complexe que les approches traditionnelles de la biologie du développement, à la fois méthodologiquement et conceptuellement, car cela nécessite généralement une approche hautement interdisciplinaire.
Méthodologie d'étude de la signalisation bioélectrique : techniques à base d'électrodes
Les techniques de référence pour extraire quantitativement les dimensions électriques d'échantillons vivants, allant des niveaux cellulaires aux niveaux d'organismes, sont la microélectrode de verre (ou micropipette ), la sonde de tension vibrante (ou auto-référentielle) et la microélectrode vibrante sélective d'ions . Le premier est intrinsèquement invasif et les deux derniers sont non invasifs, mais tous sont des capteurs ultra-sensibles et à réponse rapide largement utilisés dans une pléthore de conditions physiologiques dans des modèles biologiques répandus.
La microélectrode de verre a été développée dans les années 1940 pour étudier le potentiel d'action des cellules excitables, dérivant des travaux fondateurs de Hodgkin et Huxley dans le calmar à axone géant . Il s'agit simplement d'un pont salin liquide reliant l'échantillon biologique à l'électrode, protégeant les tissus des toxines lixiviables et des réactions redox de l'électrode nue. En raison de sa faible impédance, de son faible potentiel de jonction et de sa faible polarisation, les électrodes d'argent sont des transducteurs standard du courant ionique en courant électrique qui se produit par une réaction redox réversible à la surface de l'électrode.
La sonde vibrante a été introduite dans les études biologiques dans les années 1970. La sonde sensible à la tension est plaquée de platine pour former une boule à pointe noire capacitive avec une grande surface. Lorsqu'elle vibre dans un gradient de tension CC artificiel ou naturel, la bille capacitive oscille dans une sortie CA sinusoïdale. L'amplitude de l'onde est proportionnelle à la différence de potentiel de mesure à la fréquence de la vibration, filtrée efficacement par un amplificateur de verrouillage qui augmente la sensibilité de la sonde.
La microélectrode vibrante sélective d'ions a été utilisée pour la première fois en 1990 pour mesurer les flux de calcium dans diverses cellules et tissus. La microélectrode sélective d'ions est une adaptation de la microélectrode de verre, où un échangeur d'ions liquide spécifique aux ions (ionophore) est rempli par pointe dans une microélectrode préalablement silanisée (pour éviter les fuites). De plus, la microélectrode vibre à basse fréquence pour fonctionner en mode d'autoréférencement précis. Seul l'ion spécifique imprègne l' ionophore , donc la lecture de tension est proportionnelle à la concentration d'ions dans la condition de mesure. Ensuite, le flux est calculé en utilisant la première loi de Fick .
Les techniques émergentes basées sur l'optique, par exemple l' optrode pH (ou optode ), qui peut être intégrée dans un système d'auto-référencement, peuvent devenir une technique alternative ou complémentaire dans les laboratoires de bioélectricité. L'optrode ne nécessite pas de référencement et est insensible à l'électromagnétisme, ce qui simplifie la configuration du système et en fait une option appropriée pour les enregistrements où la stimulation électrique est appliquée simultanément.
De nombreux travaux pour étudier fonctionnellement la signalisation bioélectrique ont utilisé des courants et des champs électriques (exogènes) appliqués via des appareils de fourniture de tension continue et alternative intégrés à des ponts de sel d'agarose. Ces dispositifs peuvent générer d'innombrables combinaisons d'amplitude et de direction de tension, d'impulsions et de fréquences. Actuellement, l'application de champs électriques par le biais d'un laboratoire sur puce gagne du terrain dans le domaine avec la possibilité de permettre des tests de criblage à haut débit des grandes sorties combinatoires.
Méthodologie d'étude de la signalisation bioélectrique : réactifs et approches de l'âge moléculaire
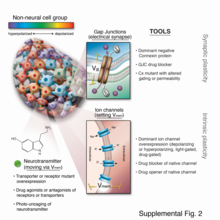
Les progrès remarquables de la biologie moléculaire au cours des six dernières décennies ont produit des outils puissants qui facilitent la dissection des signaux biochimiques et génétiques ; pourtant, ils ont tendance à ne pas être bien adaptés aux études bioélectriques in vivo. Les travaux antérieurs reposaient largement sur le courant appliqué directement par les électrodes, revigoré par des avancées récentes importantes en science des matériaux et des mesures de courant extracellulaire, facilitées par des systèmes d'électrodes auto-référencés sophistiqués. Alors que les applications d'électrodes pour manipuler les processus corporels contrôlés de manière neutre ont récemment attiré beaucoup d'attention, le système nerveux n'est que la pointe de l'iceberg lorsqu'il s'agit de contrôler les processus somatiques, car la plupart des types de cellules sont électriquement actifs et répondent aux signaux ioniques de eux-mêmes et leurs voisins (Figure 6).
Au cours des 15 dernières années, un certain nombre de nouvelles techniques moléculaires ont été développées qui ont permis d'étudier les voies bioélectriques avec un haut degré de résolution mécanistique et d'être liées à des cascades moléculaires canoniques. Ceux-ci comprennent (1) des criblages pharmacologiques pour identifier les canaux et les pompes endogènes responsables d'événements de structuration spécifiques ; (2) des colorants rapporteurs fluorescents sensibles à la tension et des indicateurs de tension fluorescents génétiquement codés pour la caractérisation de l'état bioélectrique in vivo ; (3) des panneaux de canaux ioniques dominants bien caractérisés qui peuvent être mal exprimés dans les cellules d'intérêt pour modifier l'état bioélectrique de la manière souhaitée ; et (4) des plates-formes informatiques qui sont mises en ligne pour aider à construire des modèles prédictifs de la dynamique bioélectrique dans les tissus.
Par rapport aux techniques à base d'électrodes, les sondes moléculaires offrent une résolution spatiale plus large et une analyse dynamique facilitée dans le temps. Bien que l'étalonnage ou le titrage soient possibles, les sondes moléculaires sont généralement semi-quantitatives, tandis que les électrodes fournissent des valeurs bioélectriques absolues. Un autre avantage de la fluorescence et d'autres sondes est leur nature moins invasive et leur multiplexage spatial, permettant la surveillance simultanée de vastes zones de tissus embryonnaires ou autres in vivo au cours de processus de traçage normaux ou pathologiques.
Rôle dans le développement précoce
Les travaux dans des systèmes modèles tels que Xenopus laevis et le poisson zèbre ont révélé un rôle de la signalisation bioélectrique dans le développement du cœur, du visage, des yeux, du cerveau et d'autres organes. Les écrans ont identifié des rôles pour les canaux ioniques dans le contrôle de la taille de structures telles que la nageoire du poisson zèbre, tandis que des études ciblées sur le gain de fonction ont montré par exemple que les parties du corps peuvent être re-spécifiées au niveau de l'organe - par exemple en créant des yeux entiers dans l' endoderme intestinal . Comme dans le cerveau, la bioélectricité du développement peut intégrer des informations sur une distance importante dans l'embryon, par exemple le contrôle de la taille du cerveau par les états bioélectriques du tissu ventral. et le contrôle de la tumorigenèse au site d'expression des oncogènes par l'état bioélectrique de cellules distantes.
Les troubles humains, ainsi que de nombreux mutants de souris montrent que la signalisation bioélectrique est importante pour le développement humain (tableaux 1 et 2). Ces effets sont largement liés aux canalopathies, qui sont des troubles humains résultant de mutations qui perturbent les canaux ioniques.
Plusieurs canalopathies entraînent des anomalies morphologiques ou des malformations congénitales en plus des symptômes qui affectent les muscles et/ou les neurones. Par exemple, les mutations qui perturbent un canal potassique à rectification interne Kir2.1 provoquent le syndrome d'Andersen-Tawil (ATS) héréditaire dominant . Les patients atteints de STA présentent une paralysie périodique , des arythmies cardiaques et de multiples anomalies morphologiques pouvant inclure une fente ou un palais arqué, une fente ou une lèvre supérieure mince, un philtrum aplati , une micrognathie , une oligodontie dentaire , une hypoplasie de l'émail, une éruption dentaire retardée, une malocclusion, un front large, un ensemble large yeux, oreilles placées bas, syndactylie , clinodactylie , brachydactylie et reins dysplasiques . Des mutations qui perturbent un autre canal K+ à rectification interne Girk2 codé par KCNJ6 provoquent un syndrome de Keppen-Lubinsky qui comprend une microcéphalie , un pont nasal étroit, un palais arqué et une lipodystrophie généralisée sévère (échec à générer du tissu adipeux). KCNJ6 se trouve dans la région critique du syndrome de Down , de sorte que les duplications qui incluent cette région entraînent des anomalies craniofaciales et des membres et les duplications qui n'incluent pas cette région n'entraînent pas de symptômes morphologiques du syndrome de Down. Des mutations dans KCNH1 , un canal potassique voltage-dépendant, conduisent au syndrome de Temple-Baraitser (également connu sous le nom de Zimmermann-Laband ). Les caractéristiques communes du syndrome de Temple-Baraitser comprennent l'absence ou l'hypoplasie des ongles et des phalanges des doigts et des orteils et une instabilité articulaire. Les défauts craniofaciaux associés aux mutations de KCNH1 comprennent une fente palatine ou un palais arqué, un hypertélorisme , des oreilles dysmorphiques, un nez dysmorphique, une hypertrophie gingivale et un nombre anormal de dents.
Des mutations dans CaV1.2 , un canal Ca2+ voltage-dépendant, conduisent au syndrome de Timothy qui provoque une arythmie cardiaque sévère (QT long) ainsi qu'une syndactylie et des défauts craniofaciaux similaires au syndrome d'Andersen-Tawil, notamment une fente palatine ou un palais arqué, une micrognathie, un ensemble bas oreilles, syndactylie et brachydactylie. Bien que ces canalopathies soient rares, elles montrent que les canaux ioniques fonctionnels sont importants pour le développement. De plus, l'exposition in utero à des médicaments antiépileptiques qui ciblent certains canaux ioniques entraîne également une incidence accrue de malformations congénitales telles que la fente buccale. Les effets de la perturbation génétique et exogène des canaux ioniques donnent un aperçu de l'importance de la signalisation bioélectrique dans le développement.
Rôle dans la cicatrisation et le guidage cellulaire
L'un des rôles les mieux compris des gradients bioélectriques se situe au niveau des champs électriques endogènes au niveau des tissus utilisés pendant la cicatrisation des plaies. Il est difficile d'étudier les champs électriques associés aux plaies, car ces champs sont faibles, moins fluctuants et n'ont pas de réponses biologiques immédiates par rapport aux impulsions nerveuses et à la contraction musculaire. Le développement des microélectrodes vibrantes et de verre a démontré que les plaies produisaient effectivement et, surtout, des courants électriques et des champs électriques mesurables. Ces techniques permettent une caractérisation plus poussée des champs/courants électriques de la plaie au niveau des plaies cornéennes et cutanées, qui présentent des caractéristiques spatiales et temporelles actives, suggérant une régulation active de ces phénomènes électriques. Par exemple, les courants électriques de la plaie sont toujours les plus forts au bord de la plaie, qui ont progressivement augmenté pour atteindre un pic environ 1 heure après la blessure. Au niveau des plaies chez les animaux diabétiques , les champs électriques de la plaie sont considérablement compromis. La compréhension des mécanismes de génération et de régulation des courants/champs électriques de la plaie devrait révéler de nouvelles approches pour manipuler l'aspect électrique pour une meilleure cicatrisation des plaies.
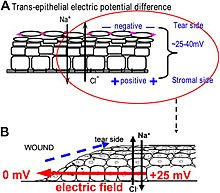
Comment sont produits les champs électriques au niveau d'une plaie ? Les épithéliums pompent activement et séparent les ions de manière différentielle. Dans l'épithélium cornéen, par exemple, Na+ et K+ sont transportés vers l'intérieur du liquide lacrymal au liquide extracellulaire, et Cl− est transporté hors du liquide extracellulaire dans le liquide lacrymal. Les cellules épithéliales sont reliées par des jonctions serrées, formant la principale barrière électrique résistive, et établissant ainsi un gradient électrique à travers l'épithélium - le potentiel transépithélial (TEP). Briser la barrière épithéliale, comme cela se produit dans toutes les plaies, crée un trou qui brise la résistance électrique élevée établie par les jonctions serrées dans la feuille épithéliale, court-circuitant l'épithélium localement. Le TEP tombe donc à zéro au niveau de la plaie. Cependant, le transport normal des ions se poursuit dans les cellules épithéliales non blessées au-delà du bord de la plaie (généralement à moins de 1 mm), entraînant un flux de charge positif hors de la plaie et établissant un champ électrique (EF) stable et orienté latéralement avec la cathode au niveau de la plaie. La peau génère également un TEP, et lorsqu'une plaie cutanée est faite, des courants et des champs électriques de plaie similaires apparaissent, jusqu'à ce que la fonction de barrière épithéliale se rétablisse pour mettre fin au court-circuit au niveau de la plaie. Lorsque les champs électriques de la plaie sont manipulés avec des agents pharmacologiques qui stimulent ou inhibent le transport des ions, les champs électriques de la plaie augmentent ou diminuent également, respectivement. La cicatrisation des plaies peut être accélérée ou ralentie en conséquence dans les plaies cornéennes.
Comment les champs électriques affectent-ils la cicatrisation des plaies ? Pour cicatriser les plaies, les cellules entourant la plaie doivent migrer et croître de manière directionnelle dans la plaie pour couvrir le défaut et restaurer la barrière. Les cellules importantes pour la cicatrisation des plaies répondent remarquablement bien aux champs électriques appliqués de la même force que ceux mesurés au niveau des plaies. Toute la gamme des types cellulaires et leurs réponses à la suite d'une blessure sont affectées par les champs électriques physiologiques. Ceux-ci comprennent la migration et la division des cellules épithéliales, la germination et l'extension des nerfs, et la migration des leucocytes et des cellules endothéliales. Le comportement cellulaire le plus étudié est la migration directionnelle des cellules épithéliales dans les champs électriques – électrotaxie . Les cellules épithéliales migrent directionnellement vers le pôle négatif (cathode), qui au niveau d'une plaie est la polarité de champ des champs électriques vectoriels endogènes dans l'épithélium, pointant (de positif à négatif) vers le centre de la plaie. Les cellules épithéliales de la cornée, les kératinocytes de la peau et de nombreux autres types de cellules présentent une migration directionnelle à des intensités de champ électrique aussi faibles que quelques mV mm-1. De grandes feuilles de cellules épithéliales monocouches et des feuilles de cellules épithéliales multicouches stratifiées migrent également de manière directionnelle. Un tel mouvement collectif ressemble étroitement à ce qui se passe lors de la cicatrisation in vivo, où les feuilles de cellules se déplacent collectivement dans le lit de la plaie pour couvrir la plaie et restaurer la fonction barrière de la peau ou de la cornée.
La façon dont les cellules détectent des champs électriques extracellulaires aussi infimes reste largement insaisissable. Des recherches récentes ont commencé à identifier certains éléments génétiques, de signalisation et structurels qui sous-tendent la façon dont les cellules détectent et répondent à de petits champs électriques physiologiques. Ceux-ci comprennent les canaux ioniques, les voies de signalisation intracellulaires, les radeaux lipidiques membranaires et l'électrophorèse des composants de la membrane cellulaire.
Rôle dans la régénération animale
Au début du 20e siècle, Albert Mathews a corrélé de manière séminale la régénération d'un polype cnidaire avec la différence de potentiel entre les surfaces du polype et du stolon , et a affecté la régénération en imposant des contre-courants. Amedeo Herlitzka, suivant les traces des courants électriques enroulés de son mentor, du Bois-Raymond, a théorisé sur les courants électriques jouant un rôle précoce dans la régénération, initiant peut-être la prolifération cellulaire. En utilisant des champs électriques supplantant les champs endogènes, Marsh et Beams ont étonnamment généré des planaires à deux têtes et ont même complètement inversé la polarité du corps primaire, avec des queues poussant là où une tête existait auparavant. Après ces études sur les semences, des variations de l'idée que la bioélectricité pourrait détecter des blessures et déclencher ou du moins être un acteur majeur de la régénération ont stimulé au fil des décennies jusqu'à nos jours. Une explication potentielle réside dans les potentiels de repos (principalement Vmem et TEP), qui peuvent être, au moins en partie, des capteurs dormants (alarmes) prêts à détecter et des effecteurs (déclencheurs) prêts à réagir aux dommages locaux.
Suite au succès relatif de la stimulation électrique sur la régénération non permissive des cuisses de grenouilles à l'aide d'une tige bimétallique implantée à la fin des années 1960, l'aspect extracellulaire bioélectrique de la régénération des membres d'amphibiens a été largement disséqué au cours des décennies suivantes. Des données physiologiques descriptives et fonctionnelles définitives ont été rendues possibles grâce au développement de la sonde vibrante ultra-sensible et de dispositifs d'application améliorés. L'amputation conduit invariablement à un courant sortant induit par la peau et à un champ électrique latéral conséquent fixant la cathode au site de la plaie. Bien qu'initialement une fuite d'ions pure, un composant actif finit par se produire et le blocage des translocateurs d'ions altère généralement la régénération. En utilisant des courants et des champs électriques exogènes biomimétiques, une régénération partielle a été obtenue, qui comprenait généralement une croissance tissulaire et une augmentation du tissu neuronal. Inversement, empêcher ou inverser le courant et les champs électriques endogènes nuit à la régénération. Ces études sur la régénération des membres d'amphibiens et les études connexes chez les lamproies et les mammifères, combinées à celles de la guérison des fractures osseuses et aux études in vitro , ont conduit à la règle générale selon laquelle les cellules migrent (comme les kératinocytes, les leucocytes et les cellules endothéliales) et deviennent trop grandes (comme les axones) contribuant à la régénération subissent une électrotaxie vers la cathode (lésion du site d'origine). De manière congruente, une anode est associée à une résorption ou à une dégénérescence tissulaire, comme cela se produit lors d'une altération de la régénération et d'une résorption ostéoclastique dans l'os. Malgré ces efforts, la promesse d'une régénération épimorphique significative chez les mammifères reste une frontière majeure pour les efforts futurs, qui comprend l'utilisation de bioréacteurs portables pour fournir un environnement dans lequel les états bioélectriques pro-régénératifs peuvent être pilotés et les efforts continus de stimulation électrique.
Des travaux moléculaires récents ont identifié les flux de protons et de sodium comme étant importants pour la régénération de la queue des têtards de Xenopus , et ont montré que la régénération de la queue entière (avec la moelle épinière, les muscles, etc.) pouvait être déclenchée dans une gamme de conditions normalement non régénératives par méthodes de génétique moléculaire, pharmacologique ou optogénétique. Chez les planaires , les travaux sur le mécanisme bioélectrique ont révélé le contrôle du comportement des cellules souches, le contrôle de la taille pendant le remodelage, la polarité antéro-postérieure et la forme de la tête. L'altération de la signalisation physiologique médiée par les jonctions lacunaires produit des vers à 2 têtes chez Dugesia japonica ; remarquablement, ces animaux continuent à se régénérer en tant que bicéphales dans les prochains cycles de régénération des mois après que le réactif bloquant les jonctions lacunaires a quitté le tissu. Cette altération stable et à long terme de la disposition anatomique à laquelle les animaux se régénèrent, sans édition génomique, est un exemple d'héritage épigénétique du modèle corporel, et est également la seule «souche» disponible d'espèces planaires présentant un changement anatomique hérité qui est différent du type sauvage.

Rôle dans le cancer
La défection des cellules de la coordination normalement étroite de l'activité vers une structure anatomique entraîne le cancer; il n'est donc pas surprenant que la bioélectricité - un mécanisme clé pour coordonner la croissance et la structuration des cellules - soit une cible souvent impliquée dans le cancer et les métastases. En effet, on sait depuis longtemps que les jonctions communicantes ont un rôle clé dans la cancérogenèse et la progression. Les canaux peuvent se comporter comme des oncogènes et conviennent donc comme nouvelles cibles médicamenteuses. Des travaux récents dans des modèles d'amphibiens ont montré que la dépolarisation du potentiel de repos peut déclencher un comportement métastatique dans les cellules normales, tandis que l'hyperpolarisation (induite par une mauvaise expression des canaux ioniques, des médicaments ou la lumière) peut supprimer la tumorigenèse induite par l'expression d'oncogènes humains. La dépolarisation du potentiel de repos semble être une signature bioélectrique par laquelle les sites tumoraux naissants peuvent être détectés de manière non invasive. L'affinement de la signature bioélectrique du cancer dans des contextes biomédicaux, en tant que modalité de diagnostic, est l'une des applications possibles de ce domaine. De manière intéressante, l'ambivalence de la polarité – la dépolarisation comme marqueur et l'hyperpolarisation comme traitement – permet conceptuellement de dériver des approches théragnostiques (portmanteau de thérapeutique avec diagnostic), conçues pour détecter et traiter simultanément les tumeurs précoces, dans ce cas basées sur la normalisation de la membrane. polarisation.
Rôle dans la régulation des modèles
Des expériences récentes utilisant des médicaments ouvreurs/bloquants de canaux ioniques, ainsi qu'une mauvaise expression des canaux ioniques dominants, dans une gamme d'espèces modèles, ont montré que la bioélectricité, en particulier, les gradients de tension instruisent non seulement le comportement des cellules souches, mais également la structuration à grande échelle. Les signaux de structuration sont souvent médiés par des gradients spatiaux de potentiels de repos cellulaire, ou Vmem, qui peuvent être transformés en cascades de second messager et en changements transcriptionnels par une poignée de mécanismes connus (figure 7). Ces potentiels sont définis par la fonction des canaux ioniques et des pompes, et façonnés par des connexions à jonctions lacunaires qui établissent des compartiments de développement (champs cellulaires isopotentiels). Étant donné que les jonctions communicantes et les canaux ioniques sont eux-mêmes sensibles à la tension, les groupes de cellules mettent en œuvre des circuits électriques dotés de capacités de rétroaction riches (Figure 8). Les résultats de la dynamique bioélectrique du développement in vivo représentent des décisions de structuration à grande échelle telles que le nombre de têtes dans les planaires, la forme du visage dans le développement de la grenouille et la taille des queues chez le poisson zèbre. La modulation expérimentale des pré-modèles bioélectriques endogènes a permis de convertir des régions du corps (telles que l'intestin) en un œil complet (figure 9), induisant la régénération d'appendices tels que les queues de têtard dans des contextes non régénératifs et la conversion des formes et du contenu de la tête des vers plats en motifs approprié à d'autres espèces de vers plats, malgré un génome normal. Des travaux récents ont montré l'utilisation d'environnements de modélisation physiologique pour identifier des interventions prédictives visant à cibler des états bioélectriques pour la réparation d'anomalies cérébrales embryonnaires sous une gamme de tératologies génétiques et pharmacologiquement induites.
Avenir du domaine
La vie est finalement une entreprise électrochimique ; la recherche dans ce domaine progresse sur plusieurs fronts. Le premier est le programme réducteur consistant à comprendre comment les signaux bioélectriques sont produits, comment les changements de tension dans la membrane cellulaire sont capables de réguler le comportement cellulaire et quelles sont les cibles génétiques et épigénétiques en aval des signaux bioélectriques. Quelques mécanismes qui transforment le changement bioélectrique en altérations de l'expression des gènes sont déjà connus, notamment le contrôle bioélectrique du mouvement de petites molécules du second messager à travers les cellules, notamment la sérotonine et le butyrate, des phosphatases sensibles au voltage, entre autres. On connaît également de nombreuses cibles génétiques de la signalisation de tension, telles que Notch , BMP , FGF et HIF-1α . Ainsi, les mécanismes proximaux de la signalisation bioélectrique au sein des cellules individuelles deviennent bien compris, et les progrès de l' optogénétique et de la magnétogénétique continuent de faciliter ce programme de recherche. Plus difficile cependant est le programme intégratif de compréhension de la façon dont des modèles spécifiques de dynamique bioélectrique aident à contrôler les algorithmes qui accomplissent une régulation de modèle à grande échelle (régénération et développement d'une anatomie complexe). L'incorporation de la bioélectricité avec la signalisation chimique dans le domaine émergent de l'exploration de la perception sensorielle des cellules et de la prise de décision est une frontière importante pour les travaux futurs.
La modulation bioélectrique a montré un contrôle sur la morphogenèse et le remodelage complexes, et pas seulement sur la définition de l'identité cellulaire individuelle. De plus, un certain nombre de résultats clés dans ce domaine ont montré que les circuits bioélectriques ne sont pas locaux - les régions du corps prennent des décisions basées sur des événements bioélectriques à une distance considérable. De tels événements non cellulaires suggèrent des modèles de réseau distribué de contrôle bioélectrique ; de nouveaux paradigmes informatiques et conceptuels devront peut-être être développés pour comprendre le traitement de l'information spatiale dans les tissus bioélectriquement actifs. Il a été suggéré que les résultats des domaines de la cognition primitive et du calcul non conventionnel sont pertinents pour le programme de craquage du code bioélectrique. Enfin, les efforts en biomédecine et en bio-ingénierie développent des applications telles que des bioréacteurs portables pour fournir des réactifs modificateurs de tension aux sites de plaies et des médicaments modificateurs de canaux ioniques (une sorte d'électroceutique) pour la réparation des malformations congénitales et la réparation régénérative. Les biologistes synthétiques commencent également à incorporer des circuits bioélectriques dans des constructions hybrides.
Tableau 1 : Canaux ioniques et pompes impliqués dans la structuration
| Protéine | Rôle morphogénétique ou phénotype LOF (perte de fonction) | Espèce | Référence |
|---|---|---|---|
| TRH1 K + transporteur | Modelage des poils racinaires | Arabidopsis | |
| Canal Kir2.1potassium | Motif d'aile | Drosophile | |
| Kir7.1 K + canal | Modélisation craniofaciale, développement pulmonaire | Mus musculus | |
| NHE2 Na + / H + échangeur | Motif épithélial | Drosophile | |
| Pompe à protons V-ATPase | Modelage des poils des ailes, Pigmentation et modelage du cerveau, Modelage craniofacial | Drosophile, Oryzias latipes, Homo sapiens | |
| HCN1, Kv3.1 K + canaux | Modélisation du cerveau antérieur | Mus musculus | |
| KCNC1 K + canal | Déficits de croissance | Mus musculus | |
| TWIK-1 K + canal (KCNK1) | Taille cardiaque (auriculaire) | Mus musculus | |
| KCNJ6 K + canal | Syndrome de Keppen-Lubinsky – craniofacial et cérébral | Homo sapiens | |
| KCNH1 (hEAG1) Canal K + et pompe à protons ATP6V1B2 V-ATPase | Syndrome de Zimmermman-Laband et Temple-Baraitser – anomalies craniofaciales et cérébrales, dysplasie/aplasie des ongles du pouce et du gros orteil. | Homo sapiens | |
| canal chlorure GLRa4 | Anomalies craniofaciales | Homo sapiens | |
| KCNJ8 K + | Syndrome de Cantu – visage, cœur, squelette, malformations cérébrales | Homo sapiens | |
| NALCN (Na + canal de fuite) | Syndrome de Freeman-Sheldon – membres, visage, cerveau | Homo sapiens | |
| Canal chlorure CFTR | Absence bilatérale de canal déférent | Homo sapiens | |
| KCNC1 | Dysmorphies tête/visage | Homo sapiens | |
| KCNK9, TASK3 K + canaux | Syndrome de dysmorphie de Birk-Barel - défauts cranio-faciaux, défauts du cerveau (structuration corticale) | Homo sapiens | |
| Kir6.2 K + canal | Défauts craniofaciaux | Homo sapiens | |
| Canal KCNQ1 K + (via la régulation épigénétique) | Hypertrophie de la langue, du foie, de la rate, du pancréas, des reins, des glandes surrénales, des organes génitaux – syndrome de Beckwith-Wiedemann ; malformations craniofaciales et des membres, développement précoce | Homo sapiens, Mus musculus, Drosophile | |
| KCNQ1 K + canal | Syndrome de Jervell et Lange-Nielsen - oreille interne et membre | Homo sapiens, Mus musculus | |
| Kir2.1 K + canal (KNCJ2) | Syndrome d'Andersen-Tawil – craniofacial, membre, côtes | Homo sapiens, Mus musculus | |
| Récepteur GABA-A (canal chlorure) | Syndrome d'Angelman - craniofacial (par exemple, fente palatine) et modelage de la main | Homo sapiens, Mus musculus | |
| Canal chlorure TMEM16A | Morphogenèse trachéale | Mus musculus | |
| Girk2 K + canal | Défauts de développement cérébelleux | Mus musculus | |
| KCNH2 K + canal | Défauts de structuration cardiaque et craniofaciale | Mus musculus | |
| KCNQ1 K + canal | Anomalies du rectum, du pancréas et de l'estomac | Mus musculus | |
| NaV1.2 | Défauts de réparation musculaire et nerveuse | Xénope | |
| Kir6.1 K + canal | Défauts de structuration des yeux | Xénope | |
| Pompe ionique V-ATPase | Défauts d'asymétrie gauche-droite, réparation musculaire et nerveuse | Xenopus, Gallus gallus domesticus, Danio rerio | |
| Pompe ionique H,K-ATPase | Défauts d'asymétrie gauche-droite | Xénope, Echinoidea | |
| Kir7.1 K + canal | Défauts de développement des mélanosomes | Danio rerio | |
| Canaux Kv | Régulation de la taille des nageoires, régulation de la taille du cœur | Danio rerio, Mus musculus | |
| NaV 1.5, Na + /K + -ATPase | Morphogenèse cardiaque | Danio rerio | |
| KCNC3 | Les mutations dominantes provoquent une dysplasie cérébelleuse chez l'homme et des défauts de la nervation des ailes et des yeux chez la drosophile. | Homo sapiens, Drosophile |
Tableau 2 : Jonctions interstitiels impliquées dans la structuration
| Gap Junction Protéine | Rôle morphogénétique ou phénotype LOF | Espèce | Les références |
|---|---|---|---|
| Innexins | Morphogenèse des gonades et de la lignée germinale | C. Elegans | |
| Innexin1,2 | Modelage des cuticules (épithéliales), développement de l'intestin antérieur | Drosophile | |
| Innexin 2 | Taille des yeux | Drosophile | |
| Cx43 | Dysplasie oculodentodigitale (ODDD), malformations cardiaques (voie d'éjection et conotronc), randomisation d'asymétrie gauche-droite, problèmes de différenciation des ostéoblastes, malformations craniofaciales, myogenèse | Homo sapiens, Mus musculus, Gallus gallus domesticus | |
| Cx37 | Modélisation du système lymphatique | Mus musculus | |
| Cx45 | Défauts cardiaques (coussin) | Mus musculus | |
| Cx50, Cx46 | Défauts oculaires (problèmes de différenciation et de prolifération, notamment du cristallin), | Mus musculus | |
| Cx26 | Défauts de développement cochléaire | Mus musculus | |
| Cx41.8 | Défauts de pigmentation | Danio rerio | |
| Cx43 | Régulation de la taille et de la configuration des nageoires Syndrome craniofrontonasal |
Danio rerio, Mus musculus | |
| Inx4, Inx2 | Différenciation germinale et spermatogenèse | Drosophile | |
| Pannexin3 | Développement squelettique | Mus musculus |
Tableau 3 : Oncogènes des canaux ioniques
| Protéine | Espèce | Les références | Cancer-rôle |
|---|---|---|---|
| NaV 1.5 canal | Homo sapiens | Oncogène | |
| Canaux potassiques ERG | Homo sapiens | Oncogène | |
| 9 canaux potassiques | Mus musculus | Oncogène | |
| Ductine (composant proton V-ATPase) | Mus musculus | Oncogène | |
| Transporteur de sodium/butyrate SLC5A8 | Homo sapiens | Oncogène | |
| canal potassique KCNE2 | Mus musculus | Oncogène | |
| Canal potassique KCNQ1 | Homo sapiens , souris | Oncogène | |
| Canal sodium voltage-dépendant SCN5A | Homo sapiens | Oncogène | |
| Récepteur métabotropique du glutamate | Mus musculus , Humain | Oncogène | |
| Canal chlorure CFTR | Homo sapiens | Suppresseur de tumeur | |
| Connexin43 | Homo sapiens | Suppresseur de tumeur | |
| BKCa | Homo sapiens | Oncogène | |
| Récepteur muscarinique de l'acétylcholine | Homo sapiens, Mus musculus | Suppresseur de tumeur | |
| KCNJ3 (Girk) | Homo sapiens | Oncogène |