Film de sang - Blood film
| Film de sang | |
|---|---|
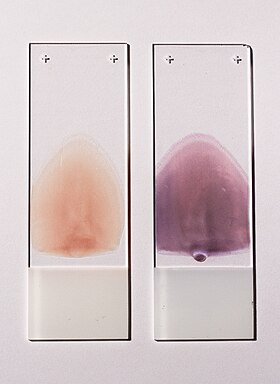 Deux frottis sanguins périphériques de type push adaptés à la caractérisation des éléments sanguins cellulaires. Le frottis gauche n'est pas coloré, le frottis droit est coloré avec le colorant Wright-Giemsa.
| |
| CIM-9-CM | 90,5 |
| MedlinePlus | 003665 |
Un film de sang -ou frottis de sang périphérique -est une mince couche de sang étalé sur un verre lame de microscope et ensuite coloré de manière à permettre les différentes cellules sanguines pour être examinées au microscope. Les frottis sanguins sont examinés dans le cadre de l'investigation des troubles hématologiques (sang) et sont couramment utilisés pour rechercher des parasites sanguins , tels que ceux du paludisme et de la filariose .
Préparation
Les frottis sanguins sont réalisés en plaçant une goutte de sang sur une extrémité d'une lame et en utilisant une lame d' étalement pour disperser le sang sur toute la longueur de la lame. L'objectif est d'obtenir une région, appelée monocouche, où les cellules sont suffisamment espacées pour être comptées et différenciées. La monocouche se trouve dans le "bord à plumes" créé par la glissière d'écartement lorsqu'elle tire le sang vers l'avant.
La lame est laissée à sécher à l'air, après quoi le sang est fixé sur la lame en la plongeant brièvement dans du méthanol . Le fixateur est essentiel pour une bonne coloration et une bonne présentation des détails cellulaires. Après fixation, la lame est colorée pour distinguer les cellules les unes des autres.
L' analyse de routine du sang dans les laboratoires médicaux est généralement réalisée sur des films sanguins colorés avec des taches Romanowsky telles que la coloration de Wright , Giemsa , ou Diff-Quik . La teinture combinée Wright-Giemsa est également un choix populaire. Ces colorations permettent de détecter les anomalies des globules blancs , des globules rouges et des plaquettes . Les hématopathologistes utilisent souvent d'autres colorations spécialisées pour faciliter le diagnostic différentiel des troubles sanguins.
Après coloration, la monocouche est observée au microscope en utilisant un grossissement jusqu'à 1000x. Les cellules individuelles sont examinées et leur morphologie est caractérisée et enregistrée.
Signification clinique
L'examen des frottis sanguins est généralement effectué en conjonction avec une numération globulaire complète afin d'enquêter sur des résultats anormaux ou de confirmer des résultats que l' analyseur automatisé a signalés comme non fiables.
L'examen microscopique de la forme, de la taille et de la coloration des globules rouges est utile pour déterminer la cause de l' anémie . Des troubles tels que l'anémie ferriprive , la drépanocytose , l'anémie mégaloblastique et l'anémie hémolytique microangiopathique entraînent des anomalies caractéristiques sur le frottis sanguin.
Les proportions des différents types de globules blancs peuvent être déterminées à partir du frottis sanguin. C'est ce qu'on appelle un différentiel manuel de globules blancs . Le différentiel de globules blancs peut révéler des anomalies dans les proportions de types de globules blancs, telles que la neutrophilie et l' éosinophilie , ainsi que la présence de cellules anormales telles que les cellules blastiques circulantes observées dans la leucémie aiguë . Des anomalies qualitatives des globules blancs, comme une granulation toxique , sont également visibles sur le frottis sanguin. Les analyseurs de numération formule sanguine modernes peuvent fournir un différentiel automatisé de globules blancs, mais ils ont une capacité limitée à différencier les cellules immatures et anormales, de sorte qu'un examen manuel du frottis sanguin est fréquemment indiqué.
L'examen des frottis sanguins est la méthode de diagnostic privilégiée pour certaines infections parasitaires, telles que le paludisme et la babésiose . Rarement, des bactéries peuvent être visibles sur le frottis sanguin chez les patients atteints de sepsis sévère .
Paludisme

Le diagnostic préféré et le plus fiable du paludisme est l'examen microscopique des frottis sanguins, car chacune des quatre principales espèces de parasites a des caractéristiques distinctives. Deux sortes de frottis sanguins sont traditionnellement utilisés.
- Les films minces sont similaires aux frottis sanguins habituels et permettent l'identification des espèces, car l'apparence du parasite est mieux préservée dans cette préparation.
- Les films épais permettent au microscopiste de dépister un plus grand volume de sang et sont environ onze fois plus sensibles que le film mince, de sorte qu'il est plus facile de détecter de faibles niveaux d'infection sur le film épais, mais l'apparence du parasite est beaucoup plus déformée et donc la distinction entre les différentes espèces peut être beaucoup plus difficile.
À partir de la couche épaisse, un microscopiste expérimenté peut détecter tous les parasites qu'il rencontre. Le diagnostic microscopique peut être difficile car les trophozoïtes précoces ("forme en anneau") des quatre espèces semblent identiques et il n'est jamais possible de diagnostiquer les espèces sur la base d'une seule forme en anneau ; l'identification des espèces est toujours basée sur plusieurs trophozoïtes.
Le plus gros écueil dans la plupart des laboratoires des pays développés est de laisser un délai trop important entre le prélèvement sanguin et la réalisation des frottis sanguins. Lorsque le sang se refroidit à température ambiante, les gamétocytes mâles se divisent et libèrent des microgamètes : ce sont de longues structures filamenteuses sinueuses qui peuvent être confondues avec des organismes tels que Borrelia . Si le sang est maintenu à des températures plus chaudes, les schizontes se rompront et les mérozoïtes envahissant les érythrocytes donneront par erreur l'apparence de la forme accolé de P. falciparum . Si P. vivax ou P. ovale est laissé plusieurs heures dans l'EDTA, l'accumulation d'acide dans l'échantillon provoquera le rétrécissement des érythrocytes parasités et le parasite s'enroulera, simulant l'apparition de P. malariae . Ce problème est aggravé si des anticoagulants tels que l' héparine ou le citrate sont utilisés. L'anticoagulant qui cause le moins de problèmes est l' EDTA . La coloration Romanowsky ou une variante de coloration est généralement utilisée. Certains laboratoires utilisent à tort le même pH de coloration que pour les frottis sanguins d'hématologie de routine ( pH 6,8) : les frottis sanguins du paludisme doivent être colorés à pH 7,2, sinon les points de Schüffner et de James ne seront pas visibles.
Les procédures de capture immunochromatographique (tests de diagnostic rapide tels que les tests de détection de l'antigène du paludisme ) sont des options de diagnostic non microscopiques pour le laboratoire qui peut ne pas disposer d'une expertise en microscopie appropriée.




