Carcinogenèse - Carcinogenesis

La cancérogenèse, également appelée oncogenèse ou tumorigenèse, est la formation d'un cancer , par lequel les cellules normales sont transformées en cellules cancéreuses . Le processus est caractérisé par des changements aux niveaux cellulaire, génétique et épigénétique et une division cellulaire anormale . La division cellulaire est un processus physiologique qui se produit dans presque tous les tissus et dans diverses circonstances. Normalement, l'équilibre entre la prolifération et la mort cellulaire programmée, sous forme d' apoptose , est maintenu pour assurer l'intégrité des tissus et des organes . Selon la théorie dominante acceptée de la cancérogenèse, la théorie de la mutation somatique, les mutations de l' ADN et les épimutations qui conduisent au cancer perturbent ces processus ordonnés en interférant avec la programmation régulant les processus, bouleversant l'équilibre normal entre la prolifération et la mort cellulaire. Il en résulte une division cellulaire incontrôlée et l' évolution de ces cellules par sélection naturelle dans le corps. Seules certaines mutations conduisent au cancer alors que la majorité des mutations ne le font pas.
Des variantes de gènes héréditaires peuvent prédisposer les individus au cancer. De plus, des facteurs environnementaux tels que les agents cancérigènes et les radiations provoquent des mutations qui peuvent contribuer au développement du cancer. Enfin, des erreurs aléatoires dans la réplication normale de l'ADN peuvent entraîner des mutations cancérigènes. Une série de plusieurs mutations de certaines classes de gènes est généralement nécessaire avant qu'une cellule normale ne se transforme en cellule cancéreuse . En moyenne, par exemple, 15 "mutations de conducteur" et 60 mutations de "passager" sont trouvées dans les cancers du côlon. Des mutations dans les gènes qui régulent la division cellulaire, l' apoptose (mort cellulaire) et la réparation de l'ADN peuvent entraîner une prolifération cellulaire incontrôlée et le cancer.
Le cancer est fondamentalement une maladie de régulation de la croissance des tissus. Pour qu'une cellule normale se transforme en cellule cancéreuse, les gènes qui régulent la croissance et la différenciation cellulaires doivent être modifiés. Des changements génétiques et épigénétiques peuvent se produire à de nombreux niveaux, allant du gain ou de la perte de chromosomes entiers à une mutation affectant un seul nucléotide de l'ADN , ou au silence ou à l'activation d'un microARN qui contrôle l'expression de 100 à 500 gènes. Il existe deux grandes catégories de gènes qui sont affectés par ces changements. Les oncogènes peuvent être des gènes normaux qui sont exprimés à des niveaux anormalement élevés, ou des gènes altérés qui ont de nouvelles propriétés. Dans les deux cas, l'expression de ces gènes favorise le phénotype malin des cellules cancéreuses. Les gènes suppresseurs de tumeurs sont des gènes qui inhibent la division cellulaire, la survie ou d'autres propriétés des cellules cancéreuses. Les gènes suppresseurs de tumeurs sont souvent désactivés par des modifications génétiques favorisant le cancer. Enfin les Oncovirinae , virus qui contiennent un oncogène , sont catégorisés comme oncogènes car ils déclenchent la croissance de tissus tumoraux chez l' hôte . Ce processus est également appelé transformation virale .
Causes
Génétique et épigénétique
Il existe un système de classification diversifié pour les divers changements génomiques qui peuvent contribuer à la génération de cellules cancéreuses . Beaucoup de ces changements sont des mutations ou des changements dans la séquence nucléotidique de l'ADN génomique. Il existe également de nombreux changements épigénétiques qui modifient si les gènes sont exprimés ou non. L'aneuploïdie , la présence d'un nombre anormal de chromosomes, est un changement génomique qui n'est pas une mutation, et peut impliquer le gain ou la perte d'un ou plusieurs chromosomes par des erreurs de mitose . Les mutations à grande échelle impliquent soit la délétion, soit la duplication d'une partie d'un chromosome. L'amplification génomique se produit lorsqu'une cellule obtient de nombreuses copies (souvent 20 ou plus) d'une petite région chromosomique, contenant généralement un ou plusieurs oncogènes et du matériel génétique adjacent. La translocation se produit lorsque deux régions chromosomiques distinctes fusionnent de manière anormale, souvent à un emplacement caractéristique. Un exemple bien connu de ceci est le chromosome Philadelphie , ou translocation des chromosomes 9 et 22 , qui se produit dans la leucémie myéloïde chronique et entraîne la production de la protéine de fusion BCR - abl , une tyrosine kinase oncogène . Les mutations à petite échelle comprennent les mutations ponctuelles , les délétions et les insertions , qui peuvent se produire dans le promoteur d'un gène et affecter son expression , ou peuvent se produire dans la séquence codante du gène et altérer la fonction ou la stabilité de son produit protéique . La perturbation d'un seul gène peut également résulter de l' intégration de matériel génomique provenant d'un virus à ADN ou d'un rétrovirus , et un tel événement peut également entraîner l'expression d'oncogènes viraux dans la cellule affectée et ses descendants.
Dommages à l'ADN
Les dommages à l'ADN sont considérés comme la principale cause de cancer. Plus de 60 000 nouveaux cas naturels de dommages à l'ADN surviennent, en moyenne, par cellule humaine, par jour, en raison de processus cellulaires endogènes (voir article Dommages à l'ADN (naturels) ).
Des dommages supplémentaires à l'ADN peuvent résulter d'une exposition à des agents exogènes . À titre d'exemple d' agent cancérigène exogène , la fumée de tabac provoque une augmentation des dommages à l'ADN, et ces dommages à l'ADN provoquent probablement une augmentation du cancer du poumon dû au tabagisme. Dans d'autres exemples, la lumière UV du rayonnement solaire provoque des dommages à l'ADN qui sont importants dans le mélanome , l' infection à Helicobacter pylori produit des niveaux élevés d' espèces réactives de l'oxygène qui endommagent l'ADN et contribuent au cancer gastrique , et l' aflatoxine métabolite Aspergillus flavus est un agent endommageant l'ADN qui est causal du cancer du foie.
Les dommages à l'ADN peuvent également être causés par des substances produites dans le corps . Les macrophages et les neutrophiles dans un épithélium colique enflammé sont la source d'espèces réactives de l'oxygène causant les dommages à l'ADN qui initient la tumorigenèse colique , et les acides biliaires, à des niveaux élevés dans le côlon des humains suivant un régime riche en graisses, causent également des dommages à l'ADN et contribuent à cancer du colon.
Ces sources exogènes et endogènes de dommages à l'ADN sont indiquées dans les encadrés en haut de la figure de cette section. Le rôle central des dommages à l'ADN dans la progression vers le cancer est indiqué au deuxième niveau de la figure. Les éléments centraux des dommages à l'ADN, des altérations épigénétiques et de la réparation déficiente de l'ADN au cours de la progression vers le cancer sont indiqués en rouge.
Une déficience dans la réparation de l'ADN entraînerait l'accumulation de plus de dommages à l'ADN et augmenterait le risque de cancer. Par exemple, les personnes atteintes d'une déficience héréditaire de l'un des 34 gènes de réparation de l'ADN (voir l'article Trouble de la réparation de l'ADN par déficit ) courent un risque accru de cancer, certains défauts provoquant un risque de cancer pouvant atteindre 100 % à vie (par exemple, mutations p53 ). Ces mutations germinales sont présentées dans un encadré à gauche de la figure, avec une indication de leur contribution au déficit de réparation de l'ADN. Cependant, de telles mutations germinales (qui provoquent des syndromes cancéreux hautement pénétrants ) ne sont à l'origine que d'environ un pour cent des cancers.
La majorité des cancers sont appelés non héréditaires ou « cancers sporadiques ». Environ 30 % des cancers sporadiques ont une composante héréditaire qui n'est actuellement pas définie, tandis que la majorité, soit 70 % des cancers sporadiques, n'ont aucune composante héréditaire.
Dans les cancers sporadiques, une déficience de la réparation de l'ADN est parfois due à une mutation d'un gène de réparation de l'ADN ; beaucoup plus fréquemment, l'expression réduite ou absente des gènes de réparation de l'ADN est due à des altérations épigénétiques qui réduisent ou font taire l'expression des gènes . Ceci est indiqué dans la figure au 3ème niveau à partir du haut. Par exemple, pour 113 cancers colorectaux examinés en séquence, seulement quatre présentaient une mutation faux-sens dans le gène de réparation de l'ADN MGMT , tandis que la majorité présentait une expression réduite de MGMT en raison de la méthylation de la région du promoteur MGMT (une altération épigénétique).
Lorsque l'expression des gènes de réparation de l'ADN est réduite, cela provoque une déficience de la réparation de l'ADN. Ceci est montré dans la figure au 4ème niveau à partir du haut. Avec un déficit de réparation de l'ADN, les dommages à l'ADN persistent dans les cellules à un niveau supérieur à la normale (5e niveau à partir du haut de la figure) ; cet excès de dommages provoque une fréquence accrue de mutation et/ou d' épimutation (6e niveau à partir du haut de la figure). Expérimentalement, les taux de mutation augmentent considérablement dans les cellules défectueuses dans la réparation des mésappariements d'ADN ou dans la réparation par recombinaison homologue (HRR). Les réarrangements chromosomiques et l' aneuploïdie augmentent également dans les cellules défectueuses HRR.
Les mutations somatiques et les altérations épigénétiques causées par les dommages à l'ADN et les déficiences dans la réparation de l'ADN s'accumulent dans les défauts de terrain . Les défauts de champ sont des tissus d'apparence normale avec de multiples altérations (discutés dans la section ci-dessous) et sont des précurseurs courants du développement du clone de tissu désordonné et sur-proliférant dans un cancer. De tels défauts de champ (deuxième niveau à partir du bas de la figure) peuvent avoir de nombreuses mutations et altérations épigénétiques.
Il est impossible de déterminer la cause initiale de la plupart des cancers spécifiques. Dans quelques cas, une seule cause existe : par exemple, le virus HHV-8 provoque tous les sarcomes de Kaposi . Cependant, à l'aide de techniques et d'informations sur l' épidémiologie du cancer , il est possible de produire une estimation d'une cause probable dans de nombreuses autres situations. Par exemple, le cancer du poumon a plusieurs causes, dont le tabagisme et le radon . Les hommes qui fument actuellement développent un cancer du poumon à un taux 14 fois supérieur à celui des hommes qui n'ont jamais fumé de tabac : le risque de cancer du poumon chez un fumeur actuel causé par le tabagisme est d'environ 93 % ; il y a 7 % de chances que le cancer du poumon du fumeur soit causé par le radon ou une autre cause non liée au tabac. Ces corrélations statistiques ont permis aux chercheurs d'inférer que certaines substances ou comportements sont cancérigènes. La fumée de tabac provoque une augmentation des dommages exogènes à l' ADN, et ces dommages à l'ADN sont la cause probable du cancer du poumon dû au tabagisme. Parmi les plus de 5 000 composés contenus dans la fumée de tabac, les agents génotoxiques qui endommagent l'ADN qui se produisent à la fois aux concentrations les plus élevées et qui ont les effets mutagènes les plus puissants sont l' acroléine , le formaldéhyde , l' acrylonitrile , le 1,3-butadiène , l' acétaldéhyde , l'oxyde d'éthylène et l' isoprène .
En utilisant la biologie moléculaire des techniques, il est possible de caractériser les mutations, épimutations ou aberrations chromosomiques dans une tumeur, et des progrès rapides ont été accomplis dans le domaine de la prévision de certains patients atteints de cancer du pronostic basé sur le spectre des mutations. Par exemple, jusqu'à la moitié de toutes les tumeurs ont un gène p53 défectueux. Cette mutation est associée à un mauvais pronostic, car ces cellules tumorales sont moins susceptibles d'entrer en apoptose ou en mort cellulaire programmée lorsqu'elles sont endommagées par la thérapie. Les mutations de la télomérase suppriment des barrières supplémentaires, augmentant le nombre de fois qu'une cellule peut se diviser. D'autres mutations permettent à la tumeur de développer de nouveaux vaisseaux sanguins pour fournir plus de nutriments, ou de métastaser , se propageant à d'autres parties du corps. Cependant, une fois qu'un cancer est formé, il continue d'évoluer et de produire des sous-clones. Il a été rapporté en 2012 qu'un seul échantillon de cancer du rein, échantillonné dans neuf zones différentes, présentait 40 mutations "ubiquistes", trouvées dans les neuf zones, 59 mutations partagées par certaines, mais pas toutes les neuf zones, et 29 mutations "privées" uniquement. présent dans une zone.
Les lignées de cellules dans lesquelles s'accumulent toutes ces altérations de l'ADN sont difficiles à retracer, mais deux éléments de preuve récents suggèrent que les cellules souches normales pourraient être les cellules d'origine des cancers. Premièrement, il existe une corrélation très positive (rho de Spearman = 0,81 ; P < 3,5 × 10−8) entre le risque de développer un cancer dans un tissu et le nombre de divisions de cellules souches normales ayant lieu dans ce même tissu. La corrélation s'appliquait à 31 types de cancer et s'étendait sur cinq ordres de grandeur . Cette corrélation signifie que si les cellules souches normales d'un tissu se divisent une fois, le risque de cancer dans ce tissu est d'environ 1X. S'ils se divisent 1 000 fois, le risque de cancer est 1 000 fois. Et si les cellules souches normales d'un tissu se divisent 100 000 fois, le risque de cancer dans ce tissu est d'environ 100 000 fois. Cela suggère fortement que le principal facteur d'initiation du cancer est le fait que les cellules souches "normales" se divisent, ce qui implique que le cancer provient de cellules souches normales et saines.
Deuxièmement, les statistiques montrent que la plupart des cancers humains sont diagnostiqués chez les personnes âgées. Une explication possible est que les cancers surviennent parce que les cellules accumulent des dommages au fil du temps. L'ADN est le seul composant cellulaire qui peut accumuler des dommages tout au long d'une vie, et les cellules souches sont les seules cellules qui peuvent transmettre l'ADN du zygote aux cellules tard dans la vie. D'autres cellules, dérivées de cellules souches, ne conservent pas l'ADN du début de la vie jusqu'à ce qu'un éventuel cancer survienne. Cela implique que la plupart des cancers proviennent de cellules souches normales.
Contribution des défauts de champ

Le terme « cancerisation de champ » a été utilisé pour la première fois en 1953 pour décrire une zone ou un « champ » de l'épithélium qui a été préconditionné par (à l'époque) des processus largement inconnus afin de le prédisposer au développement du cancer. Depuis lors, les termes « cancerisation de champ » et « défaut de champ » ont été utilisés pour décrire les tissus précancéreux dans lesquels de nouveaux cancers sont susceptibles de survenir.
Des défauts de champ ont été identifiés en association avec des cancers et sont importants dans la progression vers le cancer. Cependant, il a été souligné par Rubin que « la grande majorité des études dans la recherche sur le cancer a été réalisée sur des tumeurs bien définies in vivo, ou sur des foyers néoplasiques discrets in vitro. Pourtant, il existe des preuves que plus de 80% des mutations somatiques trouvés dans les tumeurs colorectales humaines de phénotype mutateur se produisent avant le début de l'expansion clonale terminale…" Plus de la moitié des mutations somatiques identifiées dans les tumeurs se sont produites dans une phase pré-néoplasique (dans un défaut de champ), pendant la croissance de cellules apparemment normales. On s'attendrait également à ce que de nombreuses altérations épigénétiques présentes dans les tumeurs se soient produites dans des défauts de champ pré-néoplasiques.
Dans le côlon, un défaut de champ survient probablement par sélection naturelle d'une cellule mutante ou épigénétiquement modifiée parmi les cellules souches à la base de l'une des cryptes intestinales sur la surface interne du côlon. Une cellule souche mutante ou épigénétiquement modifiée peut remplacer les autres cellules souches voisines par sélection naturelle. Cela peut provoquer l'apparition d'un patch de tissu anormal. La figure de cette section comprend une photo d'un segment du côlon fraîchement réséqué et ouvert dans le sens de la longueur montrant un cancer du côlon et quatre polypes. Sous la photo, il y a un diagramme schématique de la formation d'une grande zone de cellules mutantes ou épigénétiquement modifiées, illustré par la grande zone en jaune sur le diagramme. Dans ce premier grand patch du diagramme (un grand clone de cellules), une seconde mutation ou altération épigénétique peut se produire, de sorte qu'une cellule souche donnée acquiert un avantage par rapport à ses voisines, et cette cellule souche altérée peut se développer de manière clonale, formant un patch secondaire, ou sous-clone, dans le patch d'origine. Ceci est indiqué dans le diagramme par quatre petites taches de couleurs différentes dans la grande zone d'origine jaune. Au sein de ces nouveaux patchs (sous-clones), le processus peut être répété plusieurs fois, indiqué par les patchs encore plus petits dans les quatre patchs secondaires (avec des couleurs toujours différentes dans le diagramme) qui s'étendent par clonage, jusqu'à ce que des cellules souches apparaissent qui génèrent soit de petits polypes ou encore une tumeur maligne (cancer). Sur la photo, un défaut de champ apparent dans ce segment du côlon a généré quatre polypes (étiquetés avec la taille des polypes, 6 mm, 5 mm et deux de 3 mm, et un cancer d'environ 3 cm de diamètre dans sa dimension la plus longue). Ces néoplasmes sont également indiqués (sur le schéma sous la photo) par 4 petits cercles bronzés (polypes) et une plus grande zone rouge (cancer). Le cancer sur la photo s'est produit dans la région caecale du côlon, où le côlon rejoint l'intestin grêle (étiqueté) et où l'appendice se produit (étiqueté). La graisse sur la photo est externe à la paroi externe du côlon. Dans le segment du côlon montré ici, le côlon a été ouvert dans le sens de la longueur pour exposer sa surface interne et pour afficher le cancer et les polypes se produisant dans la paroi épithéliale interne du côlon.
Si le processus général par lequel surviennent les cancers sporadiques du côlon est la formation d'un clone pré-néoplasique qui se propage par sélection naturelle, suivi de la formation de sous-clones internes au sein du clone initial et de sous-sous-clones à l'intérieur de ceux-ci, alors les cancers du côlon doivent généralement être associés à, et être précédés par, des champs d'anomalie croissante, reflétant la succession d'événements précancéreux. La région d'anomalie la plus étendue (la zone irrégulière jaune la plus externe du diagramme) refléterait l'événement le plus précoce dans la formation d'un néoplasme malin.
Dans l'évaluation expérimentale des déficiences spécifiques de la réparation de l'ADN dans les cancers, de nombreuses déficiences spécifiques de la réparation de l'ADN se sont également avérées se produire dans les défauts de terrain entourant ces cancers. Le tableau ci-dessous donne des exemples pour lesquels le déficit de réparation de l'ADN dans un cancer s'est avéré être causé par une altération épigénétique, et les fréquences un peu plus basses avec lesquelles le même déficit de réparation de l'ADN d'origine épigénétique a été trouvé dans le défaut de champ environnant.
| Cancer | Gène | Fréquence dans le cancer | Fréquence dans le champ Défaut | Référence |
|---|---|---|---|---|
| Colorectal | MGMT | 46% | 34% | |
| Colorectal | MGMT | 47% | 11% | |
| Colorectal | MGMT | 70% | 60% | |
| Colorectal | MSH2 | 13% | 5% | |
| Colorectal | ERCC1 | 100% | 40% | |
| Colorectal | PMS2 | 88% | 50% | |
| Colorectal | XPF | 55% | 40% | |
| Tête et cou | MGMT | 54% | 38% | |
| Tête et cou | MLH1 | 33% | 25% | |
| Tête et cou | MLH1 | 31% | 20% | |
| Estomac | MGMT | 88% | 78% | |
| Estomac | MLH1 | 73% | 20% | |
| Œsophage | MLH1 | 77 % à 100 % | 23 % à 79 % |
Certains des petits polypes dans le défaut de terrain montré sur la photo du segment du côlon ouvert peuvent être des néoplasmes relativement bénins. Dans une étude de 1996 sur des polypes de taille inférieure à 10 mm trouvés lors d'une coloscopie et suivis de coloscopies répétées pendant 3 ans, 25 % sont restés inchangés en taille, 35 % ont régressé ou ont diminué de taille et 40 % ont augmenté de taille.
Instabilité du génome
Les cancers sont connus pour présenter une instabilité du génome ou un « phénotype mutateur ». L'ADN codant pour les protéines dans le noyau représente environ 1,5% de l'ADN génomique total. Au sein de cet ADN codant pour une protéine (appelé exome ), un cancer moyen du sein ou du côlon peut avoir environ 60 à 70 mutations altérant les protéines, dont environ 3 ou 4 peuvent être des mutations « pilotes », et les autres peuvent être « » mutations "passagers". Cependant, le nombre moyen de mutations de la séquence d'ADN dans l'ensemble du génome (y compris les régions non codantes pour les protéines ) dans un échantillon de tissu de cancer du sein est d'environ 20 000. Dans un échantillon de tissu de mélanome moyen (les mélanomes ont une fréquence de mutation de l' exome plus élevée),) le nombre total de mutations de la séquence d'ADN est d'environ 80 000. Ces fréquences élevées de mutations dans les séquences nucléotidiques totales au sein des cancers suggèrent que souvent une altération précoce du défaut de champ donnant lieu à un cancer (par exemple, zone jaune dans le diagramme de la section précédente) est une déficience dans la réparation de l'ADN. Les grands défauts de champ entourant les cancers du côlon (s'étendant jusqu'à environ 10 cm de chaque côté d'un cancer) présentent fréquemment des défauts épigénétiques dans deux ou trois protéines de réparation de l'ADN ( ERCC1 , ERCC4 (XPF) et/ou PMS2 ) dans toute la zone de le défaut de terrain. Lorsque l'expression des gènes de réparation de l'ADN est réduite, les dommages à l'ADN s'accumulent dans les cellules à un taux supérieur à la normale, et cet excès de dommages provoque une fréquence accrue de mutation et/ou d'épimutation. Les taux de mutation augmentent fortement dans les cellules défectueuses dans la réparation des mésappariements d'ADN ou dans la réparation par recombinaison homologue (HRR). Une déficience dans la réparation de l'ADN, elle-même, peut permettre aux dommages de l'ADN de s'accumuler, et la synthèse de translésion sujette aux erreurs de certaines des zones endommagées peut donner lieu à des mutations. De plus, une réparation défectueuse de ces dommages accumulés à l'ADN peut donner lieu à des épimutations. Ces nouvelles mutations et/ou épimutations peuvent apporter un avantage prolifératif, générant un défaut de champ. Bien que les mutations/épimutations dans les gènes de réparation de l'ADN ne confèrent pas en elles-mêmes un avantage sélectif, elles peuvent être transportées en tant que passagers dans les cellules lorsque la cellule acquiert une mutation/épimutation supplémentaire qui fournit un avantage prolifératif.
Théories non conventionnelles
Il existe un certain nombre de théories sur la cancérogenèse et le traitement du cancer qui échappent au courant dominant de l'opinion scientifique, en raison du manque de justification scientifique, de logique ou de base de preuves. Ces théories peuvent être utilisées pour justifier divers traitements alternatifs contre le cancer. Elles doivent être distinguées des théories de la cancérogenèse qui ont une base logique dans la biologie traditionnelle du cancer et à partir desquelles des hypothèses conventionnellement testables peuvent être formulées.
Cependant, plusieurs théories alternatives de la cancérogenèse sont basées sur des preuves scientifiques et sont de plus en plus reconnues. Certains chercheurs pensent que le cancer peut être causé par une aneuploïdie (anomalies numériques et structurelles des chromosomes) plutôt que par des mutations ou des épimutations. Le cancer a également été considéré comme une maladie métabolique, dans laquelle le métabolisme cellulaire de l'oxygène est détourné de la voie qui génère de l'énergie ( phosphorylation oxydative ) vers la voie qui génère des espèces réactives de l'oxygène . Cela provoque un basculement énergétique de la phosphorylation oxydative vers la glycolyse aérobie ( hypothèse de Warburg ), et l'accumulation d' espèces réactives de l'oxygène conduisant au stress oxydatif (« théorie du stress oxydatif du cancer »). Un autre concept de développement du cancer est basé sur l'exposition à de faibles champs magnétiques et électromagnétiques et leurs effets sur le stress oxydatif , connu sous le nom de magnétocarcinogenèse.
Un certain nombre d'auteurs ont remis en question l'hypothèse selon laquelle les cancers résultent de mutations aléatoires séquentielles comme étant trop simpliste, suggérant plutôt que le cancer résulte d'un échec du corps à inhiber une tendance proliférative innée et programmée. Une théorie connexe suggère que le cancer est un atavisme , un retour évolutif à une forme antérieure de vie multicellulaire . Les gènes responsables de la croissance cellulaire incontrôlée et de la coopération entre les cellules cancéreuses sont très similaires à ceux qui ont permis aux premières formes de vie multicellulaires de se regrouper et de s'épanouir. Ces gènes existent toujours dans les génomes de métazoaires plus complexes , tels que les humains, bien que des gènes plus récemment évolués les maintiennent sous contrôle. Lorsque les nouveaux gènes de contrôle échouent pour une raison quelconque, la cellule peut revenir à sa programmation plus primitive et se reproduire de manière incontrôlable. La théorie est une alternative à l'idée que les cancers commencent par des cellules voyous qui subissent une évolution dans le corps. Au lieu de cela, ils possèdent un nombre fixe de gènes primitifs qui sont progressivement activés, leur conférant une variabilité finie. Une autre théorie de l'évolution ramène les racines du cancer à l'origine de la cellule eucaryote (nucléée) par transfert de gènes horizontal massif , lorsque les génomes des virus infectieux ont été clivés (et donc atténués) par l'hôte, mais leurs fragments intégrés dans le génome de l'hôte comme protection immunitaire. Le cancer naît donc lorsqu'une rare mutation somatique recombine de tels fragments en un moteur fonctionnel de la prolifération cellulaire.
Biologie des cellules cancéreuses
Souvent, les multiples changements génétiques qui entraînent le cancer peuvent mettre de nombreuses années à s'accumuler. Pendant ce temps, le comportement biologique des cellules précancéreuses change lentement des propriétés des cellules normales aux propriétés cancéreuses. Les tissus précancéreux peuvent avoir un aspect distinctif au microscope . Parmi les traits distinctifs d'une lésion précancéreuse figurent un nombre accru de cellules en division , une variation de la taille et de la forme du noyau, une variation de la taille et de la forme des cellules , la perte de caractéristiques cellulaires spécialisées et la perte de l'organisation tissulaire normale. La dysplasie est un type anormal de prolifération cellulaire excessive caractérisée par la perte de l'arrangement normal des tissus et de la structure cellulaire dans les cellules précancéreuses. Ces changements néoplasiques précoces doivent être distingués de l' hyperplasie , une augmentation réversible de la division cellulaire causée par un stimulus externe, tel qu'un déséquilibre hormonal ou une irritation chronique.
Les cas les plus graves de dysplasie sont appelés carcinome in situ . En latin, le terme in situ signifie « en place » ; Le carcinome in situ fait référence à une croissance incontrôlée de cellules dysplasiques qui restent à leur emplacement d'origine et n'ont pas montré d' invasion dans d'autres tissus. Le carcinome in situ peut évoluer vers une tumeur maligne invasive et est généralement retiré chirurgicalement lorsqu'il est détecté.
Évolution clonale
Tout comme une population d'animaux subit une évolution , une population de cellules non contrôlée peut également subir une "évolution". Ce processus indésirable est appelé évolution somatique , et c'est ainsi que le cancer apparaît et devient plus malin au fil du temps.
La plupart des changements dans le métabolisme cellulaire qui permettent aux cellules de se développer de manière désordonnée conduisent à la mort cellulaire. Cependant, une fois le cancer commencé, les cellules cancéreuses subissent un processus de sélection naturelle : les quelques cellules présentant de nouvelles modifications génétiques qui améliorent leur survie ou leur reproduction se multiplient plus rapidement et finissent rapidement par dominer la tumeur en croissance, car les cellules présentant des modifications génétiques moins favorables sont supplantées. . C'est le même mécanisme par lequel des espèces pathogènes telles que le SARM peuvent devenir résistantes aux antibiotiques et par lequel le VIH peut devenir résistant aux médicaments ), et par lequel les maladies des plantes et les insectes peuvent devenir résistants aux pesticides . Cette évolution explique pourquoi une rechute de cancer implique souvent des cellules qui ont acquis une résistance aux médicaments anticancéreux ou une résistance à la radiothérapie ).
Propriétés biologiques des cellules cancéreuses
Dans un article de 2000 de Hanahan et Weinberg , les propriétés biologiques des cellules tumorales malignes ont été résumées comme suit :
- Acquisition d'une autosuffisance en signaux de croissance , conduisant à une croissance incontrôlée.
- Perte de sensibilité aux signaux anti-croissance, conduisant également à une croissance incontrôlée.
- Perte de capacité d' apoptose , permettant la croissance malgré les erreurs génétiques et les signaux externes anti-croissance.
- Perte de capacité de sénescence , conduisant à un potentiel réplicatif illimité (immortalité)
- Acquisition d' une angiogenèse soutenue , permettant à la tumeur de se développer au-delà des limites de la diffusion passive des nutriments.
- Acquisition de la capacité d'envahir les tissus voisins , propriété déterminante du carcinome invasif.
- Acquisition de la capacité à ensemencer des métastases sur des sites distants, propriété d'apparition tardive de certaines tumeurs malignes (carcinomes ou autres).
La réalisation de ces multiples étapes serait un événement très rare sans :
- Perte de capacité à réparer les erreurs génétiques, entraînant une augmentation du taux de mutation (instabilité génomique), accélérant ainsi tous les autres changements.
Ces changements biologiques sont classiques dans les carcinomes ; d'autres tumeurs malignes peuvent ne pas avoir besoin de toutes les atteindre. Par exemple, étant donné que l'invasion des tissus et le déplacement vers des sites distants sont des propriétés normales des leucocytes , ces étapes ne sont pas nécessaires dans le développement de la leucémie . Les différentes étapes ne représentent pas non plus nécessairement des mutations individuelles. Par exemple, l'inactivation d'un seul gène, codant pour la protéine p53 , provoquera une instabilité génomique, une évasion de l'apoptose et une augmentation de l'angiogenèse. De plus, toutes les cellules cancéreuses ne se divisent pas. Au contraire, un sous-ensemble de cellules d'une tumeur, appelées cellules souches cancéreuses , se réplique en générant des cellules différenciées.
Le cancer comme défaut des interactions cellulaires
Normalement, une fois qu'un tissu est lésé ou infecté, les cellules endommagées provoquent une inflammation en stimulant des modèles spécifiques d'activité enzymatique et d'expression de gènes de cytokines dans les cellules environnantes. Des amas discrets ("amas de cytokines") de molécules sont sécrétés, qui agissent comme des médiateurs, induisant l'activité de cascades ultérieures de changements biochimiques. Chaque cytokine se lie à des récepteurs spécifiques sur différents types cellulaires, et chaque type cellulaire répond à son tour en modifiant l'activité des voies de transduction du signal intracellulaire, en fonction des récepteurs exprimés par la cellule et des molécules de signalisation présentes à l'intérieur de la cellule. Collectivement, ce processus de reprogrammation induit un changement progressif des phénotypes cellulaires, qui conduira finalement à la restauration de la fonction tissulaire et à la récupération de l'intégrité structurelle essentielle. Un tissu peut ainsi cicatriser, en fonction de la communication productive entre les cellules présentes sur le site de l'atteinte et le système immunitaire. Un facteur clé de la guérison est la régulation de l'expression des gènes des cytokines, qui permet à des groupes complémentaires de cellules de répondre aux médiateurs inflammatoires d'une manière qui produit progressivement des changements essentiels dans la physiologie tissulaire. Les cellules cancéreuses présentent des modifications permanentes (génétiques) ou réversibles (épigénétiques) de leur génome, qui inhibent en partie leur communication avec les cellules environnantes et avec le système immunitaire. Les cellules cancéreuses ne communiquent pas avec leur microenvironnement tissulaire d'une manière qui protège l'intégrité des tissus ; au lieu de cela, le mouvement et la survie des cellules cancéreuses deviennent possibles dans des endroits où elles peuvent altérer la fonction des tissus. Les cellules cancéreuses survivent en « recâblant » les voies de signalisation qui protègent normalement les tissus du système immunitaire.
Un exemple de recâblage de la fonction tissulaire dans le cancer est l'activité du facteur de transcription NF-κB . NF-κB active l'expression de nombreux gènes impliqués dans la transition entre l'inflammation et la régénération, qui codent pour des cytokines, des facteurs d'adhésion et d'autres molécules pouvant modifier le destin cellulaire. Cette reprogrammation des phénotypes cellulaires permet normalement le développement d'un tissu intact entièrement fonctionnel. L'activité de NF-κB est étroitement contrôlée par de multiples protéines, qui garantissent collectivement que seuls des groupes discrets de gènes sont induits par NF-κB dans une cellule donnée et à un moment donné. Cette régulation étroite de l'échange de signaux entre les cellules protège le tissu d'une inflammation excessive et garantit que les différents types de cellules acquièrent progressivement des fonctions complémentaires et des positions spécifiques. L'échec de cette régulation mutuelle entre la reprogrammation génétique et les interactions cellulaires permet aux cellules cancéreuses de donner lieu à des métastases. Les cellules cancéreuses répondent de manière aberrante aux cytokines et activent des cascades de signaux qui peuvent les protéger du système immunitaire.
Dans le poisson
Le rôle de l'iode chez les poissons marins (riches en iode) et les poissons d'eau douce (carence en iode) n'est pas complètement élucidé, mais il a été rapporté que les poissons d'eau douce sont plus sensibles aux maladies infectieuses et, en particulier, néoplasiques et athéroscléreuses, que les poissons marins. poisson. Les poissons élasmobranches marins comme les requins, les raies pastenagues etc. sont beaucoup moins touchés par le cancer que les poissons d'eau douce, et ont donc stimulé la recherche médicale pour mieux comprendre la cancérogenèse.
Mécanismes
Pour que les cellules commencent à se diviser de manière incontrôlable, les gènes qui régulent la croissance cellulaire doivent être dérégulés. Les proto-oncogènes sont des gènes qui favorisent la croissance cellulaire et la mitose , tandis que les gènes suppresseurs de tumeurs découragent la croissance cellulaire ou arrêtent temporairement la division cellulaire pour effectuer la réparation de l'ADN . En règle générale, une série de plusieurs mutations de ces gènes est nécessaire avant qu'une cellule normale ne se transforme en une cellule cancéreuse . Ce concept est parfois appelé « oncoévolution ». Les mutations de ces gènes fournissent les signaux pour que les cellules tumorales commencent à se diviser de manière incontrôlable. Mais la division cellulaire incontrôlée qui caractérise le cancer nécessite également que la cellule en division duplique tous ses composants cellulaires pour créer deux cellules filles. L'activation de la glycolyse anaérobie (l' effet Warburg ), qui n'est pas nécessairement induite par des mutations des proto-oncogènes et des gènes suppresseurs de tumeurs, fournit la plupart des éléments constitutifs nécessaires pour dupliquer les composants cellulaires d'une cellule en division et, par conséquent, est également essentielle pour la cancérogenèse.
Oncogènes
Les oncogènes favorisent la croissance cellulaire de diverses manières. Beaucoup peuvent produire des hormones , un « messager chimique » entre les cellules qui favorisent la mitose , dont l'effet dépend de la transduction du signal du tissu ou des cellules récepteurs. En d'autres termes, lorsqu'un récepteur hormonal sur une cellule receveuse est stimulé, le signal est conduit de la surface de la cellule au noyau de la cellule pour affecter un certain changement dans la régulation de la transcription génique au niveau nucléaire. Certains oncogènes font partie du système de transduction du signal lui-même, ou des récepteurs du signal dans les cellules et les tissus eux-mêmes, contrôlant ainsi la sensibilité à ces hormones. Les oncogènes produisent souvent des mitogènes , ou sont impliqués dans la transcription de l'ADN dans la synthèse des protéines , qui crée les protéines et les enzymes responsables de la production des produits et des substances biochimiques que les cellules utilisent et avec lesquelles elles interagissent.
Des mutations dans les proto-oncogènes, qui sont les contreparties normalement quiescentes des oncogènes , peuvent modifier leur expression et leur fonction, augmentant la quantité ou l'activité de la protéine produite. Lorsque cela se produit, les proto-oncogènes deviennent des oncogènes et cette transition perturbe l'équilibre normal de la régulation du cycle cellulaire dans la cellule, rendant possible une croissance incontrôlée. Le risque de cancer ne peut pas être réduit en supprimant les proto-oncogènes du génome , même si cela était possible, car ils sont essentiels à la croissance, à la réparation et à l' homéostasie de l'organisme. Ce n'est qu'au moment de leur mutation que les signaux de croissance deviennent excessifs.
L'un des premiers oncogènes à être défini dans la recherche sur le cancer est l' oncogène ras . Les mutations de la famille Ras des proto-oncogènes (comprenant H-Ras, N-Ras et K-Ras) sont très fréquentes et se retrouvent dans 20 à 30 % de toutes les tumeurs humaines. Ras a été identifié à l'origine dans le génome du virus du sarcome de Harvey, et les chercheurs ont été surpris que non seulement ce gène soit présent dans le génome humain, mais aussi, lorsqu'il est ligaturé à un élément de contrôle stimulant, il puisse induire des cancers dans des cultures de lignées cellulaires.
Proto-oncogènes
Les proto-oncogènes favorisent la croissance cellulaire de diverses manières. Beaucoup peuvent produire des hormones , des « messagers chimiques » entre les cellules qui favorisent la mitose, dont l'effet dépend de la transduction du signal du tissu ou des cellules récepteurs. Certains sont responsables du système de transduction du signal et des récepteurs de signal dans les cellules et les tissus eux-mêmes, contrôlant ainsi la sensibilité à ces hormones. Ils produisent souvent des mitogènes ou sont impliqués dans la transcription de l'ADN dans la synthèse des protéines , qui créent les protéines et les enzymes responsables de la production des produits et des substances biochimiques utilisées par les cellules et avec lesquelles elles interagissent.
Des mutations dans les proto-oncogènes peuvent modifier leur expression et leur fonction, augmentant la quantité ou l'activité de la protéine produite. Lorsque cela se produit, elles deviennent des oncogènes et, par conséquent, les cellules ont plus de chances de se diviser de manière excessive et incontrôlable. Le risque de cancer ne peut pas être réduit en éliminant les proto-oncogènes du génome , car ils sont essentiels à la croissance, à la réparation et à l' homéostasie du corps. Ce n'est qu'au moment de leur mutation que les signaux de croissance deviennent excessifs. Il est important de noter qu'un gène possédant un rôle promoteur de croissance peut augmenter le potentiel cancérigène d'une cellule, à condition que tous les mécanismes cellulaires nécessaires à la croissance soient activés. Cette condition comprend également l'inactivation de gènes suppresseurs de tumeur spécifiques (voir ci-dessous). Si la condition n'est pas remplie, la cellule peut cesser de croître et peut continuer à mourir. Cela rend l'identification du stade et du type de cellule cancéreuse qui se développe sous le contrôle d'un oncogène donné cruciale pour le développement de stratégies de traitement.
Gènes suppresseurs de tumeurs

Les gènes suppresseurs de tumeurs codent pour les signaux anti-prolifération et les protéines qui suppriment la mitose et la croissance cellulaire. Généralement, les suppresseurs de tumeurs sont des facteurs de transcription qui sont activés par un stress cellulaire ou des dommages à l'ADN. Souvent, les dommages à l'ADN entraîneront la présence de matériel génétique flottant ainsi que d'autres signes, et déclencheront des enzymes et des voies qui conduisent à l'activation de gènes suppresseurs de tumeurs . Les fonctions de ces gènes sont d'arrêter la progression du cycle cellulaire afin d'effectuer la réparation de l'ADN, empêchant les mutations d'être transmises aux cellules filles. La protéine p53 , l'un des gènes suppresseurs de tumeurs les plus étudiés, est un facteur de transcription activé par de nombreux facteurs de stress cellulaires, notamment l' hypoxie et les dommages causés par les rayons ultraviolets .
Malgré près de la moitié de tous les cancers impliquant éventuellement des altérations de p53, sa fonction de suppresseur de tumeur est mal comprise. p53 a clairement deux fonctions : l'une un rôle nucléaire en tant que facteur de transcription et l'autre un rôle cytoplasmique dans la régulation du cycle cellulaire, de la division cellulaire et de l'apoptose.
L' hypothèse de Warburg est l'utilisation préférentielle de la glycolyse comme source d'énergie pour soutenir la croissance du cancer. Il a été démontré que p53 régule le passage de la voie respiratoire à la voie glycolytique.
Cependant, une mutation peut endommager le gène suppresseur de tumeur lui-même, ou la voie de signal qui l'active, en le "coupant". La conséquence invariable de ceci est que la réparation de l'ADN est entravée ou inhibée : les dommages à l'ADN s'accumulent sans réparation, conduisant inévitablement au cancer.
Les mutations des gènes suppresseurs de tumeurs qui se produisent dans les cellules germinales sont transmises à la progéniture et augmentent la probabilité de diagnostic de cancer dans les générations suivantes. Les membres de ces familles ont une incidence accrue et une latence réduite de tumeurs multiples. Les types de tumeurs sont typiques pour chaque type de mutation du gène suppresseur de tumeur, certaines mutations provoquant des cancers particuliers et d'autres mutations provoquant d'autres. Le mode de transmission des suppresseurs de tumeurs mutants est qu'un membre affecté hérite d'une copie défectueuse d'un parent et d'une copie normale de l'autre. Par exemple, les personnes qui héritent d'un allèle p53 mutant (et sont donc hétérozygotes pour p53 muté ) peuvent développer des mélanomes et un cancer du pancréas , connu sous le nom de syndrome de Li-Fraumeni . D'autres syndromes héréditaires du gène suppresseur de tumeur comprennent les mutations Rb , liées au rétinoblastome , et les mutations du gène APC , liées à l' adénopolypose du cancer du côlon . Le cancer du côlon adénopolypose est associé à des milliers de polypes dans le côlon alors qu'il est jeune, ce qui conduit au cancer du côlon à un âge relativement précoce. Enfin, des mutations héréditaires dans BRCA1 et BRCA2 conduisent à l'apparition précoce du cancer du sein .
Le développement du cancer a été proposé en 1971 pour dépendre d'au moins deux événements mutationnels. Dans ce qui est devenu connu sous le nom d' hypothèse à deux coups de Knudson , une mutation héréditaire de la lignée germinale dans un gène suppresseur de tumeur ne provoquerait le cancer que si un autre événement de mutation se produisait plus tard dans la vie de l'organisme, inactivant l'autre allèle de ce gène suppresseur de tumeur .
Habituellement, les oncogènes sont dominants , car ils contiennent des mutations de gain de fonction , tandis que les suppresseurs de tumeur mutés sont récessifs , car ils contiennent des mutations de perte de fonction . Chaque cellule a deux copies du même gène, une de chaque parent, et dans la plupart des cas, le gain de mutations fonctionnelles dans une seule copie d'un proto-oncogène particulier est suffisant pour faire de ce gène un véritable oncogène. D'un autre côté, des mutations de perte de fonction doivent se produire dans les deux copies d'un gène suppresseur de tumeur pour rendre ce gène complètement non fonctionnel. Cependant, il existe des cas dans lesquels une copie mutée d'un gène suppresseur de tumeur peut rendre l'autre copie de type sauvage non fonctionnelle. Ce phénomène est appelé effet négatif dominant et est observé dans de nombreuses mutations de p53.
Le modèle à deux succès de Knudson a récemment été contesté par plusieurs enquêteurs. L'inactivation d'un allèle de certains gènes suppresseurs de tumeurs est suffisante pour provoquer des tumeurs. Ce phénomène est appelé haploinsuffisance et a été démontré par un certain nombre d'approches expérimentales. Les tumeurs causées par une haplo-insuffisance ont généralement un âge d'apparition plus tardif que celles causées par un processus à deux coups.
Mutations multiples
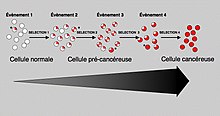
En général, des mutations dans les deux types de gènes sont nécessaires pour qu'un cancer se produise. Par exemple, une mutation limitée à un oncogène serait supprimée par le contrôle normal de la mitose et les gènes suppresseurs de tumeur, d'abord supposés par l' hypothèse de Knudson . Une mutation sur un seul gène suppresseur de tumeur ne provoquerait pas non plus de cancer, en raison de la présence de nombreux gènes « de sauvegarde » qui dupliquent ses fonctions. Ce n'est que lorsque suffisamment de proto-oncogènes ont muté en oncogènes et que suffisamment de gènes suppresseurs de tumeurs sont désactivés ou endommagés, que les signaux de croissance cellulaire dépassent les signaux de régulation, que la croissance cellulaire devient rapidement incontrôlable. Souvent, parce que ces gènes régulent les processus qui empêchent la plupart des dommages aux gènes eux-mêmes, le taux de mutations augmente avec l'âge, car les dommages à l'ADN forment une boucle de rétroaction .
La mutation des gènes suppresseurs de tumeurs qui sont transmis à la génération suivante non seulement des cellules, mais aussi de leur progéniture , peut augmenter les probabilités de transmission héréditaire des cancers. Les membres de ces familles ont une incidence accrue et une latence réduite de tumeurs multiples. Le mode de transmission des suppresseurs de tumeurs mutants est que le membre affecté hérite d'une copie défectueuse d'un parent et d'une copie normale d'un autre. Étant donné que les mutations des suppresseurs de tumeurs agissent de manière récessive (notez cependant qu'il existe des exceptions), la perte de la copie normale crée le phénotype du cancer . Par exemple, les individus hétérozygotes pour les mutations p53 sont souvent victimes du syndrome de Li-Fraumeni et ceux qui sont hétérozygotes pour les mutations Rb développent un rétinoblastome . De la même manière, des mutations du gène de la polypose adénomateuse coli sont liées à l' adénopolypose du cancer du côlon , avec des milliers de polypes dans le côlon alors qu'ils sont jeunes, tandis que les mutations de BRCA1 et BRCA2 entraînent l'apparition précoce d' un cancer du sein .
Une nouvelle idée annoncée en 2011 est une version extrême de multiples mutations, appelée chromothripsis par ses partisans. Cette idée, qui n'affecte que 2 à 3 % des cas de cancer, bien que jusqu'à 25 % des cancers des os, implique l'éclatement catastrophique d'un chromosome en dizaines ou centaines de morceaux, puis son assemblage incorrect. Cet éclatement a probablement lieu lorsque les chromosomes sont compactés pendant la division cellulaire normale , mais le déclencheur de l'éclatement est inconnu. Dans ce modèle, le cancer survient à la suite d'un événement unique et isolé, plutôt que de la lente accumulation de multiples mutations.
Cancérogènes non mutagènes
De nombreux mutagènes sont également cancérigènes , mais certains cancérogènes ne sont pas mutagènes. L' alcool et les œstrogènes sont des exemples de cancérogènes qui ne sont pas mutagènes . On pense que ceux-ci favorisent les cancers grâce à leur effet stimulant sur le taux de mitose cellulaire . Des taux de mitose plus rapides laissent de moins en moins d'opportunités aux enzymes de réparation de réparer l'ADN endommagé pendant la réplication de l'ADN , ce qui augmente la probabilité d'une erreur génétique. Une erreur commise lors de la mitose peut conduire les cellules filles à recevoir le mauvais nombre de chromosomes , ce qui conduit à une aneuploïdie et peut conduire au cancer.
Rôle des infections
Bactérien
Helicobacter pylori peut provoquer un cancer gastrique . Bien que les données varient d'un pays à l'autre, dans l'ensemble, environ 1 % à 3 % des personnes infectées par Helicobacter pylori développent un cancer gastrique au cours de leur vie, contre 0,13 % des personnes qui n'ont eu aucuneinfection à H. pylori . L' infection à H. pylori est très répandue. Comme évalué en 2002, il est présent dans les tissus gastriques de 74% des adultes d'âge moyen dans les pays en développement et 58% dans les pays développés. Étant donné que 1 à 3 % des personnes infectées sont susceptibles de développer un cancer gastrique,le cancer gastrique induit par H. pylori est la troisième cause de mortalité par cancer dans le monde en 2018.
L'infection par H. pylori ne provoque aucun symptôme chez environ 80 % des personnes infectées. Environ 75 % des individus infectés par H. pylori développent une gastrite . Ainsi, la conséquence habituelle de l' infection à H. pylori est une gastrite chronique asymptomatique. En raison de l'absence habituelle de symptômes, lorsque le cancer gastrique est finalement diagnostiqué, il est souvent assez avancé. Plus de la moitié des patients atteints de cancer gastrique présentent des métastases ganglionnaires au moment du diagnostic initial.
La gastrite causée par H. pylori s'accompagne d'une inflammation , caractérisée par une infiltration de neutrophiles et de macrophages vers l'épithélium gastrique, ce qui favorise l'accumulation de cytokines pro-inflammatoires et d' espèces réactives de l'oxygène /des espèces réactives de l'azote (ROS/RNS). La présence substantielle de ROS/RNS provoque des dommages à l'ADN, notamment la 8-oxo-2'-désoxyguanosine (8-OHdG). Si les H. pylori infectieux portent le gène cytotoxique cagA (présent dans environ 60 % des isolats occidentaux et un pourcentage plus élevé d'isolats asiatiques), ils peuvent multiplier par 8 le niveau de 8-OHdG dans les cellules gastriques, tandis que si le H. . pylori ne portent pas le gène cagA, l'augmentation de 8-OHdG est d'environ 4 fois. En plus des dommages oxydatifs à l'ADN 8-OHdG, l' infection à H. pylori provoque d'autres dommages caractéristiques à l'ADN, notamment des cassures double brin de l'ADN.
H. pylori provoque également de nombreuses altérations épigénétiques liées au développement du cancer. Ces altérations épigénétiques sont dues à la méthylation induite par H. pylori des sites CpG dans les promoteurs de gènes et à l' expression altérée induite par H. pylori de plusieurs microARN .
Comme examiné par Santos et Ribeiro, l' infection à H. pylori est associée à une efficacité épigénétiquement réduite de la machinerie de réparation de l'ADN, ce qui favorise l'accumulation de mutations et l'instabilité génomique ainsi que la carcinogenèse gastrique. En particulier, Raza et al. ont montré que l'expression de deux protéines de réparation de l'ADN, ERCC1 et PMS2 , était sévèrement réduite une fois que l' infection à H. pylori avait progressé pour provoquer une dyspepsie . La dyspepsie survient chez environ 20 % des personnes infectées. De plus, tel que revu par Raza et al., l'infection gastrique humaine par H. pylori provoque une expression protéique épigénétiquement réduite des protéines de réparation de l'ADN MLH1 , MGMT et MRE11 . La réparation réduite de l'ADN en présence de dommages accrus à l'ADN augmente les mutations cancérigènes et est probablement une cause importante de la carcinogenèse de H. pylori .
Viral
De plus, de nombreux cancers ont pour origine une infection virale ; c'est particulièrement vrai chez les animaux comme les oiseaux , mais moins chez les humains . 12% des cancers humains peuvent être attribués à une infection virale. Le mode des tumeurs induites viralement peut être divisé en deux, à transformation aiguë ou à transformation lente . Dans les virus à transformation aiguë, les particules virales portent un gène qui code pour un oncogène hyperactif appelé viral-oncogène (v-onc), et la cellule infectée est transformée dès que v-onc est exprimé. En revanche, dans les virus à transformation lente, le génome du virus est inséré, d'autant plus que l'insertion du génome viral fait partie obligatoire des rétrovirus , à proximité d'un proto-oncogène dans le génome de l'hôte. Le promoteur viral ou d'autres éléments de régulation de la transcription, à leur tour, provoquent une surexpression de ce proto-oncogène, qui, à son tour, induit une prolifération cellulaire incontrôlée. Étant donné que l'insertion du génome viral n'est pas spécifique aux proto-oncogènes et que les chances d'insertion à proximité de ce proto-oncogène sont faibles, les virus à transformation lente ont une latence tumorale très longue par rapport au virus à transformation aiguë, qui porte déjà l'oncogène viral.
Les virus connus pour causer le cancer, tels que le VPH ( cancer du col de l'utérus ), l' hépatite B ( cancer du foie ) et l' EBV (un type de lymphome ), sont tous des virus à ADN. On pense que lorsque le virus infecte une cellule, il insère une partie de son propre ADN près des gènes de croissance cellulaire, provoquant la division cellulaire. Le groupe de cellules modifiées qui sont formées à partir de la première division cellulaire ont toutes le même ADN viral à proximité des gènes de croissance cellulaire. Le groupe de cellules modifiées est maintenant spécial car l'un des contrôles normaux de la croissance a été perdu.
Selon leur emplacement, les cellules peuvent être endommagées par les radiations, les produits chimiques de la fumée de cigarette et l'inflammation causée par une infection bactérienne ou d'autres virus. Chaque cellule a une chance d'être endommagée. Les cellules meurent souvent si elles sont endommagées, par l'échec d'un processus vital ou du système immunitaire. Chez une personne âgée, il y a des milliers, des dizaines de milliers ou des centaines de milliers de cellules assommées. La probabilité qu'une personne développe un cancer est très faible.
Lorsque les dommages se produisent dans n'importe quelle zone de cellules modifiées, quelque chose de différent se produit. Chacune des cellules a un potentiel de croissance. Les cellules modifiées se diviseront plus rapidement lorsque la zone est endommagée par des agents physiques, chimiques ou viraux. Un cercle vicieux s'est mis en place : endommager la zone entraînera la division des cellules modifiées, ce qui augmentera la probabilité qu'elles subissent des KO.
Ce modèle de cancérogenèse est populaire car il explique pourquoi les cancers se développent. On s'attendrait à ce que les cellules endommagées par les radiations meurent ou du moins soient pires parce qu'elles ont moins de gènes qui fonctionnent ; les virus augmentent le nombre de gènes actifs.
Une pensée est que nous pourrions nous retrouver avec des milliers de vaccins pour empêcher chaque virus qui peut changer nos cellules. Les virus peuvent avoir des effets différents sur différentes parties du corps. Il peut être possible de prévenir un certain nombre de cancers différents en immunisant contre un agent viral. Il est probable que le VPH, par exemple, joue un rôle dans les cancers des muqueuses de la bouche.
Helminthiase
Certains vers parasites sont connus pour être cancérigènes. Ceux-ci inclus:
- Clonorchis sinensis (l'organisme à l'origine de la clonorchiase ) et Opisthorchis viverrini (à l'origine de l' opisthorchiase ) sont associés au cholangiocarcinome .
- L' espèce Schistosoma (les organismes causant la schistosomiase ) est associée au cancer de la vessie .
Épigénétique
L'épigénétique est l'étude de la régulation de l'expression des gènes par des changements chimiques non mutationnels dans la structure de l'ADN. La théorie de l' épigénétique dans la pathogenèse du cancer est que les modifications non mutationnelles de l'ADN peuvent entraîner des altérations de l'expression des gènes. Normalement, les oncogènes sont silencieux, par exemple, à cause de la méthylation de l' ADN . La perte de cette méthylation peut induire l'expression aberrante d' oncogènes , conduisant à la pathogenèse du cancer. Les mécanismes connus de changement épigénétique comprennent la méthylation de l'ADN et la méthylation ou l'acétylation des protéines histones liées à l'ADN chromosomique à des emplacements spécifiques. Des classes de médicaments, appelées inhibiteurs d'HDAC et inhibiteurs de l' ADN méthyltransférase , peuvent reréguler la signalisation épigénétique dans la cellule cancéreuse .
Les épimutations comprennent des méthylations ou des déméthylations des îlots CpG des régions promotrices des gènes, qui entraînent respectivement une répression ou une dé-répression de l'expression génique. Les épimutations peuvent également se produire par acétylation, méthylation, phosphorylation ou d'autres altérations des histones, créant un code d'histones qui réprime ou active l'expression des gènes, et de telles épimutations d'histones peuvent être des facteurs épigénétiques importants dans le cancer. De plus, une épimutation cancérigène peut se produire par des altérations de l'architecture chromosomique causées par des protéines telles que HMGA2 . Une autre source d'épimutation est due à l'augmentation ou à la diminution de l'expression des microARN (miARN). Par exemple, une expression supplémentaire de miR-137 peut entraîner une régulation négative de l'expression de 491 gènes, et miR-137 est réduit au silence épigénétiquement dans 32% des cancers colorectaux>
Cellules souches cancéreuses
Une nouvelle façon de considérer la cancérogenèse vient de l'intégration des idées de la biologie du développement dans l' oncologie . L' hypothèse des cellules souches cancéreuses propose que les différents types de cellules d'une tumeur hétérogène proviennent d'une seule cellule, appelée cellule souche cancéreuse. Les cellules souches cancéreuses peuvent résulter de la transformation de cellules souches adultes ou de cellules différenciées dans un corps. Ces cellules persistent en tant que sous-composant de la tumeur et conservent les propriétés clés des cellules souches. Ils donnent naissance à une variété de cellules, sont capables d'auto-renouvellement et de contrôle homéostatique . De plus, la rechute du cancer et l'émergence de métastases sont également attribuées à ces cellules. L' hypothèse des cellules souches cancéreuses ne contredit pas les concepts antérieurs de la cancérogenèse. L'hypothèse des cellules souches cancéreuses a été un mécanisme proposé qui contribue à l'hétérogénéité tumorale .
Évolution clonale
Alors que les altérations génétiques et épigénétiques des gènes suppresseurs de tumeurs et des oncogènes modifient le comportement des cellules, ces altérations, en fin de compte, entraînent le cancer par leurs effets sur la population de cellules néoplasiques et leur microenvironnement. Les cellules mutantes dans les néoplasmes se disputent l'espace et les ressources. Ainsi, un clone avec une mutation dans un gène suppresseur de tumeur ou un oncogène ne se développera que dans un néoplasme si cette mutation donne au clone un avantage compétitif sur les autres clones et les cellules normales de son microenvironnement. Ainsi, le processus de cancérogenèse est formellement un processus d' évolution darwinienne , connu sous le nom d' évolution somatique ou clonale . De plus, à la lumière des mécanismes darwinistes de la cancérogenèse, il a été théorisé que les différentes formes de cancer peuvent être classées comme pubertaires et gérontologiques. Des recherches anthropologiques sont actuellement menées sur le cancer en tant que processus évolutif naturel par lequel la sélection naturelle détruit les phénotypes écologiquement inférieurs tout en soutenant les autres. Selon cette théorie, le cancer se présente sous deux formes distinctes : de la naissance à la fin de la puberté (environ 20 ans) téléologiquement incliné vers la dynamique de groupe de soutien, et de la mi-vie à la mort (environ 40 ans et plus) téléologiquement incliné loin du groupe surpeuplé dynamique.
Voir également
Les références
Lectures complémentaires
- Tokar EJ, Benbrahim-Tallaa L, député de Waalkes (2011). "Chepter 14. Ions métalliques dans le développement du cancer humain". Dans Astrid Sigel, Helmut Sigel et Roland KO Sigel (éd.). Les ions métalliques en toxicologie : effets, interactions, interdépendances . Les ions métalliques dans les sciences de la vie. 8 . Éditions RSC. p. 375-401. doi : 10.1039/9781849732116-00375 . ISBN 978-1-84973-091-4.
- Dixon K, Kopras E (décembre 2004). « Altérations génétiques et réparation de l'ADN dans la cancérogenèse humaine ». Séminaires en biologie du cancer . 14 (6) : 441-8. doi : 10.1016/j.semcancer.2004.06.007 . PMID 15489137 .
- Kleinsmith LJ (2006). Principes de biologie du cancer . San Francisco : Pearson Benjamin Cummings. ISBN 978-0-8053-4003-7.
- Sarasin A (novembre 2003). "Un aperçu des mécanismes de mutagenèse et de cancérogenèse". Recherche sur les mutations . 544 (2-3): 99-106. doi : 10.1016/j.mrrev.2003.06.024 . PMID 14644312 .
- Schottenfeld D, Beebe-Dimmer JL (2005). "Les progrès de l'épidémiologie du cancer : comprendre les mécanismes causaux et les preuves pour la mise en œuvre des interventions" . Revue annuelle de santé publique . 26 : 37-60. doi : 10.1146/annurev.publhealth.26.021304.144402 . PMID 15760280 .
- Tannock I, Hill R, Bristow R, Harrington L (2005). La science fondamentale de l'oncologie (4e éd.). New York : McGraw-Hill. ISBN 978-0-07-138774-3.
- Wicha MS, Liu S, Dontu G (février 2006). « Cellules souches cancéreuses : une vieille idée - un changement de paradigme » . Recherche sur le cancer . 66 (4) : 1883-1890, discussion 1895-1806. doi : 10.1158/0008-5472.CAN-05-3153 . PMID 16488983 .


