Chimie - Chemistry
| Fait partie d'une série sur |
| Chimie |
|---|

|
|
La chimie est l' étude scientifique des propriétés et du comportement de la matière . C'est une science naturelle qui couvre les éléments qui composent la matière jusqu'aux composés composés d' atomes , de molécules et d' ions : leur composition, leur structure, leurs propriétés, leur comportement et les modifications qu'ils subissent lors d'une réaction avec d'autres substances .
Dans le cadre de son objet, la chimie occupe une position intermédiaire entre la physique et la biologie . On l'appelle parfois la science centrale car elle fournit une base pour la compréhension des disciplines scientifiques fondamentales et appliquées à un niveau fondamental. Par exemple, la chimie explique des aspects de la chimie des plantes ( botanique ), de la formation des roches ignées ( géologie ), de la formation de l'ozone atmosphérique et de la dégradation des polluants environnementaux ( écologie ), des propriétés du sol sur la lune ( cosmochimie ), de la les médicaments fonctionnent ( pharmacologie ) et comment collecter des preuves ADN sur une scène de crime ( médico-légale ).
La chimie aborde des sujets tels que la façon dont les atomes et les molécules interagissent via des liaisons chimiques pour former de nouveaux composés chimiques . Il existe deux types de liaisons chimiques : 1. les liaisons chimiques primaires, par exemple les liaisons covalentes , dans lesquelles les atomes partagent un ou plusieurs électron(s) ; les liaisons ioniques , dans lesquelles un atome cède un ou plusieurs électrons à un autre atome pour produire des ions ( cations et anions ) ; les liaisons métalliques et 2. les liaisons chimiques secondaires, par exemple les liaisons hydrogène ; Liens de force de Van der Waals , interaction ion-ion, interaction ion-dipôle, etc.
Étymologie
Le mot chimie vient d'une modification du mot alchimie , qui faisait référence à un ensemble antérieur de pratiques qui englobaient des éléments de chimie, de métallurgie , de philosophie , d' astrologie , d' astronomie , de mysticisme et de médecine . L'alchimie est souvent considérée comme liée à la quête pour transformer le plomb ou d'autres métaux de base en or, bien que les alchimistes se soient également intéressés à de nombreuses questions de la chimie moderne.
Le mot moderne alchimie à son tour est dérivé du mot arabe al-kīmīā ( الكیمیاء ). Cela peut avoir des origines égyptiennes puisque al-kīmīā est dérivé du grec ancien χημία , qui est à son tour dérivé du mot Kemet , qui est l'ancien nom de l'Égypte dans la langue égyptienne. Alternativement, al-kīmīā peut dériver de χημεία 'faire ensemble'.
Principes modernes
Le modèle actuel de la structure atomique est le modèle de la mécanique quantique . La chimie traditionnelle commence par l'étude des particules élémentaires , atomes , molécules , substances , métaux , cristaux et autres agrégats de matière . La matière peut être étudiée sous forme solide, liquide, gaz et de plasma états , isolément ou en combinaison. Les interactions , réactions et transformations étudiées en chimie sont généralement le résultat d'interactions entre atomes, conduisant à des réarrangements des liaisons chimiques qui maintiennent les atomes ensemble. De tels comportements sont étudiés dans un laboratoire de chimie .
Le laboratoire de chimie utilise de manière stéréotypée diverses formes de verrerie de laboratoire . Cependant, la verrerie n'est pas au cœur de la chimie, et une grande partie de la chimie expérimentale (ainsi qu'appliquée/industrielle) se fait sans elle.

Une réaction chimique est une transformation de certaines substances en une ou plusieurs substances différentes. La base d'une telle transformation chimique est le réarrangement des électrons dans les liaisons chimiques entre les atomes. Il peut être représenté symboliquement par une équation chimique , qui implique généralement des atomes comme sujets. Le nombre d'atomes à gauche et à droite dans l'équation d'une transformation chimique est égal. (Lorsque le nombre d'atomes de chaque côté est inégal, la transformation est appelée réaction nucléaire ou désintégration radioactive .) Le type de réactions chimiques qu'une substance peut subir et les changements d'énergie qui peuvent l'accompagner sont limités par certaines règles de base, connues sous le nom de lois chimiques .
Les considérations d'énergie et d' entropie sont invariablement importantes dans presque toutes les études chimiques. Les substances chimiques sont classées en fonction de leur structure , de leur phase ainsi que de leur composition chimique . Ils peuvent être analysés à l'aide des outils d' analyse chimique , par exemple la spectroscopie et la chromatographie . Les scientifiques engagés dans la recherche chimique sont connus sous le nom de chimistes . La plupart des chimistes se spécialisent dans une ou plusieurs sous-disciplines. Plusieurs concepts sont essentiels pour l'étude de la chimie; Certains d'entre eux sont:
Question
En chimie, la matière est définie comme tout ce qui a une masse et un volume au repos (il prend de la place) et est constitué de particules . Les particules qui composent la matière ont également une masse au repos - toutes les particules n'ont pas de masse au repos, comme le photon . La matière peut être une substance chimique pure ou un mélange de substances.
Atome

L'atome est l'unité de base de la chimie. Il est constitué d'un noyau dense appelé noyau atomique entouré d'un espace occupé par un nuage d'électrons . Le noyau est composé de protons chargés positivement et de neutrons non chargés (appelés ensemble nucléons ), tandis que le nuage d'électrons est constitué d' électrons chargés négativement qui orbitent autour du noyau. Dans un atome neutre, les électrons chargés négativement compensent la charge positive des protons. Le noyau est dense ; la masse d'un nucléon est d'environ 1 836 fois celle d'un électron, mais le rayon d'un atome est d'environ 10 000 fois celui de son noyau.
L'atome est également la plus petite entité qui peut être envisagée pour conserver les propriétés chimiques de l'élément, telles que l' électronégativité , le potentiel d'ionisation , le ou les états d'oxydation préférés , le nombre de coordination et les types préférés de liaisons à former (par exemple, métallique , ionique , covalente ).
Élément
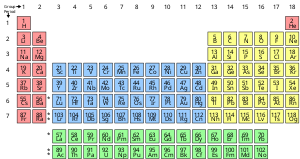
Un élément chimique est une substance pure composée d'un seul type d'atome, caractérisé par son nombre particulier de protons dans le noyau de ses atomes, appelé numéro atomique et représenté par le symbole Z . Le nombre de masse est la somme du nombre de protons et de neutrons dans un noyau. Bien que tous les noyaux de tous les atomes appartenant à un élément aient le même numéro atomique, ils n'ont pas nécessairement le même nombre de masse ; les atomes d'un élément qui ont des nombres de masse différents sont appelés isotopes . Par exemple, tous les atomes avec 6 protons dans leur noyau sont des atomes de l'élément chimique carbon , mais les atomes de carbone peuvent avoir des nombres de masse de 12 ou 13.
La présentation standard des éléments chimiques se trouve dans le tableau périodique , qui classe les éléments par numéro atomique. Le tableau périodique est organisé en groupes , ou colonnes, et périodes , ou lignes. Le tableau périodique est utile pour identifier les tendances périodiques .
Composé

Un composé est une substance chimique pure composée de plusieurs éléments. Les propriétés d'un composé ont peu de similitude avec celles de ses éléments. La nomenclature standard des composés est établie par l' Union internationale de chimie pure et appliquée (IUPAC). Les composés organiques sont nommés selon le système de nomenclature organique . Les noms des composés inorganiques sont créés selon le système de nomenclature inorganique . Lorsqu'un composé a plus d'un composant, ils sont alors divisés en deux classes, les composants électropositifs et les composants électronégatifs. De plus, le Chemical Abstracts Service a mis au point une méthode pour indexer les substances chimiques. Dans ce schéma, chaque substance chimique est identifiable par un numéro appelé numéro de registre CAS .
Molécule

Une molécule est la plus petite portion indivisible d'une substance chimique pure qui possède son ensemble unique de propriétés chimiques, c'est-à-dire son potentiel à subir un certain ensemble de réactions chimiques avec d'autres substances. Cependant, cette définition ne fonctionne bien que pour les substances composées de molécules, ce qui n'est pas le cas de nombreuses substances (voir ci-dessous). Les molécules sont généralement un ensemble d'atomes liés entre eux par des liaisons covalentes , de sorte que la structure est électriquement neutre et que tous les électrons de valence sont appariés avec d'autres électrons soit dans des liaisons, soit en paires isolées .
Ainsi, les molécules existent en tant qu'unités électriquement neutres, contrairement aux ions. Lorsque cette règle est enfreinte, donnant une charge à la "molécule", le résultat est parfois appelé ion moléculaire ou ion polyatomique. Cependant, la nature discrète et séparée du concept moléculaire nécessite généralement que les ions moléculaires soient présents uniquement sous une forme bien séparée, telle qu'un faisceau dirigé dans le vide dans un spectromètre de masse . Les collections polyatomiques chargées résidant dans des solides (par exemple, des ions sulfate ou nitrate communs) ne sont généralement pas considérées comme des « molécules » en chimie. Certaines molécules contiennent un ou plusieurs électrons non appariés, créant des radicaux . La plupart des radicaux sont relativement réactifs, mais certains, comme l'oxyde nitrique (NO) peuvent être stables.
Les éléments « inertes » ou gaz rares ( hélium , néon , argon , krypton , xénon et radon ) sont composés d'atomes isolés comme leur plus petite unité discrète, mais les autres éléments chimiques isolés sont constitués de molécules ou de réseaux d'atomes liés les uns aux autres. en quelque sorte. Les molécules identifiables composent des substances familières telles que l'eau, l'air et de nombreux composés organiques comme l'alcool, le sucre, l'essence et les divers produits pharmaceutiques .
Cependant, toutes les substances ou composés chimiques ne sont pas constitués de molécules discrètes, et en effet la plupart des substances solides qui composent la croûte solide, le manteau et le noyau de la Terre sont des composés chimiques sans molécules. Ces autres types de substances, tels que les composés ioniques et les solides en réseau , sont organisés de manière à ne pas comporter de molécules identifiables en soi . Au lieu de cela, ces substances sont discutées en termes d' unités de formule ou de cellules unitaires comme la plus petite structure répétitive au sein de la substance. Des exemples de telles substances sont les sels minéraux (tels que le sel de table ), les solides comme le carbone et le diamant, les métaux et les minéraux de silice et de silicate familiers tels que le quartz et le granit.
L'une des principales caractéristiques d'une molécule est sa géométrie souvent appelée sa structure . Alors que la structure des molécules diatomiques, triatomiques ou tétra-atomiques peut être triviale, (linéaire, pyramidale angulaire etc.) la structure des molécules polyatomiques, qui sont constituées de plus de six atomes (de plusieurs éléments) peut être cruciale pour sa nature chimique .
Substance et mélange
 
| |
 
| |
 
| |
| Exemples de substances chimiques pures. De gauche à droite : les éléments étain (Sn) et soufre (S), le diamant (un allotrope de carbone ), le saccharose (sucre pur) et le chlorure de sodium (sel) et le bicarbonate de sodium (bicarbonate de soude), qui sont tous deux des composés ioniques . |
Une substance chimique est une sorte de matière avec une composition définie et un ensemble de propriétés . Un ensemble de substances s'appelle un mélange. Des exemples de mélanges sont l' air et les alliages .
Mole et quantité de substance
La taupe est une unité de mesure qui désigne une quantité de substance (également appelée quantité chimique). Une mole est définie pour contenir exactement6,022 140 76 × 10 23 particules ( atomes , molécules , ions ou électrons ) , où le nombre de particules par mole est appelé constante d' Avogadro . La concentration molaire est la quantité d'une substance particulière par volume de solution et est généralement exprimée en mol/ dm 3 .
Phase
En plus des propriétés chimiques spécifiques qui distinguent les différentes classifications chimiques, les produits chimiques peuvent exister en plusieurs phases. Pour la plupart, les classifications chimiques sont indépendantes de ces classifications de phase en vrac ; cependant, certaines phases plus exotiques sont incompatibles avec certaines propriétés chimiques. Une phase est un ensemble d'états d'un système chimique qui ont des propriétés structurelles en vrac similaires, dans une gamme de conditions, telles que la pression ou la température .
Les propriétés physiques, telles que la densité et l' indice de réfraction ont tendance à se situer dans les valeurs caractéristiques de la phase. La phase de la matière est définie par la transition de phase , c'est-à-dire lorsque l'énergie introduite ou retirée du système réorganise la structure du système, au lieu de modifier les conditions générales.
Parfois, la distinction entre les phases peut être continue au lieu d'avoir une frontière discrète. Dans ce cas, la matière est considérée comme étant dans un état supercritique . Lorsque trois états se rencontrent en fonction des conditions, cela s'appelle un point triple et, comme c'est invariant, c'est un moyen pratique de définir un ensemble de conditions.
Les exemples les plus connus de phases sont les solides , les liquides et les gaz . De nombreuses substances présentent plusieurs phases solides. Par exemple, il existe trois phases de fer solide (alpha, gamma et delta) qui varient en fonction de la température et de la pression. Une différence principale entre les phases solides est la structure cristalline , ou l'arrangement, des atomes. Une autre phase couramment rencontrée dans l'étude de la chimie est la phase aqueuse , qui est l'état des substances dissoutes en solution aqueuse (c'est-à-dire dans l'eau).
Les phases moins connues comprennent les plasmas , les condensats de Bose-Einstein et les condensats fermioniques et les phases paramagnétiques et ferromagnétiques des matériaux magnétiques . Alors que la plupart des phases familières traitent des systèmes tridimensionnels, il est également possible de définir des analogues dans les systèmes bidimensionnels, qui ont retenu l'attention pour leur pertinence pour les systèmes en biologie .
Collage

On dit que les atomes collés ensemble dans des molécules ou des cristaux sont liés les uns aux autres. Une liaison chimique peut être visualisée comme l' équilibre multipolaire entre les charges positives dans les noyaux et les charges négatives oscillant autour d'eux. Plus que de simples attraction et répulsion, les énergies et les distributions caractérisent la disponibilité d'un électron pour se lier à un autre atome.
Une liaison chimique peut être une liaison covalente , une liaison ionique , une liaison hydrogène ou simplement à cause de la force de Van der Waals . Chacun de ces types de liens est attribué à un certain potentiel. Ces potentiels créent les interactions qui maintiennent les atomes ensemble dans des molécules ou des cristaux . Dans de nombreux composés simples, la théorie des liaisons de valence , le modèle de répulsion des paires d'électrons de Valence Shell ( VSEPR ) et le concept de nombre d'oxydation peuvent être utilisés pour expliquer la structure et la composition moléculaires.
Une liaison ionique se forme lorsqu'un métal perd un ou plusieurs de ses électrons, devenant un cation chargé positivement, et les électrons sont ensuite gagnés par l'atome non métallique, devenant un anion chargé négativement. Les deux ions de charge opposée s'attirent et la liaison ionique est la force d'attraction électrostatique entre eux. Par exemple, le sodium (Na), un métal, perd un électron pour devenir un cation Na + tandis que le chlore (Cl), un non-métal, gagne cet électron pour devenir Cl − . Les ions sont maintenus ensemble en raison de l'attraction électrostatique et ce composé de chlorure de sodium (NaCl), ou sel de table commun, est formé.

Dans une liaison covalente, une ou plusieurs paires d' électrons de valence sont partagées par deux atomes : le groupe électriquement neutre résultant d'atomes liés est appelé molécule . Les atomes partageront des électrons de valence de manière à créer une configuration électronique de gaz noble (huit électrons dans leur enveloppe la plus externe) pour chaque atome. On dit que les atomes qui ont tendance à se combiner de telle sorte qu'ils ont chacun huit électrons dans leur couche de valence suivent la règle de l' octet . Cependant, certains éléments comme l' hydrogène et le lithium n'ont besoin que de deux électrons dans leur enveloppe la plus externe pour atteindre cette configuration stable ; on dit que ces atomes suivent la règle du duo , et de cette façon ils atteignent la configuration électronique du gaz noble hélium , qui a deux électrons dans sa couche externe.
De même, les théories de la physique classique peuvent être utilisées pour prédire de nombreuses structures ioniques. Avec des composés plus compliqués, tels que les complexes métalliques , la théorie des liaisons de valence est moins applicable et des approches alternatives, telles que la théorie des orbitales moléculaires , sont généralement utilisées. Voir schéma sur les orbitales électroniques.
Énergie
Dans le contexte de la chimie, l'énergie est un attribut d'une substance en raison de sa structure atomique , moléculaire ou agrégée . Puisqu'une transformation chimique s'accompagne d'un changement dans un ou plusieurs de ces types de structures, elle s'accompagne invariablement d'une augmentation ou d'une diminution de l' énergie des substances impliquées. Une partie de l'énergie est transférée entre l'environnement et les réactifs de la réaction sous forme de chaleur ou de lumière ; ainsi les produits d'une réaction peuvent avoir plus ou moins d'énergie que les réactifs.
Une réaction est dite exergonique si l'état final est plus bas sur l'échelle énergétique que l'état initial ; dans le cas des réactions endergoniques, la situation est inverse. Une réaction est dite exothermique si la réaction libère de la chaleur dans l'environnement ; dans le cas des réactions endothermiques , la réaction absorbe la chaleur de l'environnement.
Les réactions chimiques sont invariablement impossibles à moins que les réactifs ne franchissent une barrière énergétique appelée énergie d'activation . La vitesse d'une réaction chimique (à une température donnée T) est liée à l'énergie d'activation E, par le facteur de population de Boltzmann – c'est-à-dire la probabilité qu'une molécule ait une énergie supérieure ou égale à E à la température donnée T. Cette exponentielle La dépendance d'une vitesse de réaction à la température est connue sous le nom d' équation d'Arrhenius . L'énergie d'activation nécessaire pour qu'une réaction chimique se produise peut être sous forme de chaleur, de lumière, d' électricité ou de force mécanique sous forme d' ultrasons .
Un concept connexe d'énergie libre , qui intègre également des considérations d'entropie, est un moyen très utile pour prédire la faisabilité d'une réaction et déterminer l'état d'équilibre d'une réaction chimique, en thermodynamique chimique . Une réaction n'est réalisable que si la variation totale de l' énergie libre de Gibbs est négative ; s'il est égal à zéro, la réaction chimique est dite à l' équilibre .
Il n'existe que des états d'énergie possibles limités pour les électrons, les atomes et les molécules. Celles-ci sont déterminées par les règles de la mécanique quantique , qui nécessitent la quantification de l'énergie d'un système lié. Les atomes/molécules dans un état d'énergie plus élevé sont dits excités. Les molécules/atomes de substance dans un état d'énergie excitée sont souvent beaucoup plus réactifs ; c'est-à-dire plus propice aux réactions chimiques.
La phase d'une substance est invariablement déterminée par son énergie et l'énergie de son environnement. Lorsque les forces intermoléculaires d'une substance sont telles que l'énergie du milieu n'est pas suffisante pour les vaincre, elle se produit dans une phase plus ordonnée comme liquide ou solide comme c'est le cas avec l'eau (H 2 O) ; un liquide à température ambiante car ses molécules sont liées par des liaisons hydrogène . Alors que le sulfure d'hydrogène (H 2 S) est un gaz à température ambiante et à pression standard, car ses molécules sont liées par des interactions dipôle-dipôle plus faibles .
Le transfert d'énergie d'une substance chimique à une autre dépend de la taille des quanta d' énergie émis par une substance. Cependant, l'énergie thermique est souvent transférée plus facilement de presque n'importe quelle substance à une autre car les phonons responsables des niveaux d'énergie de vibration et de rotation dans une substance ont beaucoup moins d'énergie que les photons invoqués pour le transfert d'énergie électronique. Ainsi, comme les niveaux d'énergie vibratoire et rotationnelle sont plus rapprochés que les niveaux d'énergie électronique, la chaleur est plus facilement transférée entre les substances par rapport à la lumière ou à d'autres formes d'énergie électronique. Par exemple, le rayonnement électromagnétique ultraviolet n'est pas transféré avec autant d'efficacité d'une substance à une autre que l'énergie thermique ou électrique.
L'existence de niveaux d'énergie caractéristiques pour différentes substances chimiques est utile pour leur identification par l'analyse des raies spectrales . Différents types de spectres sont souvent utilisés en spectroscopie chimique , par exemple IR , micro - ondes , RMN , ESR , etc. La spectroscopie est également utilisée pour identifier la composition d'objets distants - comme les étoiles et les galaxies lointaines - en analysant leurs spectres de rayonnement.

Le terme énergie chimique est souvent utilisé pour indiquer le potentiel d'une substance chimique à subir une transformation par une réaction chimique ou à transformer d'autres substances chimiques.
Réaction

Lorsqu'une substance chimique est transformée à la suite de son interaction avec une autre substance ou avec de l'énergie, on dit qu'une réaction chimique s'est produite. Une réaction chimique est donc un concept lié à la « réaction » d'une substance lorsqu'elle entre en contact étroit avec une autre, que ce soit sous forme de mélange ou de solution ; exposition à une forme d'énergie, ou les deux. Il en résulte un échange d'énergie entre les constituants de la réaction ainsi qu'avec l'environnement du système, qui peuvent être des récipients conçus, souvent de la verrerie de laboratoire .
Les réactions chimiques peuvent entraîner la formation ou la dissociation de molécules, c'est-à-dire la rupture de molécules pour former deux molécules ou plus ou le réarrangement d'atomes à l'intérieur ou entre les molécules. Les réactions chimiques impliquent généralement la création ou la rupture de liaisons chimiques. L'oxydation, la réduction , la dissociation , la neutralisation acide-base et le réarrangement moléculaire sont quelques-uns des types de réactions chimiques couramment utilisés.
Une réaction chimique peut être représentée symboliquement par une équation chimique . Alors que dans une réaction chimique non nucléaire, le nombre et le type d'atomes des deux côtés de l'équation sont égaux, pour une réaction nucléaire, cela n'est vrai que pour les particules nucléaires, à savoir. protons et neutrons.
La séquence d'étapes au cours de laquelle la réorganisation des liaisons chimiques peut avoir lieu au cours d'une réaction chimique est appelée son mécanisme . On peut imaginer qu'une réaction chimique se déroule en un certain nombre d'étapes, chacune pouvant avoir une vitesse différente. De nombreux intermédiaires réactionnels à stabilité variable peuvent ainsi être envisagés au cours d'une réaction. Des mécanismes de réaction sont proposés pour expliquer la cinétique et le mélange relatif de produits d'une réaction. De nombreux physico-chimistes se spécialisent dans l'exploration et la proposition des mécanismes de diverses réactions chimiques. Plusieurs règles empiriques, comme les règles de Woodward-Hoffmann sont souvent utiles tout en proposant un mécanisme pour une réaction chimique.
Selon le livre d'or de l' IUPAC , une réaction chimique est « un processus qui entraîne l'interconversion d'espèces chimiques ». Par conséquent, une réaction chimique peut être une réaction élémentaire ou une réaction par étapes . Une mise en garde supplémentaire est faite, en ce que cette définition inclut les cas où l' interconversion des conformères est observable expérimentalement. De telles réactions chimiques détectables impliquent normalement des ensembles d'entités moléculaires comme indiqué par cette définition, mais il est souvent conceptuellement pratique d'utiliser le terme également pour des changements impliquant des entités moléculaires uniques (c'est-à-dire des « événements chimiques microscopiques »).
Ions et sels
Un ion est une espèce chargée, un atome ou une molécule, qui a perdu ou gagné un ou plusieurs électrons. Lorsqu'un atome perd un électron et a donc plus de protons que d'électrons, l'atome est un ion ou un cation chargé positivement . Lorsqu'un atome gagne un électron et a donc plus d'électrons que de protons, l'atome est un ion ou un anion chargé négativement . Les cations et les anions peuvent former un réseau cristallin de sels neutres , tels que les ions Na + et Cl − formant du chlorure de sodium , ou NaCl. Des exemples d' ions polyatomiques qui ne se séparent pas au cours des réactions acide-base sont l' hydroxyde (OH − ) et le phosphate (PO 4 3− ).
Le plasma est composé de matière gazeuse qui a été complètement ionisée, généralement à haute température.
Acidité et basicité

Une substance peut souvent être classée comme un acide ou une base . Il existe plusieurs théories différentes qui expliquent le comportement acide-base. La plus simple est la théorie d'Arrhenius , qui stipule que l'acide est une substance qui produit des ions hydronium lorsqu'elle est dissoute dans l'eau, et une base est une base qui produit des ions hydroxyde lorsqu'elle est dissoute dans l'eau. Selon la théorie acide-base de Brønsted-Lowry , les acides sont des substances qui donnent un ion hydrogène positif à une autre substance lors d'une réaction chimique; par extension, une base est la substance qui reçoit cet ion hydrogène.
Une troisième théorie commune est la théorie acide-base de Lewis , qui est basée sur la formation de nouvelles liaisons chimiques. La théorie de Lewis explique qu'un acide est une substance capable d'accepter une paire d'électrons d'une autre substance pendant le processus de formation de liaison, tandis qu'une base est une substance qui peut fournir une paire d'électrons pour former une nouvelle liaison. Selon cette théorie, les choses cruciales échangées sont des charges. Il existe plusieurs autres façons de classer une substance en tant qu'acide ou base, comme le montre l'histoire de ce concept.
La force de l'acide est généralement mesurée par deux méthodes. Une mesure, basée sur la définition d'Arrhenius de l'acidité, est le pH , qui est une mesure de la concentration en ions hydronium dans une solution, exprimée sur une échelle logarithmique négative . Ainsi, les solutions qui ont un pH bas ont une concentration élevée en ions hydronium et peuvent être dites plus acides. L'autre mesure, basée sur la définition de Brønsted-Lowry, est la constante de dissociation acide (K a ), qui mesure la capacité relative d'une substance à agir comme un acide selon la définition de Brønsted-Lowry d'un acide. Autrement dit, les substances ayant un K supérieur à y faire un don plus susceptibles d' ions hydrogène dans des réactions chimiques que celles inférieures à K a les valeurs.
Redox
Redox ( rouge uction- boeuf réactions idation) comprennent toutes les réactions chimiques dans lesquelles les atomes ont leur état d'oxydation modifié soit par des électrons gagnent (réduction) ou perdre des électrons (oxydation). Les substances qui ont la capacité d'oxyder d'autres substances sont dites oxydantes et sont appelées agents oxydants, oxydants ou oxydants. Un oxydant retire les électrons d'une autre substance. De même, les substances qui ont la capacité de réduire d'autres substances sont dites réductrices et sont appelées agents réducteurs, réducteurs ou réducteurs.
Un réducteur transfère des électrons à une autre substance et est ainsi lui-même oxydé. Et parce qu'il "donne" des électrons, on l'appelle aussi un donneur d'électrons. L'oxydation et la réduction font correctement référence à un changement du nombre d'oxydation - le transfert réel d'électrons peut ne jamais se produire. Ainsi, l'oxydation est mieux définie comme une augmentation du nombre d'oxydation et la réduction comme une diminution du nombre d'oxydation.
Équilibre
Bien que le concept d' équilibre soit largement utilisé dans toutes les sciences, dans le contexte de la chimie, il apparaît chaque fois qu'un certain nombre d'états différents de la composition chimique sont possibles, comme par exemple dans un mélange de plusieurs composés chimiques qui peuvent réagir les uns avec les autres, ou lorsqu'une substance peut être présente dans plus d'un type de phase.
Un système de substances chimiques à l'équilibre, bien qu'ayant une composition immuable, n'est le plus souvent pas statique ; les molécules des substances continuent à réagir les unes avec les autres donnant ainsi lieu à un équilibre dynamique . Ainsi, le concept décrit l'état dans lequel les paramètres tels que la composition chimique restent inchangés dans le temps.
Lois chimiques
Les réactions chimiques sont régies par certaines lois, qui sont devenues des concepts fondamentaux en chimie. Certains d'entre eux sont:
- La loi d'Avogadro
- Loi Bière-Lambert
- La loi de Boyle (1662, reliant la pression et le volume)
- La loi de Charles (1787, reliant le volume et la température)
- Les lois de diffusion de Fick
- Loi de Gay-Lussac (1809, reliant pression et température)
- Le principe de Le Chatelier
- La loi d'Henri
- La loi de Hess
- La loi de conservation de l'énergie conduit aux concepts importants d' équilibre , de thermodynamique et de cinétique .
- La loi de conservation de la masse continue d'être conservée dans les systèmes isolés , même en physique moderne. Cependant, la relativité restreinte montre qu'en raison de l'équivalence masse-énergie , chaque fois qu'une "énergie" non matérielle (chaleur, lumière, énergie cinétique) est retirée d'un système non isolé, une certaine masse sera perdue avec lui. Les pertes d'énergie élevées entraînent la perte de quantités de masse pesables, un sujet important en chimie nucléaire .
- Loi de composition définie , bien que dans de nombreux systèmes (notamment les biomacromolécules et les minéraux), les rapports ont tendance à nécessiter de grands nombres et sont fréquemment représentés sous forme de fraction.
- Loi des proportions multiples
- La loi de Raoult
Histoire
L' histoire de la chimie s'étend sur une période allant des temps très anciens à nos jours. Depuis plusieurs millénaires avant JC, les civilisations utilisaient des technologies qui finiraient par former la base des différentes branches de la chimie. Les exemples incluent l'extraction de métaux à partir de minerais , la fabrication de poteries et de glaçures, la fermentation de bière et de vin, l'extraction de produits chimiques à partir de plantes pour la médecine et le parfum, la transformation de graisse en savon , la fabrication de verre et la fabrication d' alliages comme le bronze . La chimie a été précédée par sa protoscience, l' alchimie , qui est une approche intuitive mais non scientifique pour comprendre les constituants de la matière et leurs interactions. Il n'a pas réussi à expliquer la nature de la matière et ses transformations, mais, en réalisant des expériences et en enregistrant les résultats, les alchimistes ont ouvert la voie à la chimie moderne. La chimie en tant qu'ensemble de connaissances distinct de l'alchimie a commencé à émerger lorsqu'une distinction claire a été faite entre elles par Robert Boyle dans son ouvrage The Skeptical Chymist (1661). Bien que les deux l' alchimie et la chimie sont concernés par la matière et ses transformations, la différence cruciale a été donnée par la méthode scientifique que les chimistes employés dans leur travail. La chimie est considérée comme étant devenue une science établie avec les travaux d' Antoine Lavoisier , qui a développé une loi de conservation de la masse qui exigeait une mesure minutieuse et des observations quantitatives des phénomènes chimiques. L'histoire de la chimie se confond avec l' histoire de la thermodynamique , notamment à travers les travaux de Willard Gibbs .
Définition
La définition de la chimie a changé au fil du temps, à mesure que de nouvelles découvertes et théories ajoutent à la fonctionnalité de la science. Le terme « chimie », selon le scientifique renommé Robert Boyle en 1661, désignait le sujet des principes matériels des corps mixtes. En 1663, le chimiste Christopher Glaser décrivit la « chimie » comme un art scientifique, par lequel on apprend à dissoudre les corps, et à en tirer les différentes substances de leur composition, et comment les réunir à nouveau, et les exalter à une plus haute perfection.
La définition de 1730 du mot "chimie", telle qu'utilisée par Georg Ernst Stahl , signifiait l'art de résoudre les corps mixtes, composés ou agrégés en leurs principes; et de composer de tels corps à partir de ces principes. En 1837, Jean-Baptiste Dumas considérait que le mot « chimie » faisait référence à la science concernée par les lois et les effets des forces moléculaires. Cette définition a encore évolué jusqu'à ce qu'en 1947, elle désigne la science des substances : leur structure, leurs propriétés et les réactions qui les transforment en d'autres substances – une caractérisation acceptée par Linus Pauling . Plus récemment, en 1998, le professeur Raymond Chang a élargi la définition de « chimie » pour désigner l'étude de la matière et des changements qu'elle subit.
La discipline
Les premières civilisations, comme les Egyptiens, les Babyloniens et les Indiens, ont accumulé des connaissances pratiques concernant les arts de la métallurgie, de la poterie et des teintures, mais n'ont pas développé de théorie systématique.
Une hypothèse chimique de base a d'abord émergé dans la Grèce classique avec la théorie des quatre éléments telle qu'elle a été proposée définitivement par Aristote affirmant que le feu , l' air , la terre et l' eau étaient les éléments fondamentaux à partir desquels tout est formé en tant que combinaison. Grecque atomisme remonte à 440 avant JC, résultant dans des œuvres de philosophes tels que Démocrite et Epicure . En 50 avant notre ère, le philosophe romain Lucrèce a développé la théorie dans son livre De rerum natura (Sur la nature des choses). Contrairement aux concepts scientifiques modernes, l'atomisme grec était de nature purement philosophique, avec peu d'intérêt pour les observations empiriques et aucun intérêt pour les expériences chimiques.
Une première forme de l'idée de conservation de la masse est la notion que « Rien ne vient de rien » dans la philosophie grecque antique , que l'on peut trouver chez Empédocle (environ 4e siècle avant JC) : « car il est impossible que quoi que ce soit de ce qui n'est pas, et il ne peut pas être provoqué ou entendu dire que ce qui est doit être complètement détruit. » et Epicure (3ème siècle avant JC), qui, décrivant la nature de l'Univers, a écrit que « la totalité des choses a toujours été telle qu'elle est maintenant et sera toujours ».

Dans le monde hellénistique, l'art de l'alchimie a d'abord proliféré, mêlant magie et occultisme à l'étude des substances naturelles dans le but ultime de transmuter des éléments en or et de découvrir l'élixir de vie éternelle. Les travaux, en particulier le développement de la distillation , se sont poursuivis au début de la période byzantine , le praticien le plus célèbre étant le grec-égyptien Zosimos de Panopolis du IVe siècle . L'alchimie a continué à être développée et pratiquée dans tout le monde arabe après les conquêtes musulmanes , et à partir de là, et à partir des vestiges byzantins, diffusée dans l' Europe médiévale et de la Renaissance grâce à des traductions latines.
Le développement de la méthode scientifique moderne était lent et ardu, mais une première méthode scientifique pour la chimie a commencé à émerger parmi les premiers chimistes musulmans, à commencer par le chimiste perso-arabe du IXe siècle Jābir ibn Hayyān , communément appelé « le père de la chimie ». Les ouvrages arabes qui lui sont attribués introduisent une classification systématique des substances chimiques et fournissent des instructions pour dériver un composé inorganique ( sal ammoniac ou chlorure d'ammonium ) à partir de substances organiques (telles que les plantes, le sang et les cheveux) par des moyens chimiques. Certaines œuvres jabiriennes arabes (par exemple, le "Livre de la Miséricorde" et le "Livre des Soixante-dix") ont ensuite été traduites en latin sous le nom latinisé "Geber", et dans l'Europe du XIIIe siècle, un écrivain anonyme, généralement appelé pseudo -Geber , a commencé à produire des écrits alchimiques et métallurgiques sous ce nom. Plus tard, des philosophes musulmans influents, tels qu'Abū al-Rayhān al-Bīrūnī et Avicenne, ont contesté les théories de l'alchimie, en particulier la théorie de la transmutation des métaux .
Sous l'influence des nouvelles méthodes empiriques proposées par Sir Francis Bacon et d'autres, un groupe de chimistes d' Oxford , Robert Boyle , Robert Hooke et John Mayow a commencé à remodeler les anciennes traditions alchimiques en une discipline scientifique. Boyle en particulier est considéré comme le père fondateur de la chimie en raison de son travail le plus important, le texte de chimie classique The Skeptical Chymist où la différenciation est faite entre les revendications de l'alchimie et les découvertes scientifiques empiriques de la nouvelle chimie. Il a formulé la loi de Boyle , a rejeté les "quatre éléments" classiques et a proposé une alternative mécaniste d'atomes et de réactions chimiques qui pourraient être soumises à des expériences rigoureuses.

La théorie du phlogiston (une substance à l'origine de toute combustion) a été proposée par l'Allemand Georg Ernst Stahl au début du XVIIIe siècle et n'a été renversée qu'à la fin du siècle par le chimiste français Antoine Lavoisier , l'analogue chimique de Newton en la physique; qui a fait plus que tout autre pour établir la nouvelle science sur une base théorique appropriée, en élucidant le principe de conservation de la masse et en développant un nouveau système de nomenclature chimique utilisé à ce jour.
Avant son travail, cependant, de nombreuses découvertes importantes avaient été faites, en particulier concernant la nature de «l'air» qui a été découvert comme étant composé de nombreux gaz différents. Le chimiste écossais Joseph Black (le premier chimiste expérimental) et le flamand Jan Baptist van Helmont découvrirent le dioxyde de carbone , ou ce que Black appela « air fixe » en 1754 ; Henry Cavendish a découvert l' hydrogène et a élucidé ses propriétés et Joseph Priestley et, indépendamment, Carl Wilhelm Scheele ont isolé l' oxygène pur .
Le scientifique anglais John Dalton a proposé la théorie moderne des atomes ; que toutes les substances sont composées d'"atomes" indivisibles de matière et que les différents atomes ont des poids atomiques variables.
Le développement de la théorie électrochimique des combinaisons chimiques s'est produit au début du XIXe siècle grâce aux travaux de deux scientifiques en particulier, Jöns Jacob Berzelius et Humphry Davy , rendus possibles par l'invention préalable de la pile voltaïque par Alessandro Volta . Davy a découvert neuf nouveaux éléments dont les métaux alcalins en les extrayant de leurs oxydes avec un courant électrique.

Le Britannique William Prout a d' abord proposé de classer tous les éléments par leur poids atomique, car tous les atomes avaient un poids qui était un multiple exact du poids atomique de l'hydrogène. JAR Newlands a conçu un premier tableau des éléments, qui a ensuite été développé dans le tableau périodique des éléments moderne dans les années 1860 par Dmitri Mendeleev et indépendamment par plusieurs autres scientifiques, dont Julius Lothar Meyer . Les gaz inertes, appelés plus tard les gaz nobles, ont été découverts par William Ramsay en collaboration avec Lord Rayleigh à la fin du siècle, remplissant ainsi la structure de base du tableau.

En bas : Résultats observés : une petite partie des particules a été déviée, indiquant une petite charge concentrée .
Au tournant du vingtième siècle, les fondements théoriques de la chimie ont finalement été compris grâce à une série de découvertes remarquables qui ont réussi à sonder et à découvrir la nature même de la structure interne des atomes. En 1897, JJ Thomson de l'université de Cambridge découvrit l' électron et peu après le scientifique français Becquerel ainsi que le couple Pierre et Marie Curie enquêtèrent sur le phénomène de la radioactivité . Dans une série d'expériences de diffusion pionnières, Ernest Rutherford de l' Université de Manchester a découvert la structure interne de l'atome et l'existence du proton, a classé et expliqué les différents types de radioactivité et a réussi à transmuter le premier élément en bombardant de l' azote avec des particules alpha .
Ses travaux sur la structure atomique ont été améliorés par ses étudiants, le physicien danois Niels Bohr et Henry Moseley . La théorie électronique des liaisons chimiques et des orbitales moléculaires a été développée par les scientifiques américains Linus Pauling et Gilbert N. Lewis .
L'année 2011 a été déclarée par les Nations Unies comme l'Année internationale de la chimie. Il s'agissait d'une initiative de l'Union internationale de chimie pure et appliquée et de l'Organisation des Nations Unies pour l'éducation, la science et la culture et impliquait des sociétés chimiques, des universitaires et des institutions du monde entier et s'appuyait sur des initiatives individuelles pour organiser des activités locales et régionales.
La chimie organique a été développée par Justus von Liebig et d'autres, à la suite de la synthèse d' urée de Friedrich Wöhler qui a prouvé que les organismes vivants étaient, en théorie, réductibles à la chimie. D'autres avancées cruciales du 19ème siècle étaient; une compréhension de la liaison de valence ( Edward Frankland en 1852) et de l'application de la thermodynamique à la chimie ( JW Gibbs et Svante Arrhenius dans les années 1870).
S'entraîner
Sous-disciplines
La chimie est généralement divisée en plusieurs sous-disciplines principales. Il existe également plusieurs grands domaines transversaux et plus spécialisés de la chimie.
- La chimie analytique est l'analyse d'échantillons de matériaux pour mieux comprendre leur composition chimique et leur structure . La chimie analytique intègre des méthodes expérimentales normalisées en chimie. Ces méthodes peuvent être utilisées dans toutes les sous-disciplines de la chimie, à l'exclusion de la chimie purement théorique.
- La biochimie est l'étude des produits chimiques , des réactions chimiques et des interactions chimiques qui ont lieu dans les organismes vivants . La biochimie et la chimie organique sont étroitement liées, comme en chimie médicinale ou en neurochimie . La biochimie est également associée à la biologie moléculaire et à la génétique .
- La chimie inorganique est l'étude des propriétés et des réactions des composés inorganiques. La distinction entre les disciplines organiques et inorganiques n'est pas absolue et il y a beaucoup de chevauchements, surtout dans la sous-discipline de la chimie organométallique .
- La chimie des matériaux est la préparation, la caractérisation et la compréhension de substances ayant une fonction utile. Le domaine est une nouvelle étendue d'études dans les programmes d'études supérieures, et il intègre des éléments de tous les domaines classiques de la chimie en mettant l'accent sur les questions fondamentales qui sont propres aux matériaux. Les principaux systèmes d'étude comprennent la chimie des phases condensées (solides, liquides, polymères ) et les interfaces entre les différentes phases.
- La neurochimie est l'étude de la neurochimie ; y compris les transmetteurs, les peptides, les protéines, les lipides, les sucres et les acides nucléiques ; leurs interactions et les rôles qu'ils jouent dans la formation, le maintien et la modification du système nerveux.
- La chimie nucléaire est l'étude de la façon dont les particules subatomiques s'assemblent et forment des noyaux. La transmutation moderne est une composante importante de la chimie nucléaire, et la table des nucléides est un résultat et un outil important pour ce domaine.
- La chimie organique est l'étude de la structure, des propriétés, de la composition, des mécanismes et des réactions des composés organiques . Un composé organique est défini comme tout composé basé sur un squelette carboné.
- La chimie physique est l'étude des bases physiques et fondamentales des systèmes et processus chimiques. En particulier, l'énergétique et la dynamique de tels systèmes et processus intéressent les physiciens-chimistes. Les domaines d'étude importants comprennent la thermodynamique chimique , la cinétique chimique , l' électrochimie , la mécanique statistique , la spectroscopie et, plus récemment, l' astrochimie . La chimie physique a un grand chevauchement avec la physique moléculaire . La chimie physique implique l'utilisation du calcul infinitésimal pour dériver des équations. Il est généralement associé à la chimie quantique et à la chimie théorique. La chimie physique est une discipline distincte de la physique chimique , mais encore une fois, il y a un très fort chevauchement.
- La chimie théorique est l'étude de la chimie via un raisonnement théorique fondamental (généralement au sein des mathématiques ou de la physique ). En particulier, l'application de la mécanique quantique à la chimie est appelée chimie quantique . Depuis la fin de la Seconde Guerre mondiale , le développement des ordinateurs a permis un développement systématique de la chimie computationnelle , qui est l'art de développer et d'appliquer des programmes informatiques pour résoudre des problèmes chimiques. La chimie théorique a un grand chevauchement avec la physique de la matière condensée (théorique et expérimentale) et la physique moléculaire .
D'autres disciplines au sein de la chimie sont traditionnellement regroupées selon le type de matière étudiée ou le type d'étude. Ceux-ci incluent la chimie inorganique , l'étude de la matière inorganique ; chimie organique , l'étude de la matière organique (à base de carbone); la biochimie , l' étude des substances trouvées dans les organismes biologiques ; la chimie physique , l' étude des processus chimiques à l' aide de concepts physiques tels que la thermodynamique et la mécanique quantique ; et la chimie analytique , l' analyse d' échantillons de matériaux pour mieux comprendre leur composition chimique et leur structure . De nombreuses disciplines plus spécialisées ont vu le jour ces dernières années, par exemple la neurochimie l'étude chimique du système nerveux (voir sous - disciplines ).
D' autres domaines comprennent l' agrochimie , astrochimie (et cosmochimie ), la chimie atmosphérique , génie chimique , la biologie chimique , chimio-informatique , électrochimie , chimie de l' environnement , femtochimie , chimie des arômes , la chimie de l' écoulement , la géochimie , la chimie verte , histochimie , histoire de la chimie , la chimie d'hydrogénation , immunochimie , chimie marine , la science des matériaux , la chimie mathématique , mécanochimie , la chimie médicinale , la biologie moléculaire , la mécanique moléculaire , la nanotechnologie , la chimie des produits naturels , l' oenologie , la chimie organométallique , la pétrochimie , la pharmacologie , la photochimie , la chimie organique physique , phytochimiques , chimie des polymères , radiochemistry , la chimie du solide , sonochemistry , chimie supramoléculaire , chimie de surface , chimie de synthèse , thermochimie , et bien d' autres.
Industrie
L' industrie chimique représente une activité économique importante dans le monde. Les 50 premiers producteurs mondiaux de produits chimiques en 2013 ont réalisé un chiffre d'affaires de 980,5 milliards de dollars US avec une marge bénéficiaire de 10,3 %.
Sociétés professionnelles
- Société chimique américaine
- Société américaine de neurochimie
- Institut de chimie du Canada
- Société chimique du Pérou
- Union internationale de chimie pure et appliquée
- Institut royal australien de chimie
- Société royale néerlandaise de chimie
- Société royale de chimie
- Société de l'industrie chimique
- Association mondiale des chimistes théoriques et computationnels
- Liste des sociétés de chimie
Voir également
- Comparatif de logiciels de modélisation en mécanique moléculaire
- Glossaire des termes de chimie
- Année internationale de la chimie
- Liste des chimistes
- Liste des composés
- Liste des publications importantes en chimie
- Liste des problèmes non résolus en chimie
- Aperçu de la chimie
- Systèmes périodiques de petites molécules
- Philosophie de la chimie
- Tourisme scientifique
Les références
Bibliographie
- Atkins, Pierre ; de Paula, Julio (2009) [1992]. Éléments de chimie physique (5e éd.). New York : Oxford University Press . ISBN 978-0-19-922672-6.
- Terriers, Andrew ; Holman, Jean ; Parsons, André ; Pilling, Gwen; Prix, Gareth (2009). Chimie 3 . Italie : Oxford University Press . ISBN 978-0-19-927789-6.
- Housecroft, Catherine E.; Sharpe, Alan G. (2008) [2001]. Chimie inorganique (3e éd.). Harlow, Essex : Pearson Education . ISBN 978-0-13-175553-6.
Lectures complémentaires
- Lecture populaire
- Atkins, PW Galileo's Finger ( Oxford University Press ) ISBN 0-19-860941-8
- Atkins, Molécules de PW Atkins (Cambridge University Press) ISBN 0-521-82397-8
- Kean, Sam. The Disappearing Spoon - et d'autres histoires vraies du tableau périodique (Black Swan) Londres, 2010 ISBN 978-0-552-77750-6
- Levi, Primo The Periodic Table (Penguin Books) [1975] traduit de l'italien par Raymond Rosenthal (1984) ISBN 978-0-14-139944-7
- Stwertka, A. Un guide des éléments (Oxford University Press) ISBN 0-19-515027-9
- "Dictionnaire de l'histoire des idées" . Archivé de l'original le 10 mars 2008.
- . Encyclopédie Britannica . 6 (11e éd.). 1911. p. 33-76.
- Manuels d'introduction au premier cycle
- Atkins, PW, Overton, T., Rourke, J., Weller, M. et Armstrong, F. Shriver et Atkins chimie inorganique (4e édition) 2006 (Oxford University Press) ISBN 0-19-926463-5
- Chang, Raymond. Chimie 6e éd. Boston : James M. Smith, 1998. ISBN 0-07-115221-0 .
- Clayden, Jonathan ; Greeves, Nick ; Warren, Stuart ; Wothers, Peter (2001). Chimie organique (1ère éd.). Presses de l'Université d'Oxford. ISBN 978-0-19-850346-0.
- Voet et Voet Biochimie (Wiley) ISBN 0-471-58651-X
- Manuels avancés de premier cycle ou des cycles supérieurs
- Atkins, chimie physique PW (Oxford University Press) ISBN 0-19-879285-9
- Atkins, PW et al. Mécanique quantique moléculaire (Oxford University Press)
- McWeeny, Valence de R. Coulson (Oxford Science Publications) ISBN 0-19-855144-4
- Pauling, L. La nature de la liaison chimique (Cornell University Press) ISBN 0-8014-0333-2
- Pauling, L., et Wilson, EB Introduction à la mécanique quantique avec applications à la chimie (Dover Publications) ISBN 0-486-64871-0
- Smart and Moore Solid State Chemistry: An Introduction (Chapman et Hall) ISBN 0-412-40040-5
- Stephenson, G. Méthodes mathématiques pour les étudiants en sciences (Longman) ISBN 0-582-44416-0








