Crotamine - Crotamine
| Crotamine | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Identifiants | |||||||
| Organisme | ? | ||||||
| symbole | CRO2 | ||||||
| UniProt | Q9PWF3 | ||||||
| |||||||
Crotamine est une toxine présente dans le venin du Amérique du Sud serpent à sonnette ( crotale cascabelle terrificus ). C'est une protéine longue de 42 résidus contenant 11 résidus basiques (9 lysines , 2 arginines ) et 6 cystéines . Il a également été isolé du venin du crotale des prairies d'Amérique du Nord, Crotalus viridis viridis . Il a d'abord été isolé et purifié par le scientifique brésilien José Moura Gonçalves , puis étudié de manière intensive par son groupe de collaborateurs à la faculté de médecine de Ribeirão Preto de l' université de São Paulo .
Fonction biologique
La crotamine a de nombreuses actions biologiques : elle agit sur les canaux sodiques de la membrane cellulaire , est légèrement analgésique et est myotoxique, c'est-à-dire qu'elle pénètre dans les cellules des muscles et favorise la nécrose . La crotamine est homologue avec d'autres myotoxines de venin et est similaire aux α-,β- défensines .
Biochimie et mécanisme
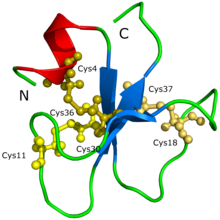
La séquence d' acides aminés ( YKQCHKKGGHCFPKEKICLPPSSDFGKMDCRWRWKCCKKGSG , Cys4-Cys36, Cys11-Cys30, Cys18-Cys37) et la structure moléculaire 3D de la crotamine ont déjà été déterminées.
La protéine structure crotamine n'a pas pu être d' abord déterminée par la cristallisation des protéines , ni la diffraction des rayons X . Il a été supposé que la difficulté était due au fait que la crotamine a tellement d'isoformes, conduisant à la formation d'agrégats et de différentes conformations possibles de la protéine. La structure et la forme de la protéine ont été proposées grâce à un modèle 3D généré par Siqueira et al. (2002) sur la base de calculs informatiques soutenus par des simulations de dynamique moléculaire intensives et des procédures de modélisation d'homologie. Par la suite, Nicastro et al. (2003) ont découvert la structure de la crotamine par spectroscopie de résonance magnétique nucléaire . La crotamine a une topologie qui n'a jamais été vue auparavant dans les toxines actives qui ciblent les canaux ioniques ; la protéine est composée d'une courte hélice alpha N-terminale , un type de formation protéique, et d'un petit feuillet bêta triple brin antiparallèle, un autre type de formation protéique, disposés dans une topologie ab1b2b3. La crotamine a des conformations de plis structurels similaires à celles de la famille des b-défensines humaines ainsi qu'un agencement de ponts disulfure identique .
[Chiffre nécessaire]
Le gène et l' emplacement chromosomique responsable de sa synthèse ont été identifiés par le groupe dirigé par Gandhi Rádis-Baptista , travaillant à l' Instituto Butantan , à São Paulo, au Brésil. L' ARNm a environ 340 nucléotides et codifie une pré-crotamine, comprenant le peptide signal , la crotamine mature et une lysine finale.
Le gène Crotamine a été le premier gène à être cartographié sur un chromosome de serpent. Le gène responsable du codage de la protéine crotamine est étiqueté Crt-p1 et sa longueur de séquence de paires de bases est d'environ 1,1 kpb ou 1 100 pb. Il a été rapporté que le gène de la crotamine a été isolé deux fois à partir de deux échantillons différents, l'un selon une méthode qui a donné une taille de gène de 1,8 kpb et dans l'autre échantillon une taille de gène de 1,1 kpb. Le gène a été précédemment isolé dans le génome de C. durissus terrificus et la protéine elle-même appartient à un groupe de petites myotoxines polypeptidiques basiques (SBPM). Le contenu des venins de Crotalus peut varier selon les sous-espèces et la situation géographique. Le gène Crt-p1, tel que décrit par Radis-Bastista et al. 2003, se compose d'environ trois exons séparés par un intron de phase 2 court (140 pb) et un intron de phase 1 long (900 pb). L'exon 1 code pour les 19 premiers acides aminés du peptide signal et comprend la région 5' non traduite. L'exon 2 code 39 acides aminés pour la crotamine mature et trois acides aminés du peptide signal. L'exon 3 code pour la lysine terminale et les trois derniers acides aminés de la toxine mature. La recherche sur les séquences d'acides aminés du SBPM parmi différentes espèces de Crotalus a révélé un degré élevé de similarité allant de 83 % à 98 %.
Le code d'acides aminés des protéines de la famille des myotoxines polypeptidiques basiques, qui comprend la crotamine, a été séquencé. Ils se sont avérés similaires avec une moyenne de 83 % de divergence. Une séquence d'acides aminés de crotamine a été comparée à celle de l' ADN cloné de la myotoxine a (la myotoxine utilisée pour modéliser le fonctionnement des SBPM). Dans la comparaison, les régions codant pour les exons comprenant la myotoxine mature et le peptide signal étaient respectivement similaires à 98 % et 100 %. Les régions non traduites pour 5' et 3' entre l'échantillon et l'ADNc de la myotoxine a étaient respectivement de 60 % et 80 %. Lorsque l'on compare les séquences d'acides aminés d'autres protéines ne faisant pas partie de la famille SBPM trouvées dans les venins de serpent, il existe généralement une grande divergence. Lorsque l'on examine les protéines SBPM, elles présentent une grande similitude entre différentes sous-espèces du genre Crotalus et entre différents individus de la même sous-espèce. Cela indique, selon Radis-Batista et al. 2003, que le gène de la crotamine et d'autres gènes SBPM ont évolué récemment.
Les références
Lectures complémentaires
- Gonçalves JM, Deutsch HF (février 1956). « Études d'électrophorèse ultracentrifuge et de zone de certains venins de crotalidae ». Archives de biochimie et biophysique . 60 (2) : 402–11. doi : 10.1016/0003-9861(56)90444-1 . PMID 13292919 .
- Giglio JR (novembre 1975). « Des études analytiques sur le chlorhydrate de crotamine ». Biochimie analytique . 69 (1) : 207-21. doi : 10.1016/0003-2697 (75) 90581-3 . PMID 2030 .
- Laure CJ (février 1975). "[La structure primaire de la crotamine (traduction de l'auteur)]". Zeitschrift für Physiologische Chemie de Hoppe-Seyler (en allemand). 356 (2) : 213-5. PMID 1176086 .
- De Lucca FL, Imaizumi MT, Haddad A (avril 1974). "Caractérisation des acides ribonucléiques des glandes à venin de Crotalus durissus terrifucus (Ophidia, Reptilia) après extraction manuelle du venin. Etudes sur l'activité des matrices et la composition des bases" . Le Journal Biochimique . 139 (1) : 151–6. doi : 10.1042/bj1390151 . PMC 1166261 . PMID 4463939 .
- Ownby CL, Cameron D, Tu AT (octobre 1976). "Isolement du composant myotoxique du venin de serpent à sonnettes (Crotalus viridis viridis). Analyse au microscope électronique des dommages musculaires" . Le Journal américain de pathologie . 85 (1) : 149-66. PMC 2032543 . PMID 970437 .
- Rádis-Baptista G, Oguiura N, Hayashi MA, Camargo ME, Grego KF, Oliveira EB, Yamane T (juillet 1999). « Séquence nucléotidique des précurseurs d'isoformes de crotamine d'un seul serpent à sonnettes d'Amérique du Sud (Crotalus durissus terrificus) ». Toxicon . 37 (7) : 973–84. doi : 10.1016/s0041-0101(98)00226-8 . PMID 10484745 .
- Kerkis A, Kerkis I, Rádis-Baptista G, Oliveira EB, Vianna-Morgante AM, Pereira LV, Yamane T (septembre 2004). « La crotamine est une nouvelle protéine pénétrant les cellules du venin du serpent à sonnettes Crotalus durissus terrificus ». Revue FASEB . 18 (12) : 1407–9. doi : 10.1096/fj.03-1459fje . PMID 15231729 . S2CID 20510076 .
- Rádis-Baptista G, Kubo T, Oguiura N, Prieto da Silva AR, Hayashi MA, Oliveira EB, Yamane T (juin 2004). « Identification de la crotasine, un gène lié à la crotamine de Crotalus durissus terrificus ». Toxicon . 43 (7) : 751–9. doi : 10.1016/j.toxicon.2004.02.023 . PMID 15284009 .
- Rádis-Baptista G, Kubo T, Oguiura N, Svartman M, Almeida TM, Batistic RF, et al. (décembre 2003). « Structure et localisation chromosomique du gène de la crotamine, une toxine du serpent à sonnettes d'Amérique du Sud, Crotalus durissus terrificus ». Toxicon . 42 (7) : 747-52. doi : 10.1016/j.toxicon.2003.10.019 . PMID 14757205 .
- Nicastro G, Franzoni L, de Chiara C, Mancin AC, Giglio JR, Spisni A (mai 2003). « Structure de la solution de la crotamine, un canal Na + affectant la toxine du venin de Crotalus durissus terrificus » . Journal Européen de Biochimie . 270 (9) : 1969-1979. doi : 10.1046/j.1432-1033.2003.03563.x . PMID 12709056 . S2CID 20601072 .
- Mouhat S, Jouirou B, Mosbah A, De Waard M, Sabatier JM (mars 2004). "Diversité des replis des toxines animales agissant sur les canaux ioniques" . Le Journal Biochimique . 378 (Pt 3) : 717–26. doi : 10.1042/BJ20031860 . PMC 1224033 . PMID 14674883 .
Liens externes
- Séquence nucléotidique et traduction de la crotasine . Entrez la base de données. Centre national d'information sur la biotechnologie.
