Composé cyclique - Cyclic compound
Un composé cyclique (ou composé cyclique ) est un terme désignant un composé dans le domaine de la chimie dans lequel une ou plusieurs séries d'atomes du composé sont connectées pour former un cycle . Les anneaux peuvent varier en taille de trois à plusieurs atomes, et comprennent des exemples où tous les atomes sont du carbone (c'est-à-dire des carbocycles ), aucun des atomes n'est du carbone (composés cycliques inorganiques), ou où des atomes de carbone et non de carbone sont présents ( composés hétérocycliques ). Selon la taille du cycle, l' ordre des liaisons des liaisons individuelles entre les atomes du cycle et leurs arrangements au sein des cycles, les composés carbocycliques et hétérocycliques peuvent être aromatiques ou non aromatiques ; dans ce dernier cas, ils peuvent varier d'une saturation totale à un nombre variable de liaisons multiples entre les atomes du cycle. En raison de l'énorme diversité permise, en combinaison, par les valences des atomes communs et leur capacité à former des cycles, le nombre de structures cycliques possibles, même de petite taille (par exemple, < 17 atomes au total) se compte par milliards.
- Exemples de composés cycliques : composés cycliques naturels entièrement carbonés (carbocycliques) et plus complexes .
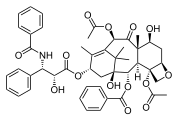
Ingénol , un produit naturel terpénoïde complexe, apparenté mais plus simple que le paclitaxel qui suit, qui présente une structure cyclique complexe comprenant des cycles carbocycliques non aromatiques à 3, 5 et 7 chaînons .
Cycloalcanes , les carbocycles les plus simples , y compris le cyclopropane , le cyclobutane , le cyclopentane et le cyclohexane . Notez qu'ailleurs, un raccourci de chimie organique est utilisé où les atomes d'hydrogène sont inférés comme présents pour remplir la valence du carbone de 4 (plutôt que de les montrer explicitement).
Le paclitaxel , un autre terpénoïde complexe d'origine végétale , également un produit naturel, présentant une structure multicyclique complexe comprenant des cycles à 4, 6 et 8 chaînons (carbocycliques et hétérocycliques , aromatiques et non aromatiques).
En plus de leur complexité et de leur nombre, la fermeture des atomes en cycles peut verrouiller des atomes particuliers avec une substitution distincte (par des groupes fonctionnels ) de telle sorte que la stéréochimie et la chiralité du composé en résultent, y compris certaines manifestations uniques aux cycles (par exemple, les isomères de configuration ). De plus, selon la taille de l'anneau, les formes tridimensionnelles de structures cycliques particulières - généralement des anneaux de cinq atomes et plus - peuvent varier et s'interconvertir de sorte qu'une isomérie conformationnelle est affichée. En effet, le développement de cet important concept chimique est né historiquement en référence aux composés cycliques. Enfin, les composés cycliques, en raison des formes, des réactivités, des propriétés et des bioactivités uniques qu'ils engendrent, constituent la majorité de toutes les molécules impliquées dans la biochimie, la structure et la fonction des organismes vivants et dans les molécules artificielles telles que les médicaments, pesticides, etc...
Introduction structurelle
Un composé cyclique ou un composé cyclique est un composé dans lequel au moins certains de ses atomes sont connectés pour former un cycle. Les anneaux varient en taille de trois à plusieurs dizaines voire centaines d'atomes. Des exemples de composés cycliques comprennent facilement les cas où :
- tous les atomes sont du carbone (c'est-à-dire des carbocycles ),
- aucun des atomes n'est du carbone (composés cycliques inorganiques), ou lorsque
- des atomes de carbone et non de carbone sont présents ( composés hétérocycliques ).
Les atomes communs peuvent (en raison de leurs valences ) former un nombre variable de liaisons, et de nombreux atomes communs forment facilement des anneaux. De plus, en fonction de la taille du cycle, de l' ordre des liaisons des liaisons individuelles entre les atomes du cycle et de leurs arrangements au sein des cycles, les composés cycliques peuvent être aromatiques ou non aromatiques ; dans le cas des composés cycliques non aromatiques, ils peuvent varier d'être entièrement saturés à avoir un nombre variable de liaisons multiples. En conséquence de la variabilité constitutionnelle qui est thermodynamiquement possible dans les structures cycliques, le nombre de structures cycliques possibles, même de petite taille (par exemple, <17 atomes) se compte par milliards.
De plus, la fermeture des atomes en cycles peut verrouiller un groupe fonctionnel particulier - atomes substitués en place, ce qui entraîne une stéréochimie et une chiralité associées au composé, y compris certaines manifestations uniques aux cycles (par exemple, les isomères configurationnels ) ; De plus, selon la taille des anneaux, les formes tridimensionnelles de structures cycliques particulières - généralement des anneaux de cinq atomes et plus - peuvent varier et s'interconvertir de sorte que l' isomérie conformationnelle est affichée.
Nomenclature
La nomenclature IUPAC a des règles étendues pour couvrir la dénomination des structures cycliques, à la fois en tant que structures de base et en tant que substituants ajoutés aux structures alicycliques . Le terme macrocycle est utilisé lorsqu'un composé contenant un cycle a un cycle de 12 atomes ou plus. Le terme polycyclique est utilisé lorsque plus d'un cycle apparaît dans une seule molécule. Le naphtalène est formellement un composé polycyclique, mais est plus spécifiquement nommé un composé bicyclique. Plusieurs exemples de structures macrocycliques et polycycliques sont donnés dans la galerie finale ci-dessous.
Les atomes qui font partie de la structure cyclique sont appelés atomes annulaires.
Carbocycles
La grande majorité des composés cycliques sont organiques , et parmi ceux-ci, une partie significative et conceptuellement importante est composée de cycles constitués uniquement d'atomes de carbone (c'est-à-dire de carbocycles).
Composés cycliques inorganiques
Les atomes inorganiques forment également des composés cycliques. Les exemples incluent le soufre , le silicium (par exemple, dans les silanes ), le phosphore (par exemple, dans les variantes de phosphanes et d' acide phosphorique ) et le bore (par exemple, dans l'acide triborique). Lorsque le carbone du benzène est "remplacé" par d'autres éléments, par exemple, comme dans le borabenzène , le silabenzène , le germanabenzène , le stannabenzène et la phosphorine , l'aromaticité est conservée et les composés cycliques inorganiques aromatiques sont donc connus et bien caractérisés.
Composés hétérocycliques
Les composés cycliques contenant à la fois des atomes de carbone et des atomes non carbonés sont appelés ( composés hétérocycliques ); alternativement, le nom peut se référer à des composés cycliques inorganiques, tels que les siloxanes et les borazines, qui ont plus d'un type d'atome dans leurs cycles. La nomenclature Hantzsch-Widman est recommandée par l'IUPAC pour nommer les hétérocycles, mais de nombreux noms communs restent d'usage courant.
Aromaticité
Les composés cycliques peuvent présenter ou non une aromaticité ; le benzène est un exemple de composé cyclique aromatique, tandis que le cyclohexane est non aromatique. En chimie organique, le terme aromaticité est utilisé pour décrire une molécule cyclique (en forme d'anneau), plane (plate) qui présente une stabilité inhabituelle par rapport à d'autres arrangements géométriques ou conjonctifs du même ensemble d'atomes. En raison de leur stabilité, il est très difficile de faire éclater les molécules aromatiques et de réagir avec d'autres substances. Les composés organiques qui ne sont pas aromatiques sont classés comme composés aliphatiques - ils peuvent être cycliques, mais seuls les cycles aromatiques ont une stabilité particulière (faible réactivité).
Étant donné que l'un des systèmes aromatiques de composés les plus couramment rencontrés en chimie organique est basé sur des dérivés du composé aromatique prototype benzène (un hydrocarbure aromatique commun dans le pétrole et ses distillats), le mot «aromatique» est parfois utilisé pour désigner de manière informelle les dérivés du benzène. , et c'est ainsi qu'il a été défini pour la première fois. Néanmoins, de nombreux composés aromatiques non benzéniques existent. Dans les organismes vivants, par exemple, les cycles aromatiques les plus courants sont les bases à double cycle dans l'ARN et l'ADN. Un groupe fonctionnel ou un autre substituant aromatique est appelé groupe aryle.
La première utilisation du terme «aromatique» était dans un article d'August Wilhelm Hofmann en 1855. Hofmann a utilisé le terme pour une classe de composés benzéniques, dont beaucoup ont des odeurs (arômes), contrairement aux hydrocarbures saturés purs. Aujourd'hui, il n'y a pas de relation générale entre l'aromaticité en tant que propriété chimique et les propriétés olfactives de ces composés (comment ils sentent), bien qu'en 1855, avant que la structure du benzène ou des composés organiques ne soit comprise, des chimistes comme Hofmann commençaient à comprendre que l'odeur les molécules des plantes, telles que les terpènes, avaient des propriétés chimiques que nous reconnaissons aujourd'hui sont similaires à celles des hydrocarbures pétroliers insaturés comme le benzène.
En termes de nature électronique de la molécule, l'aromaticité décrit un système conjugué souvent constitué d'une alternance de liaisons simples et doubles dans un cycle. Cette configuration permet aux électrons du système pi de la molécule d'être délocalisés autour de l'anneau, augmentant la stabilité de la molécule. La molécule ne peut pas être représentée par une structure, mais plutôt par un hybride de résonance de différentes structures, comme avec les deux structures de résonance du benzène. Ces molécules ne peuvent être trouvées dans aucune de ces représentations, avec les liaisons simples plus longues à un endroit et la double liaison plus courte à un autre (voir la théorie ci-dessous). Au contraire, la molécule présente des longueurs de liaison entre celles des liaisons simples et doubles. Ce modèle couramment observé de cycles aromatiques, à savoir l'idée que le benzène était formé d'un cycle carboné à six chaînons avec des liaisons simples et doubles alternées (cyclohexatriène), a été développé par August Kekulé (voir la section Historique ci-dessous). Le modèle du benzène se compose de deux formes de résonance, qui correspondent aux liaisons doubles et simples se superposant pour produire six liaisons une et demie. Le benzène est une molécule plus stable que ce à quoi on pourrait s'attendre sans tenir compte de la délocalisation de la charge.
Exemples simples et monocycliques
Voici des exemples de carbocycles simples et aromatiques, de composés cycliques inorganiques et d'hétérocycles :
- Composés monocycliques simples : exemples carbocycliques, inorganiques et hétérocycliques (aromatiques et non aromatiques).
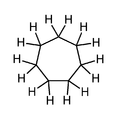
Cycloheptane , un simple composé carbocyclique à 7 chaînons, les hydrogènes de méthylène indiqués (non aromatiques).
Le benzène , un composé carbocyclique à 6 chaînons. hydrogènes de méthine montrés, et 6 électrons montrés comme délocalisés par le dessin d'un cercle (aromatique).
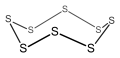
Cyclo - octasulfur , un composé cyclique inorganique à 8 chaînons (non aromatique).
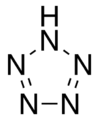
Pentazole , un composé cyclique inorganique à 5 chaînons (aromatique).
Pyridine , un composé hétérocyclique à 6 chaînons, des atomes d'hydrogène de méthine impliqués, non représentés, et des électrons π délocalisés représentés sous forme de liaisons discrètes (aromatiques).
Stéréochimie
La fermeture d'atomes en cycles peut verrouiller des atomes particuliers avec une substitution distincte par des groupes fonctionnels de sorte que le résultat est une stéréochimie et une chiralité du composé, y compris certaines manifestations uniques aux cycles (par exemple, des isomères de configuration ).
Isomérie conformationnelle
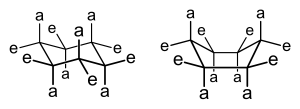
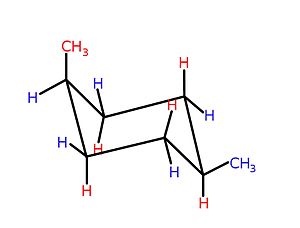
Selon la taille de l'anneau, les formes tridimensionnelles de structures cycliques particulières - généralement des anneaux de 5 atomes et plus - peuvent varier et s'interconvertir de sorte que l' isomérie conformationnelle est affichée. En effet, le développement de cet important concept chimique est né, historiquement, en référence aux composés cycliques. Par exemple, les cyclohexanes - des carbocycles à six chaînons sans doubles liaisons, auxquels divers substituants peuvent être attachés, voir l'image - présentent un équilibre entre deux conformations, la chaise et le bateau, comme le montre l'image.
La conformation chaise est la configuration privilégiée, parce que dans cette conformation, la souche stérique , souche éclipsant et contrainte d'angle qui sont par ailleurs possibles sont réduits au minimum. Laquelle des conformations de chaise possibles prédomine dans les cyclohexanes portant un ou plusieurs substituants dépend des substituants, et où ils sont situés sur le cycle ; généralement, les substituants "encombrants" - ces groupes avec de grands volumes , ou des groupes qui sont par ailleurs répulsifs dans leurs interactions - préfèrent occuper une position équatoriale. Un exemple d'interactions au sein d'une molécule qui conduirait à une contrainte stérique , conduisant à un changement d'équilibre du bateau à la chaise, est l'interaction entre les deux groupes méthyle dans le cis -1,4-diméthylcyclohexane. Dans cette molécule, les deux groupes méthyle sont dans des positions opposées du cycle (1,4-), et leur stéréochimie cis projette ces deux groupes vers le même côté du cycle. Par conséquent, s'ils sont forcés dans la forme de bateau à énergie plus élevée, ces groupes méthyle sont en contact stérique, se repoussent et conduisent l'équilibre vers la conformation de la chaise.
Macrocycles
Le terme macrocycle est utilisé pour les composés ayant un cycle de 8 atomes ou plus. Les macrocycles peuvent être entièrement carbocycliques, hétérocycliques mais ayant des hétéroatomes limités (par exemple, dans les lactones et les lactames ), ou être riches en hétéroatomes et présentant une symétrie significative (par exemple, dans le cas des macrocycles chélatants). Les macrocycles peuvent accéder à un certain nombre de conformations stables , de préférence dans des conformations qui minimisent les interactions transannulaires non liées au sein de l'anneau (par exemple, la chaise et la chaise-bateau étant plus stables que la conformation bateau-bateau pour le cyclooctane, en raison des interactions décrites par les arcs représentés). Les anneaux moyens (8-11 atomes) sont les plus tendus, avec une énergie de déformation comprise entre 9 et 13 (kcal/mol), et l'analyse des facteurs importants dans les conformations de macrocycles plus grands peut être modélisée en utilisant des conformations d'anneaux moyens. L'analyse conformationnelle des anneaux à membres impairs suggère qu'ils ont tendance à résider sous des formes moins symétriques avec des différences d'énergie plus petites entre les conformations stables.

Utilisations principales des structures cycliques
En raison des formes, des réactivités, des propriétés et des bioactivités uniques qu'ils engendrent, les composés cycliques constituent la plus grande majorité de toutes les molécules impliquées dans la biochimie, la structure et la fonction des organismes vivants et dans les molécules artificielles (par exemple, les médicaments, herbicides, etc.) à travers lesquels l'homme tente d'exercer un contrôle sur la nature et les systèmes biologiques.
Exemples complexes et polycycliques
Voici des exemples de composés cycliques présentant des systèmes cycliques et des caractéristiques stéréochimiques plus complexes :
- Composés cycliques complexes : exemples macrocycliques et polycycliques
Le naphtalène , techniquement un composé polycyclique, plus précisément un composé bicyclique, avec des cercles montrant la délocalisation des électrons (aromatiques).
Décaline (décahydronaphtalène), le dérivé entièrement saturé du naphtalène , montrant les deux stéréochimies possibles pour "fusionner" les deux cycles ensemble, et comment cela affecte les formes disponibles pour ce composé bicyclique (non aromatique).
Longifolène , un produit naturel terpénique , et un exemple de molécule tricyclique (non aromatique).
Paclitaxel , un produit naturel polycyclique avec un noyau tricyclique : avec un cycle D hétérocyclique à 4 chaînons, fusionné à d'autres cycles carbocycliques à 6 et 8 chaînons (A/C et B) (non aromatiques), et avec trois autres pendants des cycles phényle sur sa "queue", et attaché à C-2 (abréviation Ph, C 6 H 5 ; aromatiques).
Une forme tridimensionnelle représentative adoptée par le paclitaxel , en raison de sa structure cyclique unique.
Le cholestérol , un autre produit naturel terpénique, en particulier un stéroïde , une classe de molécules tétracycliques (non aromatiques).
Le benzo[a]pyrène , un composé pentacyclique à la fois naturel et artificiel, et les électrons π délocalisés représentés par des liaisons discrètes (aromatiques).
Pagodane , un composé polycyclique complexe, hautement symétrique, artificiel (non aromatique).
Brevetoxin A , un produit naturel à dix anneaux, tous fusionnés, et tous hétérocycliques , et un composant toxique associé aux organismes responsables des marées rouges . Le groupe R à droite fait référence à l'une des nombreuses chaînes latérales possibles à quatre carbones (voir l' article principal de Brevetoxin ; non aromatique).
Réactions synthétiques altérant les anneaux
Réactions générales importantes pour la formation d'anneaux
Il existe une variété de réactions spécialisées dont l'utilisation est uniquement la formation d'anneaux, et celles-ci seront discutées ci-dessous. En plus de celles-ci, il existe une grande variété de réactions organiques générales qui, historiquement, ont été cruciales dans le développement, premièrement, de la compréhension des concepts de chimie cyclique, et deuxièmement, de procédures fiables pour préparer des structures cycliques à haut rendement et avec des définitions orientation des substituants du cycle (c'est-à-dire stéréochimie définie ). Ces réactions générales comprennent :
- Condensation d'acyloine ;
- Oxydations anodiques ; et
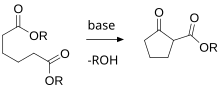
- la condensation de Dieckmann appliquée à la formation du cycle.
Réactions de fermeture de sonnerie
En chimie organique, une variété de produits synthétiques sont particulièrement utiles pour fermer les cycles carbocycliques et autres ; celles-ci sont appelées réactions de fermeture de cycle . Les exemples comprennent:
- trimérisation alcyne ;
- la cyclisation de Bergman ;
- les réactions de Diels-Alder et d'autres cycloadditions ;
- la réaction de cyclisation de Nazarov ;
- diverses cyclisations radicalaires ;
- des réactions de métathèse à fermeture de cycle , qui peuvent également être utilisées pour accomplir un type spécifique de polymérisation ;
- la synthèse à grands anneaux de Ruzicka ; et
- la synthèse Wenker des aziridines .
Réactions d'ouverture de cycle
Une variété d'autres procédures de synthèse sont particulièrement utiles pour ouvrir des cycles carbocycliques et autres, qui contiennent généralement une « poignée » à double liaison ou un autre groupe fonctionnel pour faciliter la chimie; celles-ci sont appelées réactions d'ouverture de cycle . Les exemples comprennent:
- la métathèse par ouverture de cycle , qui peut également être utilisée pour accomplir un type spécifique de polymérisation .
Réactions d'expansion et de contraction d'anneau
Les réactions d'expansion et de contraction du cycle sont courantes en synthèse organique et sont fréquemment rencontrées dans les réactions péricycliques . Les expansions et contractions de cycle peuvent impliquer l'insertion d'un groupe fonctionnel comme dans le cas de l' oxydation de Baeyer-Villiger des cétones cycliques, des réarrangements des carbocycles cycliques comme on le voit dans les réactions intramoléculaires de Diels-Alder , ou l'effondrement ou le réarrangement de composés bicycliques comme plusieurs exemples.
Voir également
Les références
- ^ Mars, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3e éd.), New York: Wiley, ISBN 0-471-85472-7
- ^ Halduc, I. (1961). "Classification des composés cycliques inorganiques". Journal de chimie structurale . 2 (3) : 350-8. doi : 10.1007/BF01141802 . S2CID 93804259 .
- ^ Reymond, Jean-Louis (2015). "Le projet de l'espace chimique" . Comptes de la recherche chimique . 48 (3) : 722–30. doi : 10.1021/ar500432k . PMID 25687211 .
- ^ A b c d e f g h William Reusch (2010). "Stéréoisomères Partie I" dans Manuel Virtuel de Chimie Organique. Université d'État du Michigan . Consulté le 7 avril 2015 .
- ^ un b Toujours, W.Clark; Galynker, Igor (1981). « Conséquences chimiques de la conformation dans les composés macrocycliques ». Tétraèdre . 37 (23) : 3981-96. doi : 10.1016/S0040-4020(01)93273-9 .
-
^ un b J.D. Dunitz (1968). JD Dunitz et JA Ibers (éd.). Perspectives en chimie structurale . Vol. 2. New York : Wiley. p. 1–70.
|volume=a du texte supplémentaire ( aide ) - ^ Morris, Christopher G.; Presse, Académique (1992). Dictionnaire de presse académique de la science et de la technologie . Éditions professionnelles du Golfe. p. 120. ISBN 9780122004001.
- ^ Eliel, EL, Wilen, SH et Mander, LS ( 1994 ) Stéréochimie des composés organiques, John Wiley and Sons, Inc., New York.
- ^ Anet, FAL; Saint-Jacques, M. ; Henrichs, PM ; Cheng, AK ; Krane, J.; Wong, L. (1974). « Analyse conformationnelle des cétones à anneau moyen ». Tétraèdre . 30 (12) : 1629-1637. doi : 10.1016/S0040-4020(01)90685-4 .
- ^ Löwe, J; Li, H; Downing, KH ; Nogales, E (2001). « Structure raffinée de la αβ-tubuline à une résolution de 3,5 Å » . Journal de biologie moléculaire . 313 (5) : 1045-1057. doi : 10.1006/jmbi.2001.5077 . PMID 11700061 .
Lectures complémentaires
- Jürgen-Hinrich Fuhrhop & Gustav Penzlin, 1986, "Organic lysis: concepts, methods, starting materials," Weinheim, BW, DEU:VCH, ISBN 0895732467 , voir [1] , consulté le 19 juin 2015.
- Michael B. Smith & Jerry March, 2007, "March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure," 6th Ed., New York, NY, USA: Wiley & Sons, ISBN 0470084944 , voir [2] , consulté le 19 juin 2015.
- Francis A. Carey & Richard J. Sundberg, 2006, "Title Advanced Organic Chemistry: Part A: Structure and Mechanisms," 4th Edn., New York, NY, USA: Springer Science & Business Media, ISBN 0306468565 , voir [3] , consulté le 19 juin 2015.
- Michael B. Smith, 2011, "Organic Chemistry: An Acid—Base Approach," Boca Raton, FL, USA:CRC Press, ISBN 1420079212 , voir [4] , consulté le 19 juin 2015. [Peut ne pas être le matériel le plus nécessaire pour cela article, mais un contenu important ici est disponible en ligne.]
- Jonathan Clayden, Nick Greeves & Stuart Warren, 2012, "Organic Chemistry," Oxford, Oxon, GBR:Oxford University Press, ISBN 0199270295 , voir [5] , consulté le 19 juin 2015.
- László Kürti & Barbara Czakó, 2005, « Applications stratégiques des réactions nommées dans la synthèse organique : arrière-plan et mécanismes détaillés, Amsterdam, NH, NLD : Elsevier Academic Press, 2005ISBN 0124297854, voir [6] , consulté le 19 juin 2015.
Liens externes
- Polycyclic+Compounds à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis
- Macrocycliques + composés à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis