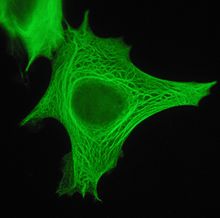
Cytokératine - Cytokeratin
Les cytokératines sont des protéines kératiniques présentes dans le cytosquelette intracytoplasmique du tissu épithélial . Ils sont un composant important des filaments intermédiaires , qui aident les cellules à résister aux contraintes mécaniques. L'expression de ces cytokératines dans les cellules épithéliales est largement spécifique à des organes ou tissus particuliers. Ainsi, ils sont utilisés en clinique pour identifier la cellule d'origine de diverses tumeurs humaines.
Appellation
Le terme « cytokératine » a commencé à être utilisé à la fin des années 1970, lorsque les sous - unités protéiques des filaments intermédiaires de la kératine à l' intérieur des cellules ont été identifiées et caractérisées pour la première fois. En 2006, une nouvelle nomenclature systématique des kératines de mammifères a été créée, et les protéines précédemment appelées « cytokératines » sont simplement appelées kératines (catégorie épithéliale humaine). Par exemple, la cytokératine-4 (CK-4) a été renommée kératine-4 (K4). Cependant, ils sont encore communément appelés cytokératines dans la pratique clinique.
Les types
Il existe deux catégories de cytokératines : les cytokératines acides de type I et les cytokératines basiques ou neutres de type II . Au sein de chaque catégorie, les cytokératines sont numérotées par ordre de taille décroissante, du haut poids moléculaire (HMWCK) au bas poids moléculaire (LMWCK). Les cytokératines se trouvent généralement dans des paires hétérodimères de sous-unités acides et basiques de taille similaire.
| CK de base (Type B / Classe II) |
CK acide (Type A / Classe I) |
|
|---|---|---|
| HMWCK " kératines squameuses " |
CK-1 CK-2 CK-3 CK-4 CK-5 CK-6 |
CK-9 CK-10 CK-11 CK-12 CK-13 CK-14 CK-15 CK-16 CK-17 |
| LMWCK " kératines simples " |
CK-7 CK-8 |
CK-18 CK-19 CK-20 |
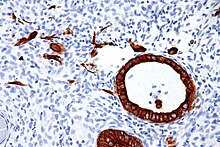
L'expression de ces cytokératines est largement spécifique d'un organe ou d'un tissu. Les sous-ensembles de cytokératines qu'exprime une cellule épithéliale dépendent principalement du type d'épithélium, du moment au cours de la différenciation terminale et du stade de développement. Ainsi, un profil d'expression spécifique des cytokératines permet l'identification des cellules épithéliales. En outre, cela s'applique également aux homologues malins de l'épithélium ( carcinomes ), car le profil des cytokératines est généralement conservé. Ainsi, l'étude de l'expression des cytokératines par des techniques d' immunohistochimie est un outil d'une immense valeur largement utilisé pour le diagnostic et la caractérisation des tumeurs en pathologie chirurgicale .
| Cytokératine | Des sites |
|---|---|
| Cytokératine 4 |
|
| Cytokératine 7 |
|
| Cytokératine 8 |
|
| Cytokératine 10 |
|
| Cytokératine 13 |
|
| Cytokératine 14 |
|
| Cytokératine 18 |
|
| Cytokératine 19 |
Ne réagit pas avec les hépatocytes et le carcinome hépatocellulaire |
| Cytokératine 20 |
|
Biologie moléculaire
Les cytokératines sont codées par une famille comprenant 30 gènes. Parmi eux, 20 sont des gènes épithéliaux et les 10 autres sont spécifiques des trichocytes.
Toutes les chaînes de cytokératines sont composées d'un domaine central riche en hélice (avec une identité de séquence de 50 à 90 % parmi les cytokératines du même type et environ 30 % entre les cytokératines de type différent) avec des N- et C non hélicoïdaux. domaines terminaux. Le domaine -hélicoïdal a 310-150 acides aminés et comprend quatre segments dans lesquels se répète un motif à sept résidus. Dans ce motif répété, les premier et quatrième résidus sont hydrophobes et les résidus chargés présentent une polarité positive et négative alternée, ce qui fait que les résidus polaires sont situés sur un côté de l'hélice. Ce domaine central de la chaîne assure l'alignement moléculaire dans la structure de la kératine et fait que les chaînes forment des dimères enroulés en solution.
Les séquences de domaine terminal des chaînes de cytokératine de type I et II contiennent des deux côtés du domaine en bâtonnets les sous-domaines V1 et V2, qui ont une taille et une séquence variables. Le type II présente également les sous-domaines conservés H1 et H2, comprenant respectivement 36 et 20 résidus. Les sous-domaines V1 et V2 contiennent des résidus enrichis en glycines et/ou en sérines, les premiers conférant à la chaîne cytokératinique un fort caractère insoluble et facilitant l'interaction avec d'autres molécules. Ces domaines terminaux sont également importants pour définir la fonction de la chaîne de cytokératine caractéristique d'un type de cellule épithéliale particulier.
Deux dimères de groupement cytokératine en un tétramère de kératine par liaison anti-parallèle. Ce tétramère de cytokératine est considéré comme le principal élément constitutif de la chaîne de cytokératine. Par la liaison tête-bêche des tétramères de cytokératine, les protofilaments sont créés, qui à leur tour s'entrelacent par paires pour former des protofibrilles. Quatre protofibrilles donnent lieu à un filament de cytokératine.
Biologie cellulaire
Dans le cytoplasme , les filaments de kératine s'associent latéralement les uns aux autres pour créer des faisceaux d'un rayon d'environ 50 nm. Le rayon de ces faisceaux est défini par l'interaction entre la répulsion électrostatique à longue portée et l'attraction hydrophobe à courte portée. Ces faisceaux de kératine s'étendent sur un réseau complexe qui s'étend de la surface du noyau à la membrane cellulaire. De nombreuses protéines accessoires sont impliquées dans la genèse et le maintien d'une telle structure.
Cette association entre la membrane plasmique et la surface nucléaire fournit des implications importantes pour l'organisation du cytoplasme et les mécanismes de communication cellulaire. Outre les fonctions relativement statiques fournies en termes de support du noyau et de résistance à la traction de la cellule, les réseaux de cytokératine subissent une dépolymérisation rapide par échanges de phosphate, avec des implications importantes dans les processus cellulaires plus dynamiques tels que la mitose et la période post-mitotique, la cellule mouvement et différenciation .
Les cytokératines interagissent avec les desmosomes et les hémidesmosomes, collaborant ainsi à l'adhésion cellule-cellule et à la connexion du tissu conjonctif sous-jacent aux cellules basales.
Les filaments intermédiaires du cytosquelette eucaryote , dont les cytokératines sont l'un de ses trois composants, ont été sondés pour s'associer également au réseau de protéines complexes d'ankyrine et de spectrine qui sous-tend la membrane cellulaire.
Les références
Liens externes
- Cytokératine à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis