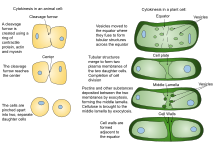
Cytokinèse - Cytokinesis
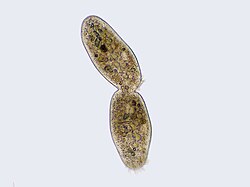
Cytokinèse ( / ˌ s aɪ t oʊ k ɪ n i s ɪ s / ) est la partie de la division cellulaire processus au cours duquel le cytoplasme d'une seule eucaryotes cellule se divise en deux cellules filles. La division cytoplasmique commence pendant ou après les derniers stades de la division nucléaire dans la mitose et la méiose . Au cours de la cytokinèse, l' appareil à fuseau divise et transporte les chromatides dupliquées dans le cytoplasme des cellules filles en séparation . Il garantit ainsi que le nombre et le complément chromosomiques sont maintenus d'une génération à l'autre et que, sauf cas particuliers, les cellules filles seront des copies fonctionnelles de la cellule mère. Après l'achèvement de la télophase et de la cytokinèse, chaque cellule fille entre dans l' interphase du cycle cellulaire .
Des fonctions particulières exigent diverses déviations du processus de cytokinèse symétrique; par exemple dans l' ovogenèse chez les animaux, l'ovule prend presque tout le cytoplasme et les organites . Cela laisse très peu pour les corps polaires résultants , qui dans la plupart des espèces meurent sans fonction, bien qu'ils assument diverses fonctions spéciales chez d'autres espèces. Une autre forme de mitose se produit dans des tissus tels que le foie et les muscles squelettiques ; il omet la cytokinèse, produisant ainsi des cellules multinucléées .
La cytokinèse végétale diffère de la cytokinèse animale, en partie à cause de la rigidité des parois cellulaires végétales. Au lieu que les cellules végétales forment un sillon de clivage comme celui qui se développe entre les cellules filles animales, une structure de division connue sous le nom de plaque cellulaire se forme dans le cytoplasme et se développe en une nouvelle paroi cellulaire doublée entre les cellules filles végétales. Il divise la cellule en deux cellules filles.
La cytokinèse ressemble en grande partie au processus procaryote de la fission binaire , mais en raison des différences entre les structures et les fonctions des cellules procaryotes et eucaryotes, les mécanismes diffèrent. Par exemple, une cellule bactérienne n'a qu'un seul chromosome sous la forme d'une boucle fermée, contrairement aux chromosomes linéaires, généralement multiples, des eucaryotes. En conséquence, les bactéries ne construisent pas de fuseau mitotique dans la division cellulaire. De plus, la duplication de l'ADN procaryote a lieu lors de la séparation réelle des chromosomes; dans la mitose, la duplication a lieu pendant l' interphase avant le début de la mitose, bien que les chromatides filles ne se séparent pas complètement avant l' anaphase .
Étymologie et prononciation
Le mot "cytokinesis" ( / ˌ s aɪ t oʊ k aɪ n Ï s ɪ s , - t ə -, - k ə - / ) utilisations combinant formes de cyto + kine- + -sis , Nouvelle latine du latin classique et le grec ancien , reflétant " cellule " et kinesis (" mouvement, mouvement "). Il a été inventé par Charles Otis Whitman en 1887.
L'origine de ce terme vient du grec κύτος ( kytos , un creux), du latin dérivé cyto (cellulaire), du grec κίνησις ( kínesis , mouvement).
Cellule animale
La cytokinèse des cellules animales commence peu de temps après le début de la séparation des chromatides sœurs lors de l' anaphase de la mitose . Le processus peut être divisé en les étapes distinctes suivantes : réorganisation du fuseau anaphasique, spécification du plan de division, assemblage et contraction de l'anneau actine-myosine et abscission. Le partitionnement fidèle du génome aux cellules filles émergentes est assuré par la coordination temporelle étroite des événements individuels ci-dessus par les voies de signalisation moléculaire.
Réorganisation du fuseau Anaphase
La cytokinèse des cellules animales commence par la stabilisation des microtubules et la réorganisation du fuseau mitotique pour former le fuseau central. Le fuseau central (ou zone médiane du fuseau ) se forme lorsque des fibres microtubulaires non kinétochores sont groupées entre les pôles du fuseau. Un certain nombre d'espèces différentes, dont H. sapiens , D. melanogaster et C. elegans, nécessitent le fuseau central pour subir efficacement une cytokinèse, bien que le phénotype spécifique associé à son absence varie d'une espèce à l'autre (par exemple, certaines cellules de Drosophila sont incapables de former un sillon de clivage sans le fuseau central, alors que dans les embryons de C. elegans et les cellules de culture de tissus humains , un sillon de clivage se forme et pénètre, puis régresse avant que la cytokinèse ne soit terminée). Le processus de réorganisation du fuseau mitotique et de formation du fuseau central est causé par le déclin de l'activité de CDK1 pendant l'anaphase. Le déclin de l'activité de CDK1 à la transition métaphase-anaphase conduit à la déphosphorylation des sites inhibiteurs sur plusieurs composants centraux du fuseau. Tout d'abord, l'élimination d'une phosphorylation de CDK1 d'une sous-unité du CPC (le complexe passager chromosomique) permet sa translocalisation vers le fuseau central depuis les centromères, où elle se situe au cours de la métaphase. En plus d'être un composant structurel du fuseau central lui-même, le CPC joue également un rôle dans la phosphorrégulation d'autres composants du fuseau central, notamment PRC1 (protéine de groupement des microtubules requise pour la cytokinèse 1) et MKLP1 (une protéine motrice de la kinésine). Initialement inhibée par la phosphorylation médiée par CDK1, PRC1 est maintenant capable de former un homodimère qui se lie sélectivement à l'interface entre les microtubules antiparallèles, facilitant l'organisation spatiale des microtubules du fuseau central. MKLP1, avec la protéine activant la GTPase de la famille Rho CYK-4 (également appelée MgcRacGAP), forme le complexe centralspindlin. Centralspindlin se lie au fuseau central en tant que clusters d'ordre supérieur. La formation du cluster centralspindlin est favorisée par la phosphorylation de MLKP1 par Aurora B, un composant de CPC. En bref, l'auto-assemblage du fuseau central est initié par la phosphorrégulation de plusieurs composants du fuseau central par le déclin de l'activité de CDK1, soit directement, soit indirectement, à la transition métaphase-anaphase. Le fuseau central peut avoir de multiples fonctions dans la cytokinèse, notamment le contrôle du positionnement du sillon de clivage, l'acheminement de vésicules membranaires au sillon de clivage et la formation de la structure médiane du corps requise pour les étapes finales de la division.
Spécification du plan de division
La deuxième étape de la cytokinèse des cellules animales implique la spécification du plan de division et la formation de sillons cytocinétiques. Le positionnement précis du plan de division entre les deux masses de chromosomes séparés est essentiel pour éviter la perte de chromosomes. Pendant ce temps, le mécanisme par lequel le fuseau détermine le plan de division dans les cellules animales est peut-être le mystère le plus durable de la cytokinèse et un sujet de débat intense. Il existe trois hypothèses d'induction de sillons. La première est l'hypothèse de la stimulation astrale, qui postule que les microtubules astraux des pôles du fuseau portent un signal induisant un sillon vers le cortex cellulaire, où les signaux des deux pôles sont en quelque sorte focalisés dans un anneau au niveau du fuseau. Une deuxième possibilité, appelée hypothèse du fuseau central, est que le sillon de clivage est induit par un stimulus positif qui provient de l'équateur du fuseau central. Le fuseau central peut contribuer à la spécification du plan de division en favorisant la concentration et l'activation de la petite GTPase RhoA au niveau du cortex équatorial. Une troisième hypothèse est l'hypothèse de la relaxation astrale. Il postule que les faisceaux actifs d'actine-myosine sont distribués dans tout le cortex cellulaire et que l'inhibition de leur contraction près des pôles du fuseau entraîne un gradient d'activité contractile qui est le plus élevé au point médian entre les pôles. En d'autres termes, les microtubules astraux génèrent un signal négatif qui augmente la relaxation corticale à proximité des pôles. Des études génétiques et de micromanipulation laser sur des embryons de C. elegans ont montré que le fuseau envoie deux signaux redondants au cortex cellulaire, l'un provenant du fuseau central et un second signal provenant du fuseau aster, suggérant l'implication de plusieurs mécanismes combinés dans le positionnement du sillon de clivage. La prédominance d'un signal particulier varie selon les types cellulaires et les organismes. Et la multitude et la redondance partielle des signaux peuvent être nécessaires pour rendre le système robuste et augmenter la précision spatiale.
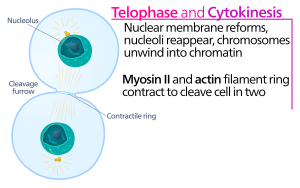
Assemblage et contraction de l'anneau actine-myosine
Au niveau du sillon de cytokinèse, c'est l' anneau contractile actine-myosine qui entraîne le processus de clivage, au cours duquel la membrane cellulaire et la paroi se développent vers l'intérieur, ce qui finit par pincer la cellule mère en deux. Les composants clés de cet anneau sont la protéine filamenteuse actine et la protéine motrice myosine II. L'anneau contractile s'assemble de manière équatoriale (au milieu de la cellule) au cortex cellulaire (adjacent à la membrane cellulaire). La famille des protéines Rho (protéine RhoA dans les cellules de mammifères) est un régulateur clé de la formation et de la contraction des anneaux contractiles dans les cellules animales. La voie RhoA favorise l'assemblage de l'anneau actine-myosine par deux effecteurs principaux. Tout d'abord, RhoA stimule la nucléation de filaments d'actine non ramifiés par l'activation de formines liées à Diaphanous. Cette génération locale de nouveaux filaments d'actine est importante pour la formation du cycle contractile. Ce processus de formation de filament d'actine nécessite également une protéine appelée profiline, qui se lie aux monomères d'actine et aide à les charger sur l'extrémité du filament. Deuxièmement, RhoA favorise l'activation de la myosine II par la kinase ROCK, qui active la myosine II directement par phosphorylation de la chaîne légère de la myosine et inhibe également la myosine phosphatase par phosphorylation de la sous-unité MYPT ciblant la phosphatase. Outre l'actine et la myosine II, l'anneau contractile contient la protéine d'échafaudage anilline. L'anilline se lie à l'actine, à la myosine, à RhoA et à CYK-4, et relie ainsi le cortex équatorial aux signaux du fuseau central. Il contribue également à la liaison de l'anneau actine-myosine à la membrane plasmique. De plus, l'anilline génère des forces contractiles en rectifiant les fluctuations thermiques. Une autre protéine, la septine, a également été supposée servir d'échafaudage structurel sur lequel l'appareil de cytokinèse est organisé. Après son assemblage, la contraction de l'anneau actine-myosine conduit à l'entrée de la membrane plasmique attachée, qui divise le cytoplasme en deux domaines de cellules sœurs émergentes. La force pour les processus contractiles est générée par les mouvements le long de l'actine par la protéine motrice myosine II. La myosine II utilise l'énergie libre libérée lors de l' hydrolyse de l' ATP pour se déplacer le long de ces filaments d'actine, resserrant la membrane cellulaire pour former un sillon de clivage . L' hydrolyse continue fait pénétrer ce sillon de clivage (se déplace vers l'intérieur), un processus frappant qui est clairement visible à travers un microscope optique .
Abscission
Le sillon cytocinétique pénètre jusqu'à ce qu'une structure médiane du corps (composée de matière protéique dense aux électrons) se forme, où l'anneau actine-myosine a atteint un diamètre d'environ 1 à 2 m. La plupart des types de cellules animales restent connectés par un pont cytocinétique intercellulaire jusqu'à plusieurs heures jusqu'à ce qu'ils soient divisés par un processus indépendant de l'actine appelé abscission, la dernière étape de la cytokinèse. Le processus d' abscission coupe physiquement le milieu du corps en deux. L'abscission procède par l'élimination des structures cytosquelettiques du pont cytocinétique, la constriction du cortex cellulaire et la fission de la membrane plasmique. Le pont intercellulaire est rempli de faisceaux denses de microtubules antiparallèles qui dérivent du fuseau central. Ces microtubules se chevauchent au milieu du corps, ce qui est généralement considéré comme une plate-forme de ciblage pour la machinerie d'abscission. La spastine, protéine de coupure des microtubules, est en grande partie responsable du désassemblage des faisceaux de microtubules à l'intérieur du pont intercellulaire. Une constriction corticale complète nécessite également l'élimination des structures cytosquelettiques sous-jacentes. Le désassemblage du filament d'actine au cours de la cytokinèse tardive dépend du complexe PKCε-14-3-3, qui inactive RhoA après l'entrée du sillon. Le désassemblage de l'actine est en outre contrôlé par la GTPase Rab35 et son effecteur, la phosphatidylinositol-4,5-bisphosphate 5-phosphatase OCRL. Comprendre le mécanisme par lequel la membrane plasmique se divise finalement nécessite une enquête plus approfondie.
Timing cytokinèse
La cytokinèse doit être contrôlée dans le temps pour s'assurer qu'elle se produit uniquement après la séparation des chromatides sœurs pendant la partie anaphase des divisions cellulaires prolifératives normales. Pour y parvenir, de nombreux composants de la machinerie de la cytokinèse sont hautement régulés pour garantir qu'ils sont capables de remplir une fonction particulière à un stade particulier du cycle cellulaire . La cytokinèse ne se produit qu'après la liaison de l'APC avec le CDC20. Cela permet à la séparation des chromosomes et de la myosine de fonctionner simultanément.
Après la cytokinèse, les microtubules non kinétochores se réorganisent et disparaissent dans un nouveau cytosquelette lorsque le cycle cellulaire revient à l' interphase (voir aussi cycle cellulaire ).
Cellule de plante
En raison de la présence d'une paroi cellulaire , la cytokinèse dans les cellules végétales est significativement différente de celle des cellules animales. Plutôt que de former un anneau contractile, les cellules végétales construisent une plaque cellulaire au milieu de la cellule. Les étapes de la formation de la plaque cellulaire comprennent (1) la création du phragmoplaste , un réseau de microtubules qui guide et soutient la formation de la plaque cellulaire ; (2) le trafic des vésicules vers le plan de division et leur fusion pour générer un réseau tubulaire-vésiculaire ; (3) la fusion continue des tubules membranaires et leur transformation en feuillets membranaires lors du dépôt de callose , suivie du dépôt de cellulose et d'autres composants de la paroi cellulaire ; (4) recyclage de l'excès de membrane et d'autres matériaux de la plaque cellulaire ; et (5) fusion avec la paroi cellulaire parentale
Le phragmoplaste est assemblé à partir des restes du fuseau mitotique et sert de piste pour le trafic des vésicules vers la zone médiane du phragmoplaste. Ces vésicules contiennent des lipides, des protéines et des glucides nécessaires à la formation d'une nouvelle frontière cellulaire. Des études de tomographie électronique ont identifié l'appareil de Golgi comme la source de ces vésicules, mais d'autres études ont suggéré qu'elles contiennent également du matériel endocytosé.
Ces tubules s'élargissent ensuite et fusionnent latéralement les uns avec les autres, formant finalement une feuille plane et fenêtrée [8] . Comme les plaques de cellules matures, de grandes quantités de matériau de membrane sont éliminés par l' intermédiaire de clathrine endocytose [7] Par la suite, les bords de la mèche de plaque de cellule avec la parental membrane plasmatique , souvent de façon asymétrique, complétant ainsi la cytokinèse. Les fenêtres restantes contiennent des brins de réticulum endoplasmique qui les traversent et sont considérées comme les précurseurs des plasmodesmes [8] .
La construction de la nouvelle paroi cellulaire commence dans la lumière des tubules étroits de la jeune plaque cellulaire . L'ordre dans lequel les différents composants de la paroi cellulaire sont déposés a été déterminé en grande partie par microscopie immuno-électronique. Les premiers composants à arriver sont les pectines , les hémicelluloses et les protéines arabinogalactanes portées par les vésicules de sécrétion qui fusionnent pour former la plaque cellulaire. Le prochain composant à ajouter est la callose , qui est polymérisée directement sur la plaque cellulaire par les calloses synthases. Au fur et à mesure que la plaque cellulaire continue de mûrir et fusionne avec la membrane plasmique parentale, la callose est lentement remplacée par de la cellulose , le composant principal d'une paroi cellulaire mature [6] . La lamelle médiane (une couche semblable à de la colle contenant de la pectine) se développe à partir de la plaque cellulaire, servant à lier les parois cellulaires des cellules adjacentes.
Les forces
Cellules animales
L'entrée du sillon cytocinétique est alimentée par la myosine ATPase de type II . Étant donné que les myosines sont recrutées dans la région médiale, les forces contractiles agissant sur le cortex ressemblent à une constriction « fil de bourse » tirant vers l'intérieur. Cela conduit à la constriction vers l'intérieur. La membrane plasmique de par son association étroite avec le cortex via des protéines de réticulation A la constriction du sillon de clivage, la surface totale doit être augmentée en alimentant la membrane plasmique par exocytose </ref>.
Voir également
Les références
Lectures complémentaires
- Les exigences moléculaires pour la cytokinèse par M. Glotzer (2005), Science 307, 1735
- "Animal Cytokinesis: from parts list to Mechanism" par Eggert, US, Mitchison, TJ, Field, CM (2006), Annual Review of Cell Biology 75, 543-66
- Campbell Biologie (2010), 580-582
- Plus de descriptions et de belles images de la division cellulaire chez les plantes, en mettant l'accent sur la microscopie à fluorescence
- Nanninga N (juin 2001). « Cytokinèse chez les procaryotes et les eucaryotes : principes communs et différentes solutions » . Microbiole. Mol. Biol. Rév . 65 (2) : 319-33. doi : 10.1128/MMBR.65.2.319-333.2001 . PMC 99029 . PMID 11381104 .