Tétrafluorure de dibore - Diboron tetrafluoride
|
|
|||
| Des noms | |||
|---|---|---|---|
|
Nom IUPAC préféré
Tétrafluorure de dibore |
|||
|
Nom IUPAC systématique
Tétrafluorodiborane |
|||
| Identifiants | |||
|
Modèle 3D ( JSmol )
|
|||
| ChemSpider | |||
|
PubChem CID
|
|||
|
Tableau de bord CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriétés | |||
| B 2 F 4 | |||
| Masse molaire | 97,616 g / mol | ||
| Apparence | Gaz incolore | ||
| Densité | 4,3 kg / m 3 (gaz) | ||
| Point de fusion | -56 ° C (-69 ° F; 217 K) | ||
| Point d'ébullition | -34 ° C (-29 ° F; 239 K) | ||
| Thermochimie | |||
|
Capacité thermique ( C )
|
79,1 J / mol K | ||
|
Entropie molaire std ( S |
317,3 J / mol K | ||
| -1440,1 kJ / mol | |||
|
Énergie libre de Gibbs (Δ f G ˚)
|
-1410,4 kJ / mol | ||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|||
| Références Infobox | |||
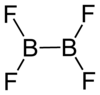
Le tétrafluorure de dibore est le composé inorganique de formule (BF 2 ) 2 . Gaz incolore, le composé a une demi-vie de jours à température ambiante. C'est le plus stable des tétrahalogénures de dibore.
Structure et collage
Le tétrafluorure de dibore est une molécule plane avec une distance de liaison BB de 172 pm. Bien qu'il soit déficient en électrons, les centres de bore insaturés sont stabilisés par liaison pi avec les ligands fluorure terminaux. Le composé est isoélectronique avec l' oxalate .
Synthèse et réactions
Le tétrafluorure de dibore peut être formé en traitant le monofluorure de bore avec du trifluorure de bore à basses températures, en prenant soin de ne pas former de polymères supérieurs. Le tétrafluorure de dibore se forme à partir de la réaction du monofluorure de bore avec du trifluorure de bore à basse température, en prenant soin de ne pas former de polymères supérieurs.
L'ajout de tétrafluorure de dibore au complexe de Vaska a été utilisé pour produire un exemple précoce d'un complexe de boryle de métal de transition :
- 2 B 2 F 4 + IrCl (CO) (PPh 3 ) 2 → Ir (BF 2 ) 3 (CO) (PPh 3 ) 2 + ClBF 2
Littérature historique
- Louis Trefonas et William N. Lipscomb (1958). "Cristal et structure moléculaire du tétrafluorure de dibore, B 2 F 4 ". J. Chem. Phys . 28 (1): 54–55. doi : 10.1063 / 1.1744079 .
- Gayles, JN; Self, J. (1964). "Spectre infrarouge de tétrafluorure de dibore dans les états gazeux et solides". Journal de physique chimique . 40 (12): 3530–3539. doi : 10.1063 / 1.1725048 .
- Arthur Finch et Hermann Irving Schlesinger (1958). "Diboron Tetrafluoride". Confiture. Chem. Soc . 80 (14): 3573–3574. doi : 10.1021 / ja01547a020 .
- AK Holliday; FB Taylor (1964). "Tétrafluorure de dibore. Partie II. Réactions avec certains oxydes et composés organométalliques". J. Chem. Soc. : 2731-2734. doi : 10.1039 / JR9640002731 .
- Vernon H. Dibeler; Susan K. Liston (1968). "Etude par spectrométrie de masse de photoionisation. XII. Trifluorure de bore et tétrafluorure de dibore". J. Chem. Soc . 7 (9): 1742–1746. doi : 10.1021 / ic50067a010 .
Références
- ^ un b Greenwood, Norman N .; Earnshaw, Alan (1997). Chimie des éléments (2e éd.). Butterworth-Heinemann . ISBN 978-0-08-037941-8 .
- ^ un b P. L. Timms (1972). Condensation à basse température . Progrès en chimie inorganique et radiochimie . p. 143. ISBN 0-12-023614-1 .
- ^ Neeve, Emily C .; Geier, Stephen J .; Mkhalid, Ibraheem AI; Westcott, Stephen A .; Marder, Todd B. (2016). "Composés de Diboron (4): De la curiosité structurelle à la bête de somme synthétique" . Examens chimiques . 116 (16): 9091–9161. doi : 10.1021 / acs.chemrev.6b00193 . PMID 27434758 .
Liens externes