Découverte du neutron - Discovery of the neutron

La découverte du neutron et de ses propriétés a été au cœur des développements extraordinaires de la physique atomique dans la première moitié du 20e siècle. Au début du siècle, Ernest Rutherford a développé un modèle grossier de l'atome, basé sur l' expérience de la feuille d'or de Hans Geiger et Ernest Marsden . Dans ce modèle, les atomes avaient leur masse et leur charge électrique positive concentrées dans un très petit noyau . En 1920, des isotopes chimiques avaient été découverts, les masses atomiques avaient été déterminées comme étant (approximativement) des multiples entiers de la masse de l' atome d'hydrogène , et le numéro atomique avait été identifié comme la charge sur le noyau. Tout au long des années 1920, le noyau était considéré comme composé de combinaisons de protons et d' électrons , les deux particules élémentaires connues à l'époque, mais ce modèle présentait plusieurs contradictions expérimentales et théoriques.
La nature essentielle du noyau atomique a été établie avec la découverte du neutron par James Chadwick en 1932 et la détermination qu'il s'agissait d'une nouvelle particule élémentaire, distincte du proton.
Le neutron non chargé fut immédiatement exploité comme nouveau moyen de sonder la structure nucléaire, conduisant à des découvertes telles que la création de nouveaux éléments radioactifs par irradiation neutronique (1934) et la fission d' atomes d' uranium par des neutrons (1938). La découverte de la fission a conduit à la création à la fois de l'énergie nucléaire et des armes nucléaires à la fin de la Seconde Guerre mondiale. Tant le proton que le neutron étaient présumés être des particules élémentaires jusqu'aux années 1960, lorsqu'il a été déterminé qu'il s'agissait de particules composites construites à partir de quarks .
Découverte de la radioactivité
Au début du XXe siècle, le vif débat sur l'existence des atomes n'était pas encore résolu. Des philosophes comme Ernst Mach et Wilhelm Ostwald ont nié que les atomes soient réels, les considérant comme une construction mathématique pratique, tandis que des scientifiques comme Arnold Sommerfeld et Ludwig Boltzmann ont vu que les théories physiques nécessitaient l'existence d'atomes.
La radioactivité a été découverte en 1896 par le scientifique français Henri Becquerel , alors qu'il travaillait avec des matériaux phosphorescents . En 1898, Ernest Rutherford du Cavendish Laboratory a distingué deux types de radioactivité, les rayons alpha et les rayons bêta , qui différaient par leur capacité à pénétrer ou à pénétrer dans des objets ou des gaz ordinaires. Deux ans plus tard, Paul Villard découvrit les rayons gamma , qui possédaient un pouvoir de pénétration encore plus grand. Ces radiations furent bientôt identifiées avec des particules connues : les rayons bêta furent montrés comme des électrons par Walter Kaufmann en 1902 ; les rayons alpha se sont avérés être des ions hélium par Rutherford et Thomas Royds en 1907 ; et les rayons gamma se sont révélés être des rayonnements électromagnétiques, c'est-à-dire une forme de lumière , par Rutherford et Edward Andrade en 1914. Ces rayonnements avaient également été identifiés comme émanant des atomes, ils ont donc fourni des indices sur les processus se produisant dans les atomes. Inversement, les rayonnements ont également été reconnus comme des outils pouvant être exploités dans des expériences de diffusion pour sonder l'intérieur des atomes.
L'expérience de la feuille d'or et la découverte du noyau atomique
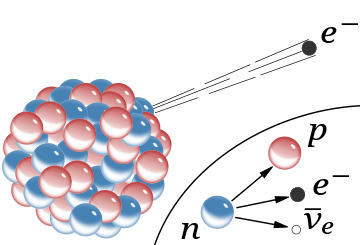
??−
rayonnement, l'émission d'un électron rapide du noyau (l'antineutrino qui l'accompagne est omis). Dans le modèle de Rutherford pour le noyau, les sphères rouges étaient des protons avec une charge positive et les sphères bleues étaient des protons étroitement liés à un électron sans charge nette.
L' encart montre la désintégration bêta d'un neutron libre tel qu'il est compris aujourd'hui ; un électron et un antineutrino sont créés dans ce processus.
À l' Université de Manchester entre 1908 et 1913, Rutherford a dirigé Hans Geiger et Ernest Marsden dans une série d'expériences pour déterminer ce qui se passe lorsque des particules alpha se dispersent à partir d'une feuille de métal. Aujourd'hui appelée expérience sur la feuille d'or de Rutherford , ou expérience Geiger-Marsden, ces mesures ont fait la découverte extraordinaire que les particules alpha se disperseraient parfois à un angle élevé lorsqu'elles traversaient une fine feuille d'or. La diffusion indiquait que les particules alpha étaient déviées par un petit, mais dense, composant d'atomes. Sur la base de ces mesures, en 1911, il était évident pour Rutherford que l'atome était constitué d'un petit noyau massif avec une charge positive entouré d'un nuage beaucoup plus grand d' électrons chargés négativement . La masse atomique concentrée était nécessaire pour fournir la déviation observée des particules alpha, et Rutherford a développé un modèle mathématique qui a pris en compte la diffusion.
Le modèle de Rutherford a été très influent, motivant le modèle de Bohr pour les électrons en orbite autour du noyau en 1913 et menant finalement à la mécanique quantique au milieu des années 1920.
Découverte des isotopes
Parallèlement aux travaux de Rutherford, Geiger et Marsden, le radiochimiste Frederick Soddy de l' Université de Glasgow étudiait les problèmes liés à la chimie sur les matières radioactives. Soddy avait travaillé avec Rutherford sur la radioactivité à l'Université McGill . En 1910, environ 40 éléments radioactifs différents, appelés radioéléments , avaient été identifiés entre l'uranium et le plomb, bien que le tableau périodique ne permette que 11 éléments. Soddy et Kazimierz Fajans ont découvert indépendamment en 1913 qu'un élément subissant une désintégration alpha produira un élément deux places vers la gauche dans le système périodique et un élément subissant une désintégration bêta produira un élément une place vers la droite dans le système périodique. De plus, les radioéléments qui résident aux mêmes endroits dans le système périodique sont chimiquement identiques. Soddy a appelé ces éléments chimiquement identiques des isotopes . Pour son étude de la radioactivité et la découverte des isotopes, Soddy a reçu le prix Nobel de chimie en 1921.
S'appuyant sur les travaux de JJ Thomson sur la déviation d'atomes chargés positivement par des champs électriques et magnétiques, Francis Aston a construit le premier spectrographe de masse au Laboratoire Cavendish en 1919. Son objectif, qu'il a facilement atteint, était de séparer les deux isotopes du néon ,20
Ne
et 22
Ne
. Aston a découvert que les masses de toutes les particules sont des nombres entiers (la règle des nombres entiers ): c'est-à-dire que les masses de tous les isotopes sont des multiples entiers de la masse de l' atome d' hydrogène. Dans ces mesures, Aston a arbitrairement calculé ses masses par rapport à l' oxygène-16 , qu'il a considéré comme ayant une masse d'exactement 16. (Aujourd'hui, l' unité de masse atomique (amu) est relative au carbone-12 .) Ironiquement, la seule exception à cette règle règle était l'hydrogène lui-même, qui avait une valeur de masse de 1,008. L'excès de masse était faible, mais bien en dehors des limites de l'incertitude expérimentale. Aston et d'autres ont rapidement réalisé que l'écart est dû à l'énergie de liaison des atomes, c'est-à-dire que la masse d'un certain nombre d'atomes d'hydrogène liés en un seul atome doit être inférieure à la somme des masses des atomes d'hydrogène séparés. Les travaux d'Aston sur les isotopes lui ont valu le prix Nobel de chimie en 1922 pour la découverte d'isotopes dans un grand nombre d'éléments non radioactifs et pour son énoncé de la règle des nombres entiers. Notant la récente découverte par Aston de l'énergie de liaison nucléaire, en 1920, Arthur Eddington suggéra que les étoiles pourraient obtenir leur énergie en fusionnant de l'hydrogène (protons) en hélium et que les éléments les plus lourds pourraient se former dans les étoiles.
Numéro atomique et loi de Moseley
Rutherford et d'autres avaient noté la disparité entre la masse d'un atome, calculée en unités de masse atomique, et la charge approximative requise sur le noyau pour que le modèle de Rutherford fonctionne. La charge requise du noyau atomique était généralement d'environ la moitié de sa masse atomique. Antonius van den Broek a hardiment émis l'hypothèse que la charge requise, notée Z , n'était pas la moitié du poids atomique des éléments, mais était exactement égale à la position ordinale de l'élément dans le tableau périodique . A cette époque, les positions des éléments dans le tableau périodique n'étaient pas connues pour avoir une signification physique. Si les éléments étaient ordonnés en fonction de l'augmentation de la masse atomique, cependant, la périodicité des propriétés chimiques était présentée. Des exceptions à cette périodicité étaient cependant apparentes, comme le cobalt et le nickel.
À l' Université de Manchester en 1913, Henry Moseley a discuté du nouveau modèle de Bohr de l'atome avec le visiteur Bohr. Le modèle tenait compte du spectre d'émission électromagnétique de l'atome d'hydrogène, et Moseley et Bohr se sont demandé si les spectres d'émission électromagnétique d'éléments plus lourds tels que le cobalt et le nickel suivraient leur ordre en poids ou leur position dans le tableau périodique. En 1913-1914, Moseley a testé la question expérimentalement en utilisant des techniques de diffraction des rayons X. Il a découvert que la raie à courte longueur d'onde la plus intense dans le spectre des rayons X d'un élément particulier, connue sous le nom de raie K-alpha , était liée à la position de l'élément dans le tableau périodique, c'est-à-dire son numéro atomique, Z . En effet, Moseley a introduit cette nomenclature. Moseley a constaté que les fréquences du rayonnement étaient liées d'une manière simple au numéro atomique des éléments pour un grand nombre d'éléments.
En un an, il a été noté que l'équation de la relation, maintenant appelée loi de Moseley , pouvait être expliquée en fonction du modèle de Bohr de 1913, avec des hypothèses supplémentaires raisonnables sur la structure atomique dans d'autres éléments. Le résultat de Moseley, selon le compte rendu ultérieur de Bohr, a non seulement établi le nombre atomique en tant que quantité expérimentale mesurable, mais lui a donné une signification physique en tant que charge positive sur le noyau atomique. Les éléments pourraient être classés dans le système périodique par ordre de numéro atomique plutôt que par poids atomique. Le résultat a lié l'organisation du tableau périodique, le modèle de Bohr pour l'atome et le modèle de Rutherford pour la diffusion alpha des noyaux. Il a été cité par Rutherford, Bohr et d'autres comme une avancée critique dans la compréhension de la nature du noyau atomique.
D'autres recherches en physique atomique ont été interrompues par le déclenchement de la Première Guerre mondiale . Moseley a été tué en 1915 à la bataille de Gallipoli , tandis que l'étudiant de Rutherford James Chadwick a été interné en Allemagne pour la durée de la guerre, 1914-1918. A Berlin, les travaux de recherche de Lise Meitner et Otto Hahn sur la détermination des chaînes de désintégration radioactive du radium et de l'uranium par séparation chimique précise ont été interrompus. Meitner a passé une grande partie de la guerre de travail en tant que radiologue et médicale à rayons X technicien près du front autrichien, tandis que Hahn, un chimiste , a travaillé sur la recherche dans la guerre des gaz toxiques .
Atome de Rutherford
En 1920, Rutherford donna une conférence Baker à la Royal Society intitulée "La constitution nucléaire des atomes", un résumé des expériences récentes sur les noyaux atomiques et des conclusions quant à la structure des noyaux atomiques. En 1920, l'existence d'électrons dans le noyau atomique était largement admise. On supposait que le noyau était constitué de noyaux d'hydrogène en nombre égal à la masse atomique. Mais puisque chaque noyau d'hydrogène avait une charge +1, le noyau nécessitait un plus petit nombre d'"électrons internes" chacun de charge -1 pour donner au noyau sa charge totale correcte. La masse des protons est environ 1800 fois supérieure à celle des électrons, donc la masse des électrons est accessoire dans ce calcul. Un tel modèle était cohérent avec la diffusion des particules alpha des noyaux lourds, ainsi qu'avec la charge et la masse des nombreux isotopes qui avaient été identifiés. Il y avait d'autres motivations pour le modèle proton-électron. Comme l'a noté Rutherford à l'époque, "Nous avons de bonnes raisons de croire que les noyaux des atomes contiennent des électrons ainsi que des corps chargés positivement...", à savoir, on savait que le rayonnement bêta était des électrons émis par le noyau.
Dans cette conférence, Rutherford a conjecturé l'existence de nouvelles particules. La particule alpha était connue pour être très stable et on supposait qu'elle conservait son identité à l'intérieur du noyau. La particule alpha était supposée se composer de quatre protons et de deux électrons étroitement liés pour lui donner une charge +2 et une masse 4. Dans un article de 1919, Rutherford avait signalé la découverte apparente d'une nouvelle particule doublement chargée de masse 3, notée le X++, interprété comme composé de trois protons et d'un électron étroitement lié. Ce résultat suggéra à Rutherford l'existence probable de deux nouvelles particules : l'une de deux protons avec un électron étroitement lié, et une autre d'un proton et d'un électron étroitement lié. Il a été déterminé plus tard que la particule X++ avait une masse 4 et n'était qu'une particule alpha de faible énergie. Néanmoins, Rutherford avait conjecturé l'existence du deutéron, une particule de charge +1 de masse 2, et du neutron, une particule neutre de masse 1. Le premier est le noyau de deutérium , découvert en 1931 par Harold Urey . La masse de la particule neutre hypothétique serait peu différente de celle du proton. Rutherford a déterminé qu'une telle particule de charge nulle serait difficile à détecter par les techniques disponibles.
En 1921, Rutherford et William Harkins avaient nommé indépendamment la particule non chargée le neutron , tandis qu'à peu près à la même époque le mot proton était adopté pour le noyau d'hydrogène. Neutron a apparemment été construit à partir de la racine latine pour neutre et de la terminaison grecque -on (par imitation d' électron et de proton ). Des références au mot neutron en rapport avec l'atome peuvent cependant être trouvées dans la littérature dès 1899.
Rutherford et Chadwick ont immédiatement commencé un programme expérimental au laboratoire Cavendish de Cambridge pour rechercher le neutron. Les expériences se sont poursuivies tout au long des années 1920 sans succès.
La conjecture de Rutherford n'a pas été largement acceptée. Dans sa monographie de 1931 sur la Constitution des noyaux atomiques et de la radioactivité , George Gamow , alors à l'Institut de physique théorique de Copenhague, ne mentionne pas le neutron. Lors de leurs mesures à Paris de 1932 qui conduiront à la découverte du neutron, Irène Joliot-Curie et Frédéric Joliot ignoraient la conjecture.
Problèmes de l'hypothèse des électrons nucléaires
Tout au long des années 1920, les physiciens ont supposé que le noyau atomique était composé de protons et d'« électrons nucléaires ». Dans cette hypothèse, le noyau azote-14 ( 14 N) serait composé de 14 protons et 7 électrons, de sorte qu'il aurait une charge nette de +7 unités de charge élémentaire et une masse de 14 unités de masse atomique. Ce noyau serait également mis en orbite par 7 autres électrons, appelés « électrons externes » par Rutherford, pour compléter l' atome de 14 N. Cependant, des problèmes avec l'hypothèse sont rapidement devenus apparents.
Ralph Kronig a souligné en 1926 que la structure hyperfine observée des spectres atomiques était incompatible avec l'hypothèse proton-électron. Cette structure est causée par l'influence du noyau sur la dynamique des électrons en orbite. Les moments magnétiques des supposés "électrons nucléaires" devraient produire des séparations de raies spectrales hyperfines similaires à l' effet Zeeman , mais aucun de ces effets n'a été observé. Il semblait que le moment magnétique de l'électron s'évanouissait lorsqu'il était dans le noyau.
Lors d'une visite à l' Université d'Utrecht en 1928, Kronig a découvert un aspect surprenant du spectre de rotation de N 2 + . La mesure de précision effectuée par Leonard Ornstein , directeur du laboratoire de physique d'Utrecht, a montré que le spin du noyau d'azote doit être égal à un. Cependant, si le noyau d' azote-14 ( 14 N) était composé de 14 protons et 7 électrons, un nombre impair de particules de spin-1/2, alors le spin nucléaire résultant devrait être un demi-entier. Kronig a donc suggéré que peut-être « les protons et les électrons ne conservent pas leur identité dans la mesure où ils le font en dehors du noyau ».
Les observations des niveaux d'énergie de rotation des molécules diatomiques à l'aide de la spectroscopie Raman par Franco Rasetti en 1929 étaient incompatibles avec les statistiques attendues de l'hypothèse proton-électron. Rasetti a obtenu des spectres de bandes pour les molécules H 2 et N 2 . Alors que les lignes pour les deux molécules diatomiques montraient une alternance d'intensité entre la lumière et l'obscurité, le schéma d'alternance pour H 2 est opposé à celui de N 2 . Après avoir soigneusement analysé ces résultats expérimentaux, les physiciens allemands Walter Heitler et Gerhard Herzberg ont montré que les noyaux d'hydrogène obéissent aux statistiques de Fermi et les noyaux d'azote obéissent aux statistiques de Bose. Cependant, un résultat alors inédit d' Eugene Wigner montrait qu'un système composite avec un nombre impair de particules de spin 1/2 doit obéir aux statistiques de Fermi ; un système avec un nombre pair de particules de spin 1/2 obéit aux statistiques de Bose. Si le noyau d'azote avait 21 particules, il devrait obéir aux statistiques de Fermi, contrairement aux faits. Ainsi, Heitler et Herzberg concluent : "l'électron dans le noyau... perd sa capacité à déterminer les statistiques du noyau".
Le paradoxe de Klein , découvert par Oskar Klein en 1928, a présenté d'autres objections de la mécanique quantique à la notion d'électron confiné dans un noyau. Dérivé de l' équation de Dirac , ce paradoxe clair et précis suggérait qu'un électron s'approchant d'une barrière de potentiel élevé a une forte probabilité de traverser la barrière par un processus de création de paires . Apparemment, un électron ne pourrait pas être confiné dans un noyau par un puits de potentiel. La signification de ce paradoxe a été intensément débattue à l'époque.
Vers 1930, il était généralement reconnu qu'il était difficile de concilier le modèle proton-électron pour les noyaux avec la relation d'incertitude de Heisenberg de la mécanique quantique. Cette relation, Δ x ⋅Δ p ≥ 1 / 2 ħ , implique qu'un électron confiné à une région de la taille d'un noyau atomique a typiquement une énergie cinétique non inférieure à 40 MeV, qui est supérieure à l'énergie observée des particules bêta émises du noyau. Une telle énergie est également beaucoup plus grande que l'énergie de liaison des nucléons, dont Aston et d'autres ont montré qu'elle était inférieure à 9 MeV par nucléon.
En 1927, Charles Ellis et W. Wooster au Laboratoire Cavendish ont mesuré les énergies des électrons de désintégration β. Ils ont constaté que la distribution des énergies de tout noyau radioactif particulier était large et continue, un résultat qui contrastait particulièrement avec les valeurs d'énergie distinctes observées dans les désintégrations alpha et gamma. De plus, la distribution continue de l'énergie semblait indiquer que l'énergie n'était pas conservée par ce processus "d'électrons nucléaires". En effet, en 1929, Bohr proposa de modifier la loi de conservation de l'énergie pour tenir compte de la distribution continue de l'énergie. La proposition a obtenu le soutien de Werner Heisenberg. De telles considérations étaient apparemment raisonnables, dans la mesure où les lois de la mécanique quantique avaient si récemment renversé les lois de la mécanique classique.
Bien que toutes ces considérations n'aient pas « prouvé » qu'un électron ne pouvait pas exister dans le noyau, elles étaient déroutantes et difficiles à interpréter pour les physiciens . De nombreuses théories ont été inventées pour expliquer comment les arguments ci-dessus pourraient être faux. Dans sa monographie de 1931, Gamow a résumé toutes ces contradictions, marquant les déclarations concernant les électrons dans le noyau avec des symboles d'avertissement.
Découverte du neutron
En 1930, Walther Bothe et Herbert Becker à Giessen , en Allemagne, ont découvert que si les particules alpha énergétiques émises par le polonium tombaient sur certains éléments légers, en particulier le béryllium (9
4Être
), le bore (11
5B
), ou au lithium (7
3Li
), un rayonnement exceptionnellement pénétrant a été produit. Le béryllium a produit le rayonnement le plus intense. Le polonium est hautement radioactif, produisant un rayonnement alpha énergétique, et il était couramment utilisé pour les expériences de diffusion à l'époque. Le rayonnement alpha peut être influencé par un champ électrique, car il est composé de particules chargées. Le rayonnement pénétrant observé n'était cependant pas influencé par un champ électrique, on a donc pensé qu'il s'agissait d'un rayonnement gamma . Le rayonnement était plus pénétrant que tous les rayons gamma connus, et les détails des résultats expérimentaux étaient difficiles à interpréter.

Deux ans plus tard, Irène Joliot-Curie et Frédéric Joliot à Paris montraient que si ce rayonnement inconnu tombait sur la cire de paraffine , ou tout autre composé contenant de l' hydrogène , il éjectait des protons de très haute énergie (5 MeV). Cette observation n'était pas en elle-même incompatible avec la nature supposée des rayons gamma du nouveau rayonnement, mais cette interprétation ( diffusion Compton ) posait un problème logique. Du point de vue de l'énergie et de la quantité de mouvement, un rayon gamma devrait avoir une énergie incroyablement élevée (50 MeV) pour diffuser un proton massif. A Rome, le jeune physicien Ettore Majorana a déclaré que la manière dont le nouveau rayonnement interagissait avec les protons nécessitait une nouvelle particule neutre.
En entendant les résultats de Paris, ni Rutherford ni James Chadwick du Laboratoire Cavendish n'ont cru à l'hypothèse des rayons gamma. Assisté de Norman Feather , Chadwick réalisa rapidement une série d'expériences montrant que l'hypothèse des rayons gamma était intenable. L'année précédente, Chadwick, JER Constable et EC Pollard avaient déjà mené des expériences sur la désintégration d'éléments légers à l'aide du rayonnement alpha du polonium. Ils avaient également développé des méthodes plus précises et efficaces pour détecter, compter et enregistrer les protons éjectés. Chadwick a répété la création du rayonnement en utilisant du béryllium pour absorber les particules alpha : 9 Be + 4 He (α) → 12 C + 1 n. À la suite de l'expérience de Paris, il a dirigé le rayonnement vers la cire de paraffine, un hydrocarbure à haute teneur en hydrogène, offrant ainsi une cible dense en protons. Comme dans l'expérience de Paris, le rayonnement a dispersé énergétiquement certains des protons. Chadwick a mesuré la portée de ces protons et a également mesuré l'impact du nouveau rayonnement sur les atomes de divers gaz. Il a découvert que le nouveau rayonnement n'était pas constitué de rayons gamma, mais de particules non chargées ayant à peu près la même masse que le proton . Ces particules étaient des neutrons. Chadwick a remporté le prix Nobel de physique en 1935 pour cette découverte.
L'année 1932 fut plus tard appelée « annus mirabilis » pour la physique nucléaire dans le laboratoire Cavendish, avec des découvertes du neutron, de la désintégration nucléaire artificielle par l' accélérateur de particules Cockcroft-Walton et du positron .
Modèle proton-neutron du noyau
Compte tenu des problèmes du modèle proton-électron , il a été rapidement admis que le noyau atomique est composé de protons et de neutrons, bien que la nature précise du neutron n'était initialement pas claire. Quelques mois après la découverte du neutron, Werner Heisenberg et Dmitri Ivanenko avaient proposé des modèles proton-neutron pour le noyau. Les articles phares de Heisenberg abordaient la description des protons et des neutrons dans le noyau par la mécanique quantique. Alors que la théorie de Heisenberg pour les protons et les neutrons dans le noyau était une "étape majeure vers la compréhension du noyau en tant que système de mécanique quantique", il supposait toujours la présence d'électrons nucléaires. En particulier, Heisenberg a supposé que le neutron était un composite proton-électron, pour lequel il n'y a pas d'explication en mécanique quantique. Heisenberg n'avait aucune explication sur la façon dont des électrons légers pouvaient être liés dans le noyau. Heisenberg a introduit la première théorie des forces d'échange nucléaire qui lient les nucléons. Il considérait que les protons et les neutrons étaient des états quantiques différents de la même particule, c'est-à-dire des nucléons se distinguant par la valeur de leurs nombres quantiques d' isospin nucléaire .
Le modèle proton-neutron a expliqué le puzzle du diazote. Lorsque 14 N a été proposé de composé de 3 paires chacune des protons et des neutrons, avec un neutron supplémentaire non apparié et le proton chacun apportant une rotation de 1 / deux H dans la même direction pour une rotation totale de 1 h, le modèle devient viable. Bientôt, les neutrons ont été utilisés pour expliquer naturellement les différences de spin dans de nombreux nucléides différents de la même manière.
Si le modèle proton-neutron pour le noyau a résolu de nombreux problèmes, il a mis en évidence le problème de l'explication des origines du rayonnement bêta. Aucune théorie existante ne pourrait expliquer comment les électrons, ou les positons, pourraient émaner du noyau. En 1934, Enrico Fermi a publié son article classique décrivant le processus de désintégration bêta , dans lequel le neutron se désintègre en un proton en créant un électron et un neutrino (encore non découvert) . L'article utilisait l'analogie selon laquelle les photons , ou rayonnement électromagnétique, étaient créés et détruits de la même manière lors de processus atomiques. Ivanenko avait suggéré une analogie similaire en 1932. La théorie de Fermi exige que le neutron soit une particule de spin 1 ⁄ 2 . La théorie préservait le principe de conservation de l'énergie, remis en cause par la distribution continue de l'énergie des particules bêta. La théorie de base de la désintégration bêta proposée par Fermi a été la première à montrer comment des particules pouvaient être créées et détruites. Il a établi une théorie de base générale pour l'interaction des particules par des forces faibles ou fortes. Bien que cet article influent ait résisté à l'épreuve du temps, les idées qu'il contenait étaient si nouvelles que lorsqu'il a été soumis pour la première fois à la revue Nature en 1933, il a été rejeté comme étant trop spéculatif.
La nature du neutron
La question de savoir si le neutron était une particule composite d'un proton et d'un électron a persisté pendant quelques années après sa découverte. En 1932, Harrie Massey a exploré un modèle de neutron composite pour expliquer son grand pouvoir de pénétration à travers la matière et sa neutralité électrique, par exemple. La question était un héritage de l'opinion dominante des années 1920 selon laquelle les seules particules élémentaires étaient le proton et l'électron.
La nature du neutron était un sujet principal de discussion lors de la 7e Conférence Solvay tenue en octobre 1933, à laquelle assistaient Heisenberg, Niels Bohr , Lise Meitner , Ernest Lawrence , Fermi, Chadwick et d'autres. Comme l'a posé Chadwick dans sa Bakerian Lecture en 1933, la question principale était la masse du neutron par rapport au proton. Si la masse du neutron était inférieure aux masses combinées d'un proton et d'un électron (1,0078 u ), alors le neutron pourrait être un composite proton-électron en raison du défaut de masse de l' énergie de liaison nucléaire . S'il est supérieur aux masses combinées, alors le neutron était élémentaire comme le proton. La question était difficile à répondre car la masse de l'électron n'est que de 0,05 % de celle du proton, des mesures exceptionnellement précises étaient donc nécessaires.
La difficulté de la mesure est illustrée par les valeurs très variées de la masse du neutron obtenues de 1932 à 1934. La valeur admise aujourd'hui est 1.008 66 u . Dans l'article de 1932 de Chadwick sur la découverte, il a estimé que la masse du neutron était comprise entre1,005 u et1.008 u . En bombardant du bore avec des particules alpha, Frédéric et Irène Joliot-Curie ont obtenu une valeur élevée de1,012 u , tandis que l'équipe d'Ernest Lawrence à l'Université de Californie mesurait la petite valeur1.0006 u utilisant leur nouveau cyclotron .
En 1935, Chadwick et son doctorant Maurice Goldhaber ont résolu le problème en rapportant la première mesure précise de la masse du neutron. Ils ont utilisé les rayons gamma de 2,6 MeV du Thallium -208 ( 208 Tl) (alors connu sous le nom de thorium C" ) pour photodésintégrer le deutéron
Dans cette réaction, le proton et le neutron résultants ont une énergie cinétique à peu près égale, car leurs masses sont à peu près égales. L'énergie cinétique du proton résultant pourrait être mesurée (0,24 MeV), et donc l'énergie de liaison du deutéron pourrait être déterminée (2,6 MeV − 2 (0,24 MeV) = 2,1 MeV, ou0,0023 u ). La masse du neutron pourrait alors être déterminée par le simple bilan de masse
m d + être = m p + m n
où m d,p,n se réfèrent à la masse du deutéron, du proton ou du neutron, et "be" est l'énergie de liaison. Les masses du deutéron et du proton étaient connues ; Chadwick et Goldhaber ont utilisé les valeurs 2,0142 u et 1,0081 u, respectivement. Ils ont découvert que la masse du neutron était légèrement supérieure à la masse du proton1,0084 u ou1,0090 u , selon la valeur précise utilisée pour la masse du deutéron. La masse du neutron était trop grande pour être un composite proton-électron, et le neutron a donc été identifié comme une particule élémentaire. Chadwick et Goldhaber ont prédit qu'un neutron libre serait capable de se désintégrer en un proton, un électron et un neutrino ( désintégration bêta ).
La physique des neutrons dans les années 30
Peu de temps après la découverte du neutron, des preuves indirectes ont suggéré que le neutron avait une valeur non nulle inattendue pour son moment magnétique. Les tentatives pour mesurer le moment magnétique du neutron ont pour origine la découverte par Otto Stern en 1933 à Hambourg que le proton avait un moment magnétique anormalement grand. En 1934, des groupes dirigés par Stern, maintenant à Pittsburgh , et II Rabi à New York avaient indépendamment déduit que le moment magnétique du neutron était négatif et étonnamment grand en mesurant les moments magnétiques du proton et du deutéron . Les valeurs du moment magnétique du neutron ont également été déterminées par Robert Bacher (1933) à Ann Arbor et IY Tamm et SA Altshuler (1934) en Union soviétique à partir d'études de la structure hyperfine des spectres atomiques. À la fin des années 1930, des valeurs précises pour le moment magnétique du neutron avaient été déduites par le groupe Rabi en utilisant des mesures utilisant des techniques de résonance magnétique nucléaire nouvellement développées . La grande valeur du moment magnétique du proton et la valeur négative déduite du moment magnétique du neutron étaient inattendues et ont soulevé de nombreuses questions.

La découverte du neutron a immédiatement donné aux scientifiques un nouvel outil pour sonder les propriétés des noyaux atomiques. Les particules alpha avaient été utilisées au cours des décennies précédentes dans des expériences de diffusion, mais ces particules, qui sont des noyaux d'hélium, ont une charge de +2. Cette charge rend difficile pour les particules alpha de surmonter la force répulsive de Coulomb et d'interagir directement avec les noyaux des atomes. Comme les neutrons n'ont pas de charge électrique, ils n'ont pas à vaincre cette force pour interagir avec les noyaux. Presque coïncidant avec sa découverte, les neutrons ont été utilisés par Norman Feather , collègue et protégé de Chadwick, dans des expériences de diffusion avec de l'azote. Feather a pu montrer que les neutrons interagissant avec les noyaux d'azote se dispersaient en protons ou induisaient la désintégration de l'azote pour former du bore avec l'émission d'une particule alpha. Feather a donc été le premier à montrer que les neutrons produisent des désintégrations nucléaires.
À Rome , Enrico Fermi et son équipe ont bombardé des éléments plus lourds avec des neutrons et ont découvert que les produits étaient radioactifs. En 1934, ils avaient utilisé des neutrons pour induire de la radioactivité dans 22 éléments différents, dont beaucoup avaient un numéro atomique élevé. Remarquant que d'autres expériences avec des neutrons dans son laboratoire semblaient mieux fonctionner sur une table en bois que sur une table en marbre, Fermi soupçonna que les protons du bois ralentissaient les neutrons et augmentaient ainsi les chances pour le neutron d'interagir avec les noyaux. Fermi a donc fait passer des neutrons à travers de la cire de paraffine pour les ralentir et a constaté que la radioactivité de certains éléments bombardés augmentait d'un facteur de dizaines à des centaines. La section efficace d'interaction avec les noyaux est beaucoup plus grande pour les neutrons lents que pour les neutrons rapides. En 1938, Fermi a reçu le prix Nobel de physique « pour ses démonstrations de l'existence de nouveaux éléments radioactifs produits par irradiation neutronique et pour sa découverte connexe des réactions nucléaires provoquées par les neutrons lents » .
A Berlin , la collaboration de Lise Meitner et Otto Hahn , avec leur assistant Fritz Strassmann , a permis de faire avancer les recherches commencées par Fermi et son équipe lorsqu'ils ont bombardé de l'uranium avec des neutrons. Entre 1934 et 1938, Hahn, Meitner et Strassmann ont trouvé un grand nombre de produits de transmutation radioactifs issus de ces expériences, qu'ils considéraient tous comme transuraniens . Les nucléides transuraniens sont ceux qui ont un numéro atomique supérieur à l'uranium (92), formés par absorption neutronique ; ces nucléides ne sont pas naturels. En juillet 1938, Meitner a été forcée d'échapper aux persécutions antisémites dans l'Allemagne nazie après l' Anschluss , et elle a pu obtenir un nouveau poste en Suède. L'expérience décisive des 16 et 17 décembre 1938 (utilisant un processus chimique appelé « fractionnement radium-baryum-mésothorium ») a produit des résultats déroutants : ce qu'ils avaient compris comme étant trois isotopes du radium se comportaient plutôt systématiquement comme du baryum . Le radium (numéro atomique 88) et le baryum (numéro atomique 56) appartiennent au même groupe chimique . En janvier 1939, Hahn avait conclu que ce qu'ils pensaient être des nucléides transuraniens étaient plutôt des nucléides beaucoup plus légers, tels que le baryum, le lanthane , le cérium et les platinoïdes légers . Meitner et son neveu Otto Frisch ont immédiatement et correctement interprété ces observations comme résultant de la fission nucléaire , un terme inventé par Frisch.
Hahn et ses collaborateurs avaient détecté la division des noyaux d'uranium, rendus instables par l'absorption de neutrons, en éléments plus légers. Meitner et Frisch ont également montré que la fission de chaque atome d'uranium libérerait environ 200 MeV d'énergie. La découverte de la fission a électrisé la communauté mondiale des physiciens atomiques et le public. Dans leur deuxième publication sur la fission nucléaire, Hahn et Strassmann ont prédit l'existence et la libération de neutrons supplémentaires au cours du processus de fission. Frédéric Joliot et son équipe ont prouvé que ce phénomène était une réaction en chaîne en mars 1939. En 1945, Hahn a reçu le prix Nobel de chimie 1944 "pour sa découverte de la fission des noyaux atomiques lourds".
Après 1939
La découverte de la fission nucléaire à la fin de 1938 marque un déplacement des centres de recherche nucléaire de l' Europe vers les États-Unis. Un grand nombre de scientifiques migraient vers les États-Unis pour échapper aux troubles et à l' antisémitisme en Europe et à la guerre imminente (Voir les scientifiques juifs et le projet Manhattan ). Les nouveaux centres de recherche nucléaire étaient les universités aux États-Unis, en particulier l'Université Columbia à New York et l' Université de Chicago où Enrico Fermi s'était installé, et un centre de recherche secret à Los Alamos , Nouveau-Mexique , créé en 1942, le nouveau foyer du projet Manhattan . Ce projet de guerre était axé sur la construction d' armes nucléaires , exploitant l'énorme énergie libérée par la fission de l'uranium ou du plutonium par le biais de réactions en chaîne à base de neutrons.
Les découvertes du neutron et du positon en 1932 ont été le début de la découverte de nombreuses nouvelles particules. Muons ont été découverts en 1936. Pions et kaons ont été découverts en 1947, alors que les particules lambda ont été découverts en 1950. Tout au long des années 1950 et 1960, un grand nombre de particules appelées hadrons ont été découverts. Un schéma de classification pour l'organisation de toutes ces particules, proposé indépendamment par Murray Gell-Mann et George Zweig en 1964, est devenu connu sous le nom de modèle des quarks . Selon ce modèle, des particules telles que le proton et le neutron n'étaient pas élémentaires, mais composées de diverses configurations d'un petit nombre d'autres particules véritablement élémentaires appelées partons ou quarks . Le modèle des quarks a fait l'objet d'une vérification expérimentale à partir de la fin des années 1960 et a finalement fourni une explication du moment magnétique anormal du neutron.
Vidéos
- Ernest Rutherford résume l'état de la physique nucléaire en 1935. (7 min., Nobelprize.org)
- Hans Bethe discute des travaux de Chadwick et Goldhaber sur la désintégration du deutéron. (2 min., Web d'histoires)
Remarques
Les références
Lectures complémentaires
- Bibliographie annotée pour les neutrons de la bibliothèque numérique Alsos pour les questions nucléaires
- Abraham Pais , Inward Bound , Oxford : Oxford University Press, 1986. ISBN 0198519974 .
- Herwig Schopper , Interactions faibles et désintégration bêta nucléaire , éditeur, North-Holland Pub. Co., 1966. OCLC 644015779
- Ruth Lewin Sime , Lise Meitner : Une vie en physique , Berkeley, University of California Press, 1996. ISBN 0520208609 .
- Roger H. Stuewer , "L'hypothèse des électrons nucléaires". Dans Otto Hahn et l'essor de la physique nucléaire , William R. Shea, éd. Dordrecht, Pays-Bas : Maison d'édition D. Riedel. p. 19-67, 1983. ISBN 90-277-1584-X .
- Sin-Itiro Tomonaga , The Story of Spin , The University of Chicago Press, 1997. ISBN 9780226807942