Élastine - Elastin
| Élastine | |||||||
|---|---|---|---|---|---|---|---|
| Identifiants | |||||||
| Alias | tropoélastinelastineELN | ||||||
| Identifiants externes | Cartes génétiques : [1] | ||||||
| Orthologues | |||||||
| Espèce | Humain | Souris | |||||
| Entrez |
|
|
|||||
| Ensemble |
|
|
|||||
| UniProt |
|
||||||
| RefSeq (ARNm) |
|
|
|||||
| RefSeq (protéine) |
|
|
|||||
| Localisation (UCSC) | n / A | n / A | |||||
| Recherche PubMed | n / A | n / A | |||||
| Wikidata | |||||||
| |||||||
L'élastine est une protéine clé de la matrice extracellulaire . Il est très élastique et présent dans le tissu conjonctif permettant à de nombreux tissus du corps de reprendre leur forme après étirement ou contraction. L'élastine aide la peau à revenir à sa position d'origine lorsqu'elle est piquée ou pincée. L'élastine est également un tissu porteur important dans le corps des vertébrés et utilisé dans des endroits où l'énergie mécanique doit être stockée. Chez l'homme, l'élastine est codée par le gène ELN .
Une fonction
Le gène ELN code pour une protéine qui est l'un des deux composants des fibres élastiques . La protéine codée est riche en acides aminés hydrophobes tels que la glycine et la proline , qui forment des régions hydrophobes mobiles délimitées par des réticulations entre les résidus lysine . Plusieurs variants de transcription codant pour différentes isoformes ont été trouvés pour ce gène. Le précurseur soluble de l'élastine est la tropoélastine. La caractérisation du désordre est cohérente avec un mécanisme de recul élastique entraîné par l'entropie. Il est conclu que le trouble conformationnel est une caractéristique constitutive de la structure et de la fonction de l'élastine.
Signification clinique
Les délétions et les mutations de ce gène sont associées à une sténose aortique supravalvulaire (SVAS) et à la cutis laxa autosomique dominante . D' autres défauts associés à l' élastine comprennent le syndrome de Marfan , l' emphysème provoqué par α 1 -antitrypsine carence, l' athérosclérose , le syndrome de Buschke-Ollendorff , le syndrome de Menkes , pseudoxanthome élastique , et le syndrome de Williams .
Élastose
L'élastose est l'accumulation d'élastine dans les tissus et est une forme de maladie dégénérative . Il existe une multitude de causes, mais la cause la plus fréquente est l' élastose actinique de la peau, également appelée élastose solaire , qui est causée par une exposition prolongée et excessive au soleil, un processus connu sous le nom de photovieillissement . Les causes rares d'élastose cutanée comprennent l' élastose perforante serpigineuse , l' élastose calcifiée perforante et l'élastose focale linéaire .
| État | Caractéristiques distinctives | Histopathologie |
|---|---|---|
|
Élastose actinique (la plus courante, également appelée élastose solaire) |
Élastine remplaçant les fibres de collagène du derme papillaire et du derme réticulaire |

|
| Elastose perforante serpigineuse | Fibres élastiques dégénérées et canaux perforants transépidermiques (la flèche dans l'image pointe vers l'un d'eux) |
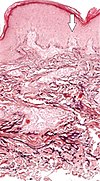
|
| Élastose calcifiante perforante | Agglutination de fibres élastiques courtes dans le derme. |

|
| Élastose focale linéaire | Accumulation de matériel élastotique fragmenté au sein du derme papillaire et élimination transcutanée des fibres élastotiques. |

|
Composition
Dans le corps, l'élastine est généralement associée à d'autres protéines dans les tissus conjonctifs. La fibre élastique dans le corps est un mélange d'élastine amorphe et de fibrilline fibreuse . Les deux composants sont principalement constitués d' acides aminés plus petits tels que la glycine , la valine , l' alanine et la proline . L'élastine totale varie de 58 à 75 % du poids de l'artère dégraissée sèche dans les artères canines normales. La comparaison entre les tissus frais et digérés montre qu'à 35% de déformation, un minimum de 48% de la charge artérielle est porté par l'élastine, et un minimum de 43% du changement de rigidité du tissu artériel est dû au changement de rigidité de l'élastine. .
Distribution de tissus
L'élastine remplit une fonction importante dans les artères en tant que moyen de propagation des ondes de pression pour favoriser la circulation sanguine et est particulièrement abondante dans les gros vaisseaux sanguins élastiques tels que l' aorte . Élastine est également très important dans les poumons , les ligaments élastiques , cartilage élastique , la peau et la vessie . Il est présent chez tous les vertébrés au-dessus des poissons sans mâchoire .
Caractéristiques
L'élastine est une protéine à très longue durée de vie, avec une demi-vie de plus de 78 ans chez l'homme.
Recherche clinique
La faisabilité de l'utilisation de la tropoélastine humaine recombinante pour permettre la production de fibres d'élastine afin d'améliorer la flexibilité de la peau dans les plaies et les cicatrices a été étudiée. Après des injections sous-cutanées de tropoélastine humaine recombinante dans des plaies fraîches, il s'est avéré qu'il n'y avait aucune amélioration de la cicatrisation ou de la flexibilité de la cicatrisation éventuelle.
Biosynthèse
Précurseurs de la tropoélastine
L'élastine est fabriquée en liant ensemble de nombreuses petites molécules de protéines précurseurs solubles de la tropoélastine (50-70 kDa ), pour former le complexe final massif insoluble et durable. Les molécules de tropoélastine non liées ne sont normalement pas disponibles dans la cellule, car elles se réticulent en fibres d'élastine immédiatement après leur synthèse par la cellule, après leur exportation dans la matrice extracellulaire .
Chaque tropoélastine se compose d'une chaîne de 36 petits domaines , chacun pesant environ 2 kDa dans une conformation de bobine aléatoire . La protéine consiste en une alternance de domaines hydrophobes et hydrophiles , qui sont codés par des exons séparés , de sorte que la structure de domaine de la tropoélastine reflète l'organisation des exons du gène. Les domaines hydrophiles contiennent des motifs Lys-Ala (KA) et Lys-Pro (KP) impliqués dans la réticulation lors de la formation d'élastine mature. Dans les domaines KA, les résidus lysine se présentent sous forme de paires ou de triplets séparés par deux ou trois résidus alanine (par exemple AAAKAAKAA) tandis que dans les domaines KP, les résidus lysine sont séparés principalement par des résidus proline (par exemple KPLKP).
Agrégation
La tropoélastine s'agrège à température physiologique en raison d'interactions entre les domaines hydrophobes dans un processus appelé coacervation . Ce processus est réversible et contrôlé thermodynamiquement et ne nécessite pas de clivage des protéines . Le coacervat est rendu insoluble par réticulation irréversible .
La réticulation
Pour fabriquer des fibres d'élastine matures, les molécules de tropoélastine sont réticulées via leurs résidus de lysine avec des molécules de réticulation de desmosine et d' isodesmosine . L'enzyme qui effectue la réticulation est la lysyl oxydase , en utilisant une réaction de synthèse de Chichibabin pyridine in vivo .
Biologie moléculaire
Chez les mammifères, le génome ne contient qu'un seul gène de la tropoélastine, appelé ELN . Le gène ELN humain est un segment de 45 kb sur le chromosome 7 et possède 34 exons interrompus par près de 700 introns, le premier exon étant un peptide signal attribuant sa localisation extracellulaire. Le grand nombre d'introns suggère que la recombinaison génétique peut contribuer à l'instabilité du gène, conduisant à des maladies telles que la SVAS . L'expression de l'ARNm de la tropoélastine est fortement régulée sous au moins huit sites différents de démarrage de la transcription .
Des variantes d'élastine spécifiques aux tissus sont produites par épissage alternatif du gène de la tropoélastine. Il existe au moins 11 isoformes connues de la tropoélastine humaine. ces isoformes sont soumises à une régulation du développement, mais il existe des différences minimes entre les tissus au même stade de développement.
Voir également
- Cutis laxa
- Fibres élastiques
- Récepteur d'élastine
- La résiline : une protéine d'invertébré
- syndrome de Williams
Les références
Lectures complémentaires
- Jan SL, Chan SC, Fu YC, Lin SJ (juin 2009). « Étude du gène de l'élastine chez les nourrissons atteints d'anévrisme congénital isolé du canal artériel ». Acta Cardiologica . 64 (3) : 363-9. doi : 10.2143/ac.64.3.2038023 . PMID 19593948 . S2CID 31411296 .
- Keeley FW, Bellingham CM, Woodhouse KA (février 2002). "L'élastine en tant que biomatériau auto-organisé: utilisation de polypeptides d'élastine humaine exprimés de manière recombinante comme modèle pour les enquêtes sur la structure et l'auto-assemblage de l'élastine" . Transactions philosophiques de la Royal Society de Londres. Série B, Sciences biologiques . 357 (1418) : 185-9. doi : 10.1098/rstb.2001.1027 . PMC 1692930 . PMID 11911775 .
- Choudhury R, McGovern A, Ridley C, Cain SA, Baldwin A, Wang MC, Guo C, Mironov A, Drymoussi Z, Trump D, Shuttleworth A, Baldock C, Kielty CM (septembre 2009). "Régulation différentielle de la formation de fibres élastiques par la fibuline-4 et -5" . Le Journal de Chimie Biologique . 284 (36) : 24553-67. doi : 10.1074/jbc.M109.019364 . PMC 2782046 . PMID 19570982 .
- Hubmacher D, Cirulis JT, Miao M, Keeley FW, Reinhardt DP (janvier 2010). "Conséquences fonctionnelles de l'homocystéinylation des protéines des fibres élastiques fibrilline-1 et tropoélastine" . Le Journal de Chimie Biologique . 285 (2) : 1188–98. doi : 10.1074/jbc.M109.021246 . PMC 2801247 . PMID 19889633 .
- Coolen NA, Schouten KC, Middelkoop E, Ulrich MM (janvier 2010). "Comparaison entre la peau fœtale humaine et la peau adulte" . Archives de la recherche dermatologique . 302 (1) : 47-55. doi : 10.1007/s00403-009-0989-8 . PMC 2799629 . PMID 19701759 .
- McGeachie M, Ramoni RL, Mychaleckyj JC, Furie KL, Dreyfuss JM, Liu Y, Herrington D, Guo X, Lima JA, Post W, Rotter JI, Rich S, Sale M, Ramoni MF (décembre 2009). "Modèle prédictif intégratif de la calcification des artères coronaires dans l'athérosclérose" . Circulation . 120 (24) : 2448–54. doi : 10.1161/CIRCULATIONAHA.109.865501 . PMC 2810344 . PMID 19948975 .
- Yoshida T, Kato K, Yokoi K, Oguri M, Watanabe S, Metoki N, Yoshida H, Satoh K, Aoyagi Y, Nishigaki Y, Nozawa Y, Yamada Y (août 2009). "Association de variantes génétiques avec une maladie rénale chronique chez des individus ayant des profils lipidiques différents" . Journal international de médecine moléculaire . 24 (2) : 233-46. doi : 10.3892/ijmm_00000226 . PMID 19578796 .
- Akima T, Nakanishi K, Suzuki K, Katayama M, Ohsuzu F, Kawai T (novembre 2009). "L'élastine soluble diminue dans la progression de la formation d'athérome dans l'aorte humaine" . Journal de diffusion . 73 (11) : 2154-62. doi : 10.1253/circj.cj-09-0104 . PMID 19755752 .
- Chen Q, Zhang T, Roshetsky JF, Ouyang Z, Essers J, Fan C, Wang Q, Hinek A, Plough EF, Dicorleto PE (octobre 2009). "La fibuline-4 régule l'expression du gène de la tropoélastine et la formation de fibres élastiques qui en résulte par les fibroblastes humains" . Le Journal Biochimique . 423 (1) : 79-89. doi : 10.1042/BJ20090993 . PMC 3024593 . PMID 19627254 .
- Tintar D, Samouillan V, Dandurand J, Lacabanne C, Pepe A, Bochicchio B, Tamburro AM (novembre 2009). « Séquence de tropoélastine humaine : dynamique du polypeptide codé par l'exon 6 en solution ». Biopolymères . 91 (11) : 943-52. doi : 10.1002/bip.21282 . PMID 19603496 .
- Dyksterhuis LB, Weiss AS (juin 2010). « Les modèles d'homologie pour les domaines 21-23 de la tropoélastine humaine mettent en lumière la réticulation de la lysine ». Communications de recherche biochimique et biophysique . 396 (4) : 870-3. doi : 10.1016/j.bbrc.2010.05.013 . PMID 20457133 .
- Romero R, Velez Edwards DR, Kusanovic JP, Hassan SS, Mazaki-Tovi S, Vaisbuch E, Kim CJ, Chaiworapongsa T, Pearce BD, Friel LA, Bartlett J, Anant MK, Salisbury BA, Vovis GF, Lee MS, Gomez R , Behnke E, Oyarzun E, Tromp G, Williams SM, Menon R (mai 2010). "Identification des polymorphismes nucléotidiques fœtaux et maternels dans les gènes candidats qui prédisposent au travail prématuré spontané avec des membranes intactes" . Journal américain d'obstétrique et de gynécologie . 202 (5) : 431.e1-34. doi : 10.1016/j.ajog.2010.03.026 . PMC 3604889 . PMID 20452482 .
- Fan BJ, Figuieredo Sena DR, Pasquale LR, Grosskreutz CL, Rhee DJ, Chen TC, Delbono EA, Haines JL, Wiggs JL (septembre 2010). "L'absence d'association des polymorphismes de l'élastine avec le syndrome de pseudoexfoliation et le glaucome" . Journal du glaucome . 19 (7) : 432-436. doi : 10.1097/IJG.0b013e3181c4b0fe . PMC 6748032 . PMID 20051886 .
- Bertram C, Hass R (oct. 2009). « La sénescence cellulaire des cellules épithéliales mammaires humaines (HMEC) est associée à une signalisation MMP-7/HB-EGF altérée et à une formation accrue de structures de type élastine ». Mécanismes du vieillissement et du développement . 130 (10) : 657-69. doi : 10.1016/j.mad.2009.08.001 . PMID 19682489 . S2CID 46477586 .
- Roberts KE, Kawut SM, Krowka MJ, Brown RS, Trotter JF, Shah V, Peter I, Tighiouart H, Mitra N, Handorf E, Knowles JA, Zacks S, Fallon MB (juil. 2010). « Facteurs de risque génétiques du syndrome hépatopulmonaire chez les patients atteints d'une maladie hépatique avancée » . Gastro-entérologie . 139 (1) : 130-9.e24. doi : 10.1053/j.gastro.2010.03.044 . PMC 2908261 . PMID 20346360 .
- Rosenbloom J (décembre 1984). « Élastine : relation de protéine et de structure de gène à la maladie ». Enquête de laboratoire . 51 (6) : 605–23. PMID 6150137 .
- Bax DV, Rodgers UR, Bilek MM, Weiss AS (octobre 2009). "L'adhésion cellulaire à la tropoélastine est médiée par le motif GRKRK C-terminal et l'intégrine alphaVbeta3" . Le Journal de Chimie Biologique . 284 (42) : 28616-23. doi : 10.1074/jbc.M109.017525 . PMC 2781405 . PMID 19617625 .
- Rodriguez-Revenga L, Iranzo P, Badenas C, Puig S, Carrió A, Milà M (septembre 2004). "Une nouvelle mutation du gène de l'élastine résultant en une forme autosomique dominante de cutis laxa" . Archives de dermatologie . 140 (9) : 1135–9. doi : 10.1001/archderm.140.9.1135 . PMID 15381555 .
- Micale L, Turturo MG, Fusco C, Augello B, Jurado LA, Izzi C, Digilio MC, Milani D, Lapi E, Zelante L, Merla G (mars 2010). "Identification et caractérisation de sept nouvelles mutations du gène de l'élastine dans une cohorte de patients atteints de sténose aortique supravalvulaire" . Journal Européen de Génétique Humaine . 18 (3) : 317-23. doi : 10.1038/ejhg.2009.181 . PMC 2987220 . PMID 19844261 .
- Tzaphlidou M (2004). « Le rôle du collagène et de l'élastine dans la peau âgée : une approche de traitement d'image ». Micron . 35 (3) : 173-7. doi : 10.1016/j.micron.2003.11.003 . PMID 15036271 .
Liens externes
- Élastine à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis
- Image d'histologie : 21402loa - Système d'apprentissage d'histologie à l'Université de Boston
- Entrée GeneReviews/NIH/NCBI/UW sur le syndrome de Williams ou Williams-Beuren
- La protéine d'élastine
- Microfibrille
Cet article incorpore du texte de la National Library of Medicine des États-Unis , qui est dans le domaine public .


