Chromatographie des gaz - Gas chromatography
 Un chromatographe en phase gazeuse avec un échantillonneur d'espace de tête
| |
| Acronyme | CG |
|---|---|
| Classification | Chromatographie |
| Analytes |
Organique Inorganique Doit être volatile |
| Autres techniques | |
| En rapport |
Chromatographie sur couche mince Chromatographie liquide haute performance |
| trait d'union | Chromatographie en phase gazeuse-spectrométrie de masse |
La chromatographie en phase gazeuse ( GC ) est un type courant de chromatographie utilisé en chimie analytique pour séparer et analyser des composés qui peuvent être vaporisés sans décomposition . Les utilisations typiques de la GC comprennent le test de la pureté d'une substance particulière ou la séparation des différents composants d'un mélange. En chromatographie préparative , la GC peut être utilisée pour préparer des composés purs à partir d'un mélange.
La chromatographie en phase gazeuse est aussi parfois appelée chromatographie en phase vapeur (VPC) ou chromatographie de partage gaz-liquide (GLPC). Ces noms alternatifs, ainsi que leurs abréviations respectives, sont fréquemment utilisés dans la littérature scientifique.
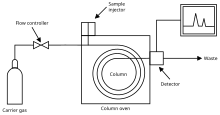
La chromatographie en phase gazeuse est le processus de séparation des composés dans un mélange en injectant un échantillon gazeux ou liquide dans une phase mobile, généralement appelée gaz porteur, et en faisant passer le gaz à travers une phase stationnaire. La phase mobile est généralement un gaz inerte ou un gaz non réactif tel que l' hélium , l' argon , l' azote ou l' hydrogène . La phase stationnaire est une couche microscopique de liquide visqueux sur une surface de particules solides sur un support solide inerte à l'intérieur d'un morceau de tube de verre ou de métal appelé colonne. La surface des particules solides peut également jouer le rôle de phase stationnaire dans certaines colonnes. La colonne de verre ou de métal traversée par la phase gazeuse est située dans un four où la température du gaz peut être contrôlée et l'éluant sortant de la colonne est surveillé par un détecteur informatisé.
Histoire
La chromatographie remonte à 1903 dans les travaux du scientifique russe, Mikhail Semenovich Tswett , qui séparait les pigments végétaux par chromatographie sur colonne liquide. La physico-chimiste allemande Erika Cremer en 1947 avec l'étudiant diplômé autrichien Fritz Prior a développé les fondements théoriques de la GC et construit le premier chromatographe liquide-gaz, mais son travail a été jugé hors de propos et a été ignoré pendant longtemps. Les chimistes anglais Archer Martin et Richard Synge ont reçu un prix Nobel en 1952 pour l'invention de la chromatographie de partage dans les années 1940, posant les bases de la chromatographie en phase gazeuse. La popularité de la chromatographie en phase gazeuse a rapidement augmenté après le développement du détecteur à ionisation de flamme.
Analyse GC
Un chromatographe en phase gazeuse est un instrument d'analyse chimique permettant de séparer les produits chimiques dans un échantillon complexe. Un chromatographe en phase gazeuse est constitué d'un tube à écoulement étroit, appelé colonne, à travers lequel l'échantillon passe dans un flux gazeux (le gaz vecteur) à des vitesses différentes en fonction de leurs diverses propriétés chimiques et physiques et de leur interaction avec un produit spécifique. le garnissage ou le remplissage des colonnes, appelé "phase stationnaire" . Lorsque les produits chimiques sortent de l'extrémité de la colonne, ils sont détectés et identifiés électroniquement. La fonction de la phase stationnaire dans la colonne est de séparer les différents composants, faisant chacun sortir de la colonne à un moment différent. D'autres paramètres qui peuvent être utilisés pour modifier l'ordre ou le temps de rétention sont le débit de gaz porteur, la longueur de la colonne et la température.
Dans une analyse GC, un volume connu d' analyte gazeux ou liquide est injecté à travers un disque en caoutchouc et dans un port chaud à température contrôlée fixé à la colonne. Lorsque le gaz porteur transporte les molécules d'analyte à travers la colonne, il y a adsorption des molécules d' analyte soit sur les parois de la colonne, soit sur des matériaux de garnissage (phase stationnaire) dans la colonne pour assurer la séparation. Étant donné que chaque type de molécule a une vitesse de progression différente, les divers composants du mélange d'analytes sont séparés au fur et à mesure qu'ils progressent le long de la colonne et atteignent la fin de la colonne à des moments différents (temps de rétention). Un détecteur est utilisé pour surveiller le moment auquel chaque composant atteint la sortie et finalement la quantité de ce composant peut être déterminée. Généralement, les substances sont identifiées (qualitativement) par l'ordre dans lequel elles éluent de la colonne et par le temps de rétention de l'analyte dans la colonne.
Composants physiques
Échantillonneurs automatiques
L'échantillonneur automatique permet d'introduire automatiquement un échantillon dans les injecteurs. L'insertion manuelle de l'échantillon est possible mais n'est plus courante. L'insertion automatique offre une meilleure reproductibilité et une optimisation du temps.
Il existe différents types d'échantillonneurs automatiques. Les échantillonneurs automatiques peuvent être classés en fonction de la capacité d'échantillonnage (auto-injecteurs par rapport aux échantillonneurs automatiques, où les auto-injecteurs peuvent traiter un petit nombre d'échantillons), aux technologies robotiques (robot XYZ par rapport au robot rotatif - le plus courant) ou à l'analyse :
- Liquide
- Espace de tête statique grâce à la technologie de la seringue
- Espace de tête dynamique grâce à la technologie de ligne de transfert
- Microextraction en phase solide (SPME)
Entrées
L'entrée de la colonne (ou injecteur) permet d'introduire un échantillon dans un flux continu de gaz vecteur. L'entrée est un morceau de matériel attaché à la tête de colonne.
Les types d'entrée courants sont :
- Injecteur S/SL (split/splitless) ; un échantillon est introduit dans une petite chambre chauffée via une seringue à travers un septum - la chaleur facilite la volatilisation de l'échantillon et de la matrice de l'échantillon. Le gaz vecteur balaie ensuite la totalité (mode sans division) ou une partie (mode avec division) de l'échantillon dans la colonne. En mode fractionné, une partie du mélange échantillon/gaz vecteur dans la chambre d'injection est évacuée par l'évent fractionné. L'injection fractionnée est préférable lorsque l'on travaille avec des échantillons avec des concentrations élevées d'analytes (> 0,1 %), tandis que l'injection sans fractionnement est la mieux adaptée pour l'analyse de traces avec de faibles quantités d'analytes (< 0,01 %). En mode sans division, la vanne divisée s'ouvre après un laps de temps prédéfini pour purger les éléments plus lourds qui contamineraient autrement le système. Ce temps préréglé (sans fractionnement) doit être optimisé, le temps le plus court (par exemple, 0,2 min) assure moins de queue mais la perte de réponse, le plus long (2 min) augmente la queue mais aussi le signal.
- Entrée sur colonne ; l'échantillon est ici introduit directement dans la colonne dans son intégralité sans chaleur, ou à une température inférieure à la température d'ébullition du solvant. La basse température condense l'échantillon dans une zone étroite. La colonne et l'entrée peuvent ensuite être chauffées, libérant l'échantillon dans la phase gazeuse. Cela garantit la température la plus basse possible pour la chromatographie et empêche les échantillons de se décomposer au-dessus de leur point d'ébullition.
- injecteur PTV; L'introduction d'échantillons à température programmée a été décrite pour la première fois par Vogt en 1979. À l'origine, Vogt a développé la technique comme méthode d'introduction de grands volumes d'échantillons (jusqu'à 250 µL) dans la GC capillaire. Vogt a introduit l'échantillon dans le manchon à un débit d'injection contrôlé. La température du liner a été choisie légèrement en dessous du point d'ébullition du solvant. Le solvant à bas point d'ébullition a été évaporé en continu et ventilé à travers la ligne de séparation. Sur la base de cette technique, Poy a développé l'injecteur vaporisateur à température programmée ; PTV. En introduisant l'échantillon à une faible température initiale du revêtement, de nombreux inconvénients des techniques classiques d'injection à chaud pourraient être évités.
- Entrée de source de gaz ou vanne de commutation de gaz ; les échantillons gazeux dans des bouteilles de collecte sont connectés à ce qui est le plus souvent une vanne de commutation à six ports. Le flux de gaz porteur n'est pas interrompu tandis qu'un échantillon peut être étendu dans une boucle d'échantillonnage préalablement évacuée. Lors de la commutation, le contenu de la boucle d'échantillonnage est inséré dans le flux de gaz porteur.
- Système P/T (Purge-and-Trap) ; Un gaz inerte est mis à barboter à travers un échantillon aqueux, provoquant la purge des produits chimiques volatils insolubles de la matrice. Les volatiles sont « piégés » sur une colonne absorbante (appelée piège ou concentrateur) à température ambiante. Le piège est ensuite chauffé et les volatiles sont dirigés dans le flux de gaz porteur. Les échantillons nécessitant une préconcentration ou une purification peuvent être introduits via un tel système, généralement connecté au port S/SL.
Le choix du gaz vecteur (phase mobile) est important. L'hydrogène a une gamme de débits qui sont comparables à l'hélium en efficacité. Cependant, l'hélium peut être plus efficace et fournir la meilleure séparation si les débits sont optimisés. L'hélium est ininflammable et fonctionne avec un plus grand nombre de détecteurs et d'instruments plus anciens. Par conséquent, l'hélium est le gaz vecteur le plus couramment utilisé. Cependant, le prix de l'hélium a considérablement augmenté ces dernières années, poussant un nombre croissant de chromatographistes à passer à l'hydrogène gazeux. L'utilisation historique, plutôt qu'une considération rationnelle, peut contribuer à l'utilisation préférentielle continue de l'hélium.
Détecteurs
Les détecteurs couramment utilisés sont le détecteur à ionisation de flamme (FID) et le détecteur à conductivité thermique (TCD). Alors que les TCD sont bénéfiques en ce qu'ils sont non destructifs, sa faible limite de détection pour la plupart des analytes inhibe une utilisation généralisée. Les FID sont sensibles principalement aux hydrocarbures, et y sont plus sensibles que le TCD. Les FID ne peuvent pas détecter l'eau ou le dioxyde de carbone, ce qui les rend idéaux pour l'analyse d'analytes organiques environnementaux. Le FID est deux à trois fois plus sensible à la détection des analytes que le TCD.
Le TCD repose sur la conductivité thermique de la matière passant autour d'un fil mince de tungstène-rhénium avec un courant qui le traverse. Dans cette configuration, l'hélium ou l'azote servent de gaz porteur en raison de leur conductivité thermique relativement élevée qui maintient le filament frais et maintient une résistivité et une efficacité électrique uniformes du filament. Lorsque les molécules d'analyte sont éluées de la colonne, mélangées au gaz vecteur, la conductivité thermique diminue tandis qu'il y a une augmentation de la température et de la résistivité du filament entraînant des fluctuations de tension provoquant finalement une réponse du détecteur. La sensibilité du détecteur est proportionnelle au courant du filament alors qu'elle est inversement proportionnelle à la température ambiante immédiate de ce détecteur ainsi qu'au débit du gaz vecteur.
Dans un détecteur à ionisation de flamme (FID), des électrodes sont placées à côté d'une flamme alimentée en hydrogène/air près de la sortie de la colonne, et lorsque des composés contenant du carbone sortent de la colonne, ils sont pyrolysés par la flamme. Ce détecteur ne fonctionne que pour les composés organiques/hydrocarbures en raison de la capacité des carbones à former des cations et des électrons lors de la pyrolyse qui génère un courant entre les électrodes. L'augmentation du courant est traduite et apparaît comme un pic dans un chromatogramme. Les FID ont des limites de détection faibles (quelques picogrammes par seconde), mais ils sont incapables de générer des ions à partir de carbones contenant du carbonyle . Les gaz vecteurs compatibles FID comprennent l'hélium, l'hydrogène, l'azote et l'argon.
Le détecteur de flamme alcaline (AFD) ou le détecteur à ionisation de flamme alcaline (AFID) a une sensibilité élevée à l'azote et au phosphore, similaire au NPD. Cependant, les ions de métaux alcalins sont fournis avec l'hydrogène gazeux, plutôt qu'une perle au-dessus de la flamme. Pour cette raison, l'AFD ne subit pas la "fatigue" du NPD, mais offre une sensibilité constante sur une longue période de temps. De plus, lorsque les ions alcalins ne sont pas ajoutés à la flamme, l'AFD fonctionne comme un FID standard. Un détecteur de combustion catalytique (CCD) mesure les hydrocarbures combustibles et l'hydrogène. Le détecteur à ionisation à décharge (DID) utilise une décharge électrique à haute tension pour produire des ions.
Le réacteur polyarc est un complément aux instruments GC-FID nouveaux ou existants qui convertit tous les composés organiques en molécules de méthane avant leur détection par le FID. Cette technique peut être utilisée pour améliorer la réponse du FID et permettre la détection de beaucoup plus de composés contenant du carbone. La conversion complète des composés en méthane et la réponse désormais équivalente dans le détecteur élimine également le besoin d'étalonnages et d'étalons car les facteurs de réponse sont tous équivalents à ceux du méthane. Cela permet l'analyse rapide de mélanges complexes contenant des molécules pour lesquelles les normes ne sont pas disponibles.
Le détecteur photométrique de flamme (FPD) utilise un tube photomultiplicateur pour détecter les raies spectrales des composés lorsqu'ils sont brûlés dans une flamme. Les composés élués de la colonne sont transportés dans une flamme alimentée à l'hydrogène qui excite des éléments spécifiques dans les molécules, et les éléments excités (P, S, halogènes, certains métaux) émettent une lumière de longueurs d'onde caractéristiques spécifiques. La lumière émise est filtrée et détectée par un tube photomultiplicateur. En particulier, l'émission de phosphore est d'environ 510 à 536 nm et l'émission de soufre est de 394 nm. Avec un détecteur d'émission atomique (AED), un échantillon éluant d'une colonne pénètre dans une chambre qui est alimentée par des micro-ondes qui induisent un plasma. Le plasma provoque la décomposition de l'échantillon d'analyte et certains éléments génèrent un spectre d'émission atomique. Le spectre d'émission atomique est diffracté par un réseau de diffraction et détecté par une série de tubes photomultiplicateurs ou de photodiodes.
Le détecteur à capture d'électrons (ECD) utilise une source de particules bêta radioactives (électrons) pour mesurer le degré de capture d'électrons. Les ECD sont utilisés pour la détection de molécules contenant des éléments électronégatifs/retirants et des groupes fonctionnels tels que des halogènes, des carbonyles, des nitriles, des groupes nitro et des organométalliques. Dans ce type de détecteur, de l'azote ou du méthane à 5 % dans l'argon est utilisé comme gaz porteur de la phase mobile. Le gaz porteur passe entre deux électrodes placées en bout de colonne, et à côté de la cathode (électrode négative) réside une feuille radioactive telle que 63Ni. La feuille radioactive émet une particule bêta (électron) qui entre en collision avec et ionise le gaz porteur pour générer plus d'ions résultant en un courant. Lorsque des molécules d'analyte avec des éléments électronégatifs/retirants ou des groupes fonctionnels, des électrons sont capturés, ce qui entraîne une diminution du courant générant une réponse du détecteur.
Détecteur d'azote-phosphore (NPD), une forme de détecteur thermoionique où l'azote et le phosphore modifient le travail d'extraction sur une perle spécialement revêtue et un courant résultant est mesuré.
Le détecteur de conductivité électrolytique à sec (DELCD) utilise une phase aérienne et une température élevée (v. Coulsen) pour mesurer les composés chlorés.
Spectromètre de masse (MS), également appelé GC-MS ; très efficace et sensible, même dans une petite quantité d'échantillon. Ce détecteur peut être utilisé pour identifier les analytes dans les chromatogrammes par leur spectre de masse. Certains GC-MS sont connectés à un spectromètre RMN qui fait office de détecteur de secours. Cette combinaison est connue sous le nom de GC-MS-RMN . Certaines GC-MS-NMR sont connectées à un spectrophotomètre infrarouge qui fait office de détecteur de secours. Cette combinaison est connue sous le nom de GC-MS-NMR-IR. Il faut cependant souligner que c'est très rare car la plupart des analyses nécessaires peuvent être conclues par GC-MS purement.
L'ultraviolet sous vide (VUV) représente le développement le plus récent dans les détecteurs de chromatographie en phase gazeuse. La plupart des espèces chimiques absorbent et ont des sections efficaces d'absorption en phase gazeuse uniques dans la gamme de longueurs d'onde VUV d'environ 120 à 240 nm surveillées. Lorsque les sections efficaces d'absorption sont connues pour les analytes, le détecteur VUV est capable de déterminer de manière absolue (sans étalonnage) le nombre de molécules présentes dans la cellule à écoulement en l'absence d'interférences chimiques.
Le détecteur olfactométrique , également appelé GC-O, utilise un évaluateur humain pour analyser l'activité olfactive des composés. Avec un port d'odeur ou un port de reniflement, la qualité de l'odeur, l'intensité de l'odeur et la durée de l'activité olfactive d'un composé peuvent être évaluées.
Les autres détecteurs comprennent le détecteur de conductivité électrolytique Hall (ElCD), le détecteur à ionisation d'hélium (HID), le détecteur infrarouge (IRD), le détecteur à photo-ionisation (PID), le détecteur à ionisation à décharge pulsée (PDD) et le détecteur à ionisation thermoionique (TID).
Méthodes

La méthode est l'ensemble des conditions dans lesquelles fonctionne le GC pour une analyse donnée. Le développement de méthodes est le processus consistant à déterminer quelles conditions sont adéquates et/ou idéales pour l'analyse requise.
Les conditions qui peuvent être modifiées pour s'adapter à une analyse requise comprennent la température d'entrée, la température du détecteur, la température de la colonne et le programme de température, les débits de gaz porteur et de gaz porteur, la phase stationnaire de la colonne, le diamètre et la longueur, le type d'entrée et les débits, la taille de l'échantillon et l'injection technique. Selon le(s) détecteur(s) (voir ci-dessous) installés sur le CPG, il peut y avoir un certain nombre de conditions de détecteur qui peuvent également être modifiées. Certains GC comprennent également des vannes qui peuvent modifier le trajet de l'échantillon et du flux de support. Le moment de l'ouverture et de la fermeture de ces vannes peut être important pour le développement de la méthode.
Sélection et débits de gaz vecteur
Les gaz vecteurs typiques comprennent l' hélium , l' azote , l' argon et l' hydrogène . Le gaz à utiliser est généralement déterminé par le détecteur utilisé, par exemple, un DID nécessite de l'hélium comme gaz porteur. Lors de l'analyse d'échantillons de gaz, le porteur est également sélectionné en fonction de la matrice de l'échantillon, par exemple, lors de l'analyse d'un mélange dans l'argon, un porteur d'argon est préféré car l'argon dans l'échantillon n'apparaît pas sur le chromatogramme. La sécurité et la disponibilité peuvent également influencer le choix du transporteur.
La pureté du gaz vecteur est également fréquemment déterminée par le détecteur, bien que le niveau de sensibilité requis puisse également jouer un rôle important. Typiquement, des puretés de 99,995% ou plus sont utilisées. Les degrés de pureté les plus courants requis par les instruments modernes pour la majorité des sensibilités sont des degrés de 5,0, ou 99,999 % de pureté, ce qui signifie qu'il y a un total de 10 ppm d'impuretés dans le gaz vecteur qui pourraient affecter les résultats. Les grades de pureté les plus élevés couramment utilisés sont les grades 6,0, mais le besoin de détection à des niveaux très bas dans certaines applications médico-légales et environnementales a entraîné le besoin de gaz vecteurs à une pureté de grade 7,0 et ceux-ci sont désormais disponibles dans le commerce. Les noms commerciaux pour les puretés typiques incluent « grade zéro », « qualité ultra-haute pureté (UHP) », « qualité 4,5 » et « qualité 5,0 ».
La vitesse linéaire du gaz vecteur affecte l'analyse de la même manière que la température (voir ci-dessus). Plus la vitesse linéaire est élevée, plus l'analyse est rapide, mais plus la séparation entre les analytes est faible. Le choix de la vitesse linéaire est donc le même compromis entre le niveau de séparation et la durée d'analyse que le choix de la température de la colonne. La vitesse linéaire sera mise en œuvre au moyen du débit de gaz porteur, par rapport au diamètre intérieur de la colonne.
Avec les GC fabriqués avant les années 1990, le débit du porteur était contrôlé indirectement en contrôlant la pression d'entrée du porteur, ou « pression de tête de colonne ». Le débit réel a été mesuré à la sortie de la colonne ou du détecteur à l'aide d'un débitmètre électronique ou d'un débitmètre à bulles, et pouvait être un processus complexe, long et frustrant. Il n'a pas été possible de faire varier le réglage de la pression pendant l'analyse, et donc le débit était essentiellement constant pendant l'analyse. La relation entre le débit et la pression d'entrée est calculée avec l'équation de Poiseuille pour les fluides compressibles .
Cependant, de nombreux CPG modernes mesurent électroniquement le débit et contrôlent électroniquement la pression du gaz vecteur pour régler le débit. Par conséquent, les pressions du vecteur et les débits peuvent être ajustés pendant l'analyse, créant des programmes de pression/débit similaires aux programmes de température.
Sélection de composé stationnaire
La polarité du soluté est cruciale pour le choix du composé stationnaire, qui dans un cas optimal aurait une polarité similaire à celle du soluté. Les phases stationnaires courantes dans les colonnes tubulaires ouvertes sont le cyanopropylphényl diméthyl polysiloxane, le carbowax polyéthylène glycol, le biscyanopropyl cyanopropylphényl polysiloxane et le diphényl diméthyl polysiloxane. Pour les colonnes remplies, davantage d'options sont disponibles.
Types d'entrée et débits
Le choix du type d'injecteur et de la technique d'injection dépend du fait que l'échantillon est sous forme liquide, gazeuse, adsorbée ou solide, et de la présence d'une matrice de solvant à vaporiser. Les échantillons dissous peuvent être introduits directement sur la colonne via un injecteur COC, si les conditions sont bien connues ; si une matrice de solvant doit être vaporisée et partiellement éliminée, un injecteur S/SL est utilisé (technique d'injection la plus courante) ; les échantillons gazeux (par exemple, les bouteilles d'air) sont généralement injectés à l'aide d'un système de vanne de commutation de gaz ; les échantillons adsorbés (par exemple, sur des tubes adsorbants) sont introduits à l'aide d'un appareil de désorption externe (en ligne ou hors ligne) tel qu'un système de purge et de piégeage, ou sont désorbés dans l'injecteur (applications SPME).
Taille de l'échantillon et technique d'injection
Injection d'échantillon
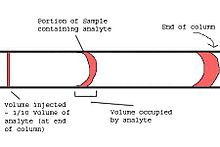
La véritable analyse chromatographique commence par l'introduction de l'échantillon sur la colonne. Le développement de la chromatographie en phase gazeuse capillaire a entraîné de nombreux problèmes pratiques avec la technique d'injection. La technique d'injection sur colonne, souvent utilisée avec les colonnes garnies, n'est généralement pas possible avec les colonnes capillaires. Dans le système d'injection du chromatographe en phase gazeuse capillaire, la quantité injectée ne doit pas surcharger la colonne et la largeur du bouchon injecté doit être faible par rapport à l'étalement dû au processus chromatographique. Le non-respect de cette dernière exigence réduira la capacité de séparation de la colonne. En règle générale, le volume injecté, V inj , et le volume de la cellule détectrice, V det , doivent être d'environ 1/10 du volume occupé par la portion d'échantillon contenant les molécules d'intérêt (analytes) lorsqu'elles sortent du colonne.
Certaines exigences générales qu'une bonne technique d'injection doit remplir sont qu'il doit être possible d'obtenir l'efficacité de séparation optimale de la colonne, elle doit permettre des injections précises et reproductibles de petites quantités d'échantillons représentatifs, elle ne doit induire aucun changement dans la composition de l'échantillon, elle ne doit pas présenter une discrimination basée sur des différences de point d'ébullition, de polarité, de concentration ou de stabilité thermique/catalytique, et elle devrait être applicable à l'analyse de traces ainsi qu'aux échantillons non dilués.
Cependant, il existe un certain nombre de problèmes inhérents à l'utilisation de seringues pour injection. Même les meilleures seringues revendiquent une précision de seulement 3%, et entre des mains non qualifiées, les erreurs sont beaucoup plus importantes. L'aiguille peut couper de petits morceaux de caoutchouc dans le septum lorsqu'elle injecte l'échantillon à travers celui-ci. Ceux-ci peuvent bloquer l'aiguille et empêcher la seringue de se remplir la prochaine fois qu'elle est utilisée. Il n'est peut-être pas évident que cela s'est produit. Une fraction de l'échantillon peut se retrouver piégée dans le caoutchouc, pour être libérée lors des injections suivantes. Cela peut donner lieu à des pics fantômes dans le chromatogramme. Il peut y avoir une perte sélective des composants les plus volatils de l'échantillon par évaporation de la pointe de l'aiguille.
Sélection de colonne
Le choix de la colonne dépend de l'échantillon et de l'actif mesuré. Le principal attribut chimique pris en compte lors du choix d'une colonne est la polarité du mélange, mais les groupes fonctionnels peuvent jouer un rôle important dans la sélection de la colonne. La polarité de l'échantillon doit correspondre étroitement à la polarité de la phase stationnaire de la colonne pour augmenter la résolution et la séparation tout en réduisant le temps d'analyse. La séparation et le temps d'exécution dépendent également de l'épaisseur du film (de la phase stationnaire), du diamètre de la colonne et de la longueur de la colonne.
Température de la colonne et programme de température
La ou les colonnes d'un GC sont contenues dans un four dont la température est contrôlée électroniquement avec précision. (En discutant de la "température de la colonne", un analyste fait techniquement référence à la température du four à colonne. La distinction, cependant, n'est pas importante et ne sera pas faite par la suite dans cet article.)
La vitesse à laquelle un échantillon passe à travers la colonne est directement proportionnelle à la température de la colonne. Plus la température de la colonne est élevée, plus l'échantillon se déplace rapidement dans la colonne. Cependant, plus un échantillon se déplace rapidement dans la colonne, moins il interagit avec la phase stationnaire et moins les analytes sont séparés.
En général, la température de la colonne est choisie pour faire un compromis entre la longueur de l'analyse et le niveau de séparation.
Une méthode qui maintient la colonne à la même température pendant toute l'analyse est appelée « isotherme ». Cependant, la plupart des méthodes augmentent la température de la colonne pendant l'analyse, la température initiale, le taux d'augmentation de la température (la "rampe de température") et la température finale sont appelés programme de température.
Un programme de température permet aux analytes qui s'éluent au début de l'analyse de se séparer de manière adéquate, tout en raccourcissant le temps nécessaire aux analytes à élution tardive pour traverser la colonne.
Réduction et analyse des données
Analyse qualitative
Généralement, les données chromatographiques sont présentées sous forme de graphique de la réponse du détecteur (axe des y) par rapport au temps de rétention (axe des x), appelé chromatogramme. Ceci fournit un spectre de pics pour un échantillon représentant les analytes présents dans un échantillon éluant de la colonne à différents moments. Le temps de rétention peut être utilisé pour identifier les analytes si les conditions de la méthode sont constantes. En outre, la configuration des pics sera constante pour un échantillon dans des conditions constantes et peut identifier des mélanges complexes d'analytes. Cependant, dans la plupart des applications modernes, le GC est connecté à un spectromètre de masse ou à un détecteur similaire capable d'identifier les analytes représentés par les pics.
Analyse quantitative
L'aire sous un pic est proportionnelle à la quantité d'analyte présente dans le chromatogramme. En calculant l'aire du pic à l'aide de la fonction mathématique d' intégration , la concentration d'un analyte dans l'échantillon d'origine peut être déterminée. La concentration peut être calculée à l'aide d'une courbe d'étalonnage créée en trouvant la réponse pour une série de concentrations d'analyte, ou en déterminant le facteur de réponse relatif d'un analyte. Le facteur de réponse relative est le rapport attendu d'un analyte à un étalon interne (ou étalon externe ) et est calculé en trouvant la réponse d'une quantité connue d'analyte et d'une quantité constante d'étalon interne (un produit chimique ajouté à l'échantillon à une concentration, avec un temps de rétention distinct pour l'analyte).
Dans la plupart des systèmes GC-MS modernes, un logiciel informatique est utilisé pour dessiner et intégrer des pics et faire correspondre les spectres MS aux spectres de la bibliothèque.
Applications
En général, les substances qui se vaporisent en dessous de 300 °C (et sont donc stables jusqu'à cette température) peuvent être mesurées quantitativement. Les échantillons doivent également être exempts de sel ; ils ne doivent pas contenir d' ions . Des quantités très infimes d'une substance peuvent être mesurées, mais il est souvent nécessaire que l'échantillon soit mesuré par rapport à un échantillon contenant la substance pure et suspectée connue sous le nom d' étalon de référence .
Divers programmes de température peuvent être utilisés pour rendre les lectures plus significatives ; par exemple pour différencier les substances qui se comportent de manière similaire au cours du processus de GC.
Les professionnels travaillant avec GC analysent le contenu d'un produit chimique, par exemple pour s'assurer de la qualité des produits de l'industrie chimique ; ou mesurer des produits chimiques dans le sol, l'air ou l'eau, tels que les gaz du sol . La GC est très précise si elle est utilisée correctement et peut mesurer des picomoles d'une substance dans un échantillon liquide de 1 ml, ou des concentrations en parties par milliard dans des échantillons gazeux.
Dans les cours pratiques des collèges, les étudiants se familiarisent parfois avec le GC en étudiant le contenu de l' huile de lavande ou en mesurant l' éthylène sécrété par les plantes Nicotiana benthamiana après avoir blessé artificiellement leurs feuilles. Ces GC analysent les hydrocarbures (C2-C40+). Dans une expérience typique, une colonne garnie est utilisée pour séparer les gaz légers, qui sont ensuite détectés avec un TCD . Les hydrocarbures sont séparés à l'aide d'une colonne capillaire et détectés avec un FID . Une complication avec les analyses de gaz légers qui incluent H 2 est que He, qui est le support inerte le plus commun et le plus sensible (la sensibilité est proportionnelle à la masse moléculaire) a une conductivité thermique presque identique à l'hydrogène (c'est la différence de conductivité thermique entre deux filaments séparés dans un arrangement de type pont de Wheatstone qui montre quand un composant a été élué). Pour cette raison, les instruments à double TCD utilisés avec un canal séparé pour l'hydrogène utilisant l'azote comme vecteur sont courants. L'argon est souvent utilisé lors de l'analyse des réactions chimiques en phase gazeuse telles que la synthèse FT afin qu'un seul gaz vecteur puisse être utilisé plutôt que deux distincts. La sensibilité est réduite, mais c'est un compromis pour la simplicité de l'alimentation en gaz.
La chromatographie en phase gazeuse est largement utilisée en médecine légale . Des disciplines aussi diverses que l'identification et la quantification de la dose de médicament solide (formulaire de pré-consommation), l'enquête sur les incendies criminels, l'analyse des éclats de peinture et les cas de toxicologie, utilisent la GC pour identifier et quantifier divers échantillons biologiques et preuves de scènes de crime.
Voir également
- Chimie analytique
- Chromatographie
- Chromatographie en phase gazeuse-spectrométrie de masse
- Chromatographie en phase gazeuse-olfactométrie
- Chromatographie en phase liquide à haute performance
- Chromatographie en phase gazeuse inverse
- Spectrométrie de masse à réaction de transfert de protons
- Ionisation secondaire par électrospray
- Spectrométrie de masse à tube à flux ionique sélectionné
- Ajout standard
- Chromatographie sur couche mince
- Mélange complexe non résolu
Les références
Liens externes
![]() Médias liés à la chromatographie en phase gazeuse sur Wikimedia Commons
Médias liés à la chromatographie en phase gazeuse sur Wikimedia Commons
- Colonnes chromatographiques dans la bibliothèque Chemistry LibreTexts
- Chromatographie en phase gazeuse à Curlie