Paraplégie spastique héréditaire - Hereditary spastic paraplegia
| Paraplégie spastique héréditaire | |
|---|---|
| Spécialité |
Neurologie |
La paraplégie spastique héréditaire ( HSP ) est un groupe de maladies héréditaires dont la principale caractéristique est un trouble progressif de la marche. La maladie se manifeste par une raideur progressive ( spasticité ) et une contraction des membres inférieurs. La HSP est également connue sous le nom de paraparésie spastique héréditaire, paraplégie spastique familiale, maladie des colonies françaises, maladie de Strumpell ou maladie de Strumpell-Lorrain. Les symptômes sont le résultat d'un dysfonctionnement des axones longs de la moelle épinière . Les cellules affectées sont les motoneurones primaires ; par conséquent, la maladie est une maladie des motoneurones supérieurs . La HSP n'est pas une forme de paralysie cérébrale même si elle peut physiquement apparaître et se comporter de la même manière que la diplégie spastique . L'origine de la HSP est différente de la paralysie cérébrale. Malgré cela, certains des mêmes médicaments anti-spasmodiques utilisés dans la paralysie cérébrale spastique sont parfois utilisés pour traiter les symptômes de la HSP.
La HSP est causée par des défauts de transport des protéines, des protéines structurelles, des protéines de maintien des cellules, des lipides et d'autres substances à travers la cellule. Les fibres nerveuses longues (axones) sont affectées car les longues distances rendent les cellules nerveuses particulièrement sensibles aux défauts de ces mécanismes mentionnés.
La maladie a été décrite pour la première fois en 1880 par le neurologue allemand Adolph Strümpell . Il a été décrit plus en détail en 1888 par Maurice Lorrain, un médecin français. En raison de leur contribution à la description de la maladie, elle est encore appelée maladie de Strümpell-Lorrain dans les pays francophones. Le terme paraplégie spastique héréditaire a été inventé par Anita Harding en 1983.
Signes et symptômes
Les symptômes dépendent du type de HSP hérité. La principale caractéristique de la maladie est une spasticité progressive des membres inférieurs due à un dysfonctionnement du tractus pyramidal . Cela se traduit également par des réflexes vifs, des réflexes plantaires extenseurs, une faiblesse musculaire et des troubles variables de la vessie. En outre, parmi les principaux symptômes de la HSP figurent également une démarche anormale et des difficultés à marcher, une diminution du sens vibratoire au niveau des chevilles et une paresthésie . Les personnes atteintes de HSP peuvent ressentir une fatigue extrême associée à des troubles du système nerveux central et neuromusculaires, qui peuvent être invalidantes. Les symptômes initiaux sont généralement des difficultés d'équilibre, un écrasement de l'orteil ou un trébuchement. Les symptômes de la HSP peuvent apparaître à tout âge, de la petite enfance à plus de 60 ans. Si les symptômes commencent pendant l'adolescence ou plus tard, alors les troubles spastiques de la marche progressent généralement sur de nombreuses années. Des cannes, des déambulateurs et des fauteuils roulants peuvent éventuellement être nécessaires, bien que certaines personnes n'aient jamais besoin d'appareils d'assistance. Le handicap a été décrit comme progressant plus rapidement dans les formes d'apparition de l'adulte.
Plus précisément, les patients atteints de la forme pure autosomique dominante de HSP révèlent des mouvements faciaux et extraoculaires normaux. Bien que la secousse de la mâchoire puisse être vive chez les sujets plus âgés, il n'y a pas de troubles de la parole ou de difficulté à avaler. Le tonus et la force musculaire des membres supérieurs sont normaux. Dans les membres inférieurs, le tonus musculaire est augmenté au niveau des ischio-jambiers, des quadriceps et des chevilles. La faiblesse est plus notable au niveau du psoas - iliaque , du tibial antérieur et, dans une moindre mesure, des muscles ischio - jambiers . Dans la forme complexe du trouble, des symptômes supplémentaires sont présents. Ceux-ci incluent : neuropathie périphérique , amyotrophie , ataxie , déficience intellectuelle , ichtyose , épilepsie , neuropathie optique , démence , surdité ou problèmes d'élocution, de déglutition ou de respiration.
Anita Harding a classé le HSP sous une forme pure et compliquée. L'HSP pure présente une spasticité des membres inférieurs, associée à des troubles neurogènes de la vessie ainsi qu'à un manque de sensibilité aux vibrations ( pallhypesthésie ). D'autre part, la HSP est classée comme complexe lorsque la spasticité des membres inférieurs est associée à tout symptôme neurologique supplémentaire.
Cette classification est subjective et les patients atteints de HSP complexes sont parfois diagnostiqués comme ayant une ataxie cérébelleuse avec spasticité, une déficience intellectuelle (avec spasticité) ou une leucodystrophie . Certains des gènes énumérés ci-dessous ont déjà été décrits dans d'autres maladies que les HSP. Par conséquent, certains gènes clés se chevauchent avec d'autres groupes de maladies.
Âge d'apparition
Dans le passé, le HSP a été classé comme un début précoce dans la petite enfance ou un début plus tardif à l'âge adulte. L'âge d'apparition a deux points de maximum à l'âge de 2 ans et vers l'âge de 40 ans. De nouvelles découvertes suggèrent qu'une apparition plus précoce conduit à une durée plus longue de la maladie sans perte de mobilité ni besoin d'utiliser un fauteuil roulant. Cela a également été décrit plus tôt, que les formes d'apparition tardive évoluent plus rapidement.
Causer
HSP est un groupe de troubles génétiques. Il suit les règles générales de transmission et peut être hérité de manière autosomique dominante , autosomique récessive ou récessive liée à l'X . Le mode de transmission impliqué a un impact direct sur les chances d'hériter de la maladie. Plus de 70 génotypes ont été décrits et plus de 50 loci génétiques ont été liés à cette maladie. Dix gènes ont été identifiés à transmission autosomique dominante. L'un d'eux, SPG4, représente environ 50% de tous les cas génétiquement résolus, soit environ 25% de tous les cas HSP. Douze gènes sont connus pour être hérités de manière autosomique récessive. Collectivement, ce dernier groupe représente environ 1/3 des cas.
La plupart des gènes modifiés ont une fonction connue, mais pour certains, la fonction n'a pas encore été identifiée. Tous sont répertoriés dans la liste des gènes ci-dessous, y compris leur mode de transmission. Certains exemples sont la spastine (SPG4) et la paraplégine (SPG7) sont toutes deux des ATPases AAA.
Génotypes
Les gènes sont désignés SPG (Spastic gait gene). Les emplacements des gènes sont au format : chromosome - bras (court ou p : long ou q ) - numéro de bande. Ces désignations ne concernent que les gènes humains. Les emplacements peuvent (et seront probablement) varier dans d'autres organismes. Malgré le nombre de gènes connus pour être impliqués dans cette maladie, environ 40 % des cas n'ont pas encore identifié leur cause. Dans le tableau ci-dessous SPG? est utilisé pour indiquer un gène qui a été associé à HSP mais n'a pas encore reçu de désignation officielle de gène HSP.
| Génotype | OMIM | Symbole du gène | Locus du gène | Héritage | Âge d'apparition | Autres noms et caractéristiques |
|---|---|---|---|---|---|---|
| SPG1 | 303350 | L1CAM | Xq28 | récessif lié à l'X | De bonne heure | Syndrome MASA |
| SPG2 | 312920 | PLP1 | Xq22.2 | récessif lié à l'X | Variable | Maladie de Pelizaeus-Merzbacher |
| SPG3A | 182600 | ATL1 | 14q22.1 | Autosomique dominante | De bonne heure | Maladie de Strumpell (ce Wiki) |
| SPG4 | 182601 | SPAST | 2p22.3 | Autosomique dominante | Variable | |
| SPG5A | 270800 | CYP7B1 | 8q12.3 | Autosomique récessif | Variable | |
| SPG6 | 600363 | NIPA1 | 15q11.2 | Autosomique dominante | Variable | |
| SPG7 | 607259 | SPG7 | 16q24.3 | Autosomique dominante | Variable | |
| SPG8 | 603563 | KIAA0196 | 8q24.13 | Autosomique dominante | Adulte | |
| SPG9A | 601162 | ALDH18A1 | 10q24.1 | Autosomique dominante | Adolescent | Cataractes avec neuropathie motrice, petite taille et anomalies squelettiques |
| SPG9B | 616586 | ALDH18A1 | 10q24.1 | Autosomique récessif | De bonne heure | |
| SPG10 | 604187 | KIF5A | 12q13.3 | Autosomique dominante | De bonne heure | |
| SPG11 | 604360 | SPG11 | 15q21.1 | Autosomique récessif | Variable | |
| SPG12 | 604805 | RTN2 | 19q13.32 | Autosomique dominante | De bonne heure | |
| SPG13 | 605280 | HSP60 | 2q33.1 | Autosomique dominante | Variable | |
| SPG14 | 605229 | ? | 3q27–q28 | Autosomique récessif | Adulte | |
| SPG15 | 270700 | ZFYVE26 | 14q24.1 | Autosomique récessif | De bonne heure | |
| SPG16 | 300266 | ? | Xq11.2 | récessif lié à l'X | De bonne heure | |
| SPG17 | 270685 | BSCL2 | 11q12.3 | Autosomique dominante | Adolescent | |
| SPG18 | 611225 | ERLIN2 | 8p11.23 | Autosomique récessif | De bonne heure | |
| SPG19 | 607152 | ? | 9q | Autosomique dominante | Début adulte | |
| SPG20 | 275900 | SPG20 | 13q13.3 | Autosomique récessif | Début précoce | syndrome de Troyer |
| SPG21 | 248900 | ACP33 | 15q22.31 | Autosomique récessif | Début précoce | Syndrome MAST |
| SPG22 | 300523 | SLC16A2 | Xq13.2 | récessif lié à l'X | Début précoce | Syndrome d'Allan-Herndon-Dudley |
| SPG23 | 270750 | RIPK5 | 1q32.1 | Autosomique récessif | Début précoce | Syndrome de Lison |
| SPG24 | 607584 | ? | 13q14 | Autosomique récessif | Début précoce | |
| SPG25 | 608220 | ? | 6q23–q24.1 | Autosomique récessif | Adulte | |
| SPG26 | 609195 | B4GALNT1 | 12q13.3 | Autosomique récessif | Début précoce | |
| SPG27 | 609041 | ? | 10q22.1–q24.1 | Autosomique récessif | Variable | |
| SPG28 | 609340 | DDHD1 | 14q22.1 | Autosomique récessif | Début précoce | |
| SPG29 | 609727 | ? | 1p31.1–p21.1 | Autosomique dominante | Adolescent | |
| SPG30 | 610357 | KIF1A | 2q37.3 | Autosomique récessif | Adolescent | |
| SPG31 | 610250 | REEP1 | 2p11.2 | Autosomique dominante | Début précoce | |
| SPG32 | 611252 | ? | 14q12–q21 | Autosomique récessif | Enfance | |
| SPG33 | 610244 | ZFYVE27 | 10q24.2 | Autosomique dominante | Adulte | |
| SPG34 | 300750 | ? | Xq24–q25 | récessif lié à l'X | Adolescent/Adulte | |
| SPG35 | 612319 | FA2H | 16q23.1 | Autosomique récessif | Enfance | |
| SPG36 | 613096 | ? | 12q23–q24 | Autosomique dominante | Adolescent/Adulte | |
| SPG37 | 611945 | ? | 8p21.1–q13.3 | Autosomique dominante | Variable | |
| SPG38 | 612335 | ? | 4p16–p15 | Autosomique dominante | Adolescent/Adulte | |
| SPG39 | 612020 | PNPL6 | 19p13.2 | Autosomique récessif | Enfance | |
| SPG41 | 613364 | ? | 11p14.1–p11.2 | Autosomique dominante | Adolescence | |
| SPG42 | 612539 | SLC33A1 | 3q25.31 | Autosomique dominante | Variable | |
| SPG43 | 615043 | C19orf12 | 19q12 | Autosomique récessif | Enfance | |
| SPG44 | 613206 | GJC2 | 1q42.13 | Autosomique récessif | Enfance/adolescent | |
| SPG45 | 613162 | NT5C2 | 10q24.32–q24.33 | Autosomique récessif | Enfance | |
| SPG46 | 614409 | GBA2 | 9p13.3 | Autosomique récessif | Variable | |
| SPG47 | 614066 | AP4B1 | 1p13.2 | Autosomique récessif | Enfance | |
| SPG48 | 613647 | AP5Z1 | 7p22.1 | Autosomique récessif | 6ème décennie | |
| SPG49 | 615041 | TECPR2 | 14q32.31 | Autosomique récessif | Enfance | |
| SPG50 | 612936 | AP4M1 | 7q22.1 | Autosomique récessif | Enfance | |
| SPG51 | 613744 | AP4E1 | 15q21.2 | Autosomique récessif | Enfance | |
| SPG52 | 614067 | AP4S1 | 14q12 | Autosomique récessif | Enfance | |
| SPG53 | 614898 | VPS37A | 8p22 | Autosomique récessif | Enfance | |
| SPG54 | 615033 | DDHD2 | 8p11.23 | Autosomique récessif | Enfance | |
| SPG55 | 615035 | C12orf65 | 12q24.31 | Autosomique récessif | Enfance | |
| SPG56 | 615030 | CYP2U1 | 4q25 | Autosomique récessif | Enfance | |
| SPG57 | 615658 | TFG | 3q12.2 | Autosomique récessif | De bonne heure | |
| SPG58 | 611302 | KIF1C | 17p13.2 | Autosomique récessif | Au cours des deux premières décennies | Ataxie spastique 2 |
| SPG59 | 603158 | USP8 | 15q21.2 | ?Autosomique récessif | Enfance | |
| SPG60 | 612167 | WDR48 | 3p22.2 | ?Autosomique récessif | Enfance | |
| SPG61 | 615685 | ARL6IP1 | 16p12.3 | Autosomique récessif | Enfance | |
| SPG62 | 615681 | ERLIN1 | 10q24.31 | Autosomique récessif | Enfance | |
| SPG63 | 615686 | AMPD2 | 1p13.3 | Autosomique récessif | Enfance | |
| SPG64 | 615683 | ENTPD1 | 10q24.1 | Autosomique récessif | Enfance | |
| SPG66 | 610009 | ARSI | 5q32 | ?Autosomique dominant | Enfance | |
| SPG67 | 615802 | PGAP1 | 2q33.1 | Autosomique récessif | Enfance | |
| SPG68 | 609541 | KLC2 | 11q13.1 | Autosomique récessif | Enfance | Syndrome de SPOAN |
| SPG69 | 609275 | RAB3GAP2 | 1q41 | Autosomique récessif | Enfance | Syndrome Martsolf , syndrome Warburg Micro |
| SPG70 | 156560 | MARS | 12q13 | ?Autosomique dominant | Enfance | |
| SPG71 | 615635 | ZFR | 5p13.3 | ?Autosomique récessif | Enfance | |
| SPG72 | 615625 | REEP2 | 5q31 | Autosomique récessif; autosomique dominante |
Enfance | |
| SPG73 | 616282 | CPT1C | 19q13.33 | Autosomique dominante | Adulte | |
| SPG74 | 616451 | IBA57 | 1q42.13 | Autosomique récessif | Enfance | |
| SPG75 | 616680 | MAG | 19q13.12 | Autosomique récessif | Enfance | |
| SPG76 | 616907 | CAPN1 | 11q13 | Autosomique récessif | Adulte | |
| SPG77 | 617046 | FARS2 | 6p25 | Autosomique récessif | Enfance | |
| SPG78 | 617225 | ATP13A2 | 1p36 | Autosomique récessif | Adulte | Syndrome de Kufor-Rakeb |
| SPG79 | 615491 | UCHL1 | 4p13 | Autosomique récessif | Enfance | |
| HSNSP | 256840 | CCT5 | 5p15.2 | Autosomique récessif | Enfance | Neuropathie sensorielle héréditaire avec paraplégie spastique |
| SPG ? | SERAC1 | 6q25.3 | Juvénile | Syndrome de MEGDEL | ||
| SPG ? | 605739 | KY | 3q22.2 | Autosomique récessif | Enfance | |
| SPG ? | PLA2G6 | 22q13.1 | Autosomique récessif | Enfance | ||
| SPG ? | ATAD3A | 1p36.33 | Autosomique dominante | Enfance | Syndrome d'Harel-Yoon | |
| SPG ? | KCNA2 | 1p13.3 | Autosomique dominante | Enfance | ||
| SPG ? | Granuline | 17q21.31 | ||||
| SPG ? | POLR3A | 10q22.3 | Autosomique récessif |
Physiopathologie
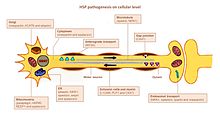
La principale caractéristique de la HSP est une dégénérescence axonale dépendante de la longueur. Il s'agit notamment des faisceaux corticospinaux croisés et non croisés jusqu'aux jambes et du fasciculus gracilis . Le tractus spinocérébelleux est impliqué dans une moindre mesure. Les corps cellulaires neuronaux des axones en dégénérescence sont préservés et il n'y a aucune preuve de démyélinisation primaire . Des pertes de cellules de la corne antérieure de la moelle épinière sont observées dans certains cas. Les ganglions de la racine dorsale, les racines postérieures et les nerfs périphériques ne sont pas directement touchés.
HSP affecte plusieurs voies dans les motoneurones. De nombreux gènes ont été identifiés et liés à la HSP. Il reste un défi de définir avec précision les acteurs clés de chacune des voies affectées, principalement parce que de nombreux gènes ont des fonctions multiples et sont impliqués dans plus d'une voie.
Trajectoire des axones
La recherche de chemin est importante pour la croissance des axones vers la bonne destination (par exemple, une autre cellule nerveuse ou un muscle). Le gène L1CAM, une glycoprotéine de surface cellulaire de la superfamille des immunoglobulines, est significatif pour ce mécanisme. Des mutations conduisant à une perte de fonction dans L1CAM sont également trouvées dans d'autres syndromes liés à l'X. Tous ces troubles présentent une atteinte du tractus corticospinal (une caractéristique distinctive de la HSP). L1CAM participe à un ensemble d'interactions, liant d'autres molécules L1CAM ainsi que des molécules d'adhésion cellulaire extracellulaire, des intégrines et des protéoglycanes ou des protéines intracellulaires comme les ankyrines.
Le défaut d'orientation se produit via l'association de L1CAM avec la neuropiline-1 . La neuropiline-1 interagit avec les protéines Plexine-A pour former le complexe récepteur de la sémaphorine-3A . La sémaphorine-a3A est ensuite libérée dans la moelle épinière ventrale pour éloigner les neurones corticospinaux de la jonction médiane moelle épinière/médullaire. Si L1CAM ne fonctionne pas correctement en raison d'une mutation, les neurones cortiocospinaux ne sont pas dirigés vers la position correcte et la déficience se produit.
Métabolisme des lipides
Les axones du système nerveux central et périphérique sont recouverts d'un isolant, la couche de myéline, pour augmenter la vitesse de propagation du potentiel d'action. Une myélinisation anormale dans le SNC est détectée dans certaines formes de hsp HSP. Plusieurs gènes étaient liés à la malformation de la myéline, à savoir PLP1, GFC2 et FA2H. Les mutations modifient la composition, l'épaisseur et l'intégrité de la myéline.
Le réticulum endoplasmique (RE) est le principal organite pour la synthèse des lipides. Des mutations dans les gènes codant pour des protéines qui jouent un rôle dans la formation de la morphologie du RE et du métabolisme des lipides ont été liées à la HSP. Des mutations dans ATL1 , BSCL2 et ERLIN2 modifient la structure du RE, en particulier le réseau tubulaire et la formation de jonctions à trois voies dans les tubules du RE. De nombreux gènes mutés sont liés à un métabolisme lipidique anormal. L'effet le plus répandu concerne le métabolisme de l'acide arachidonique ( CYP2U1 ) et du cholestérol ( CYP7B1 ), l'activité des phospholipases (DDHD1 et DDHD2), la formation de gangliosides ( B4GALNT-1 ) et l'équilibre entre le métabolisme des glucides et des graisses (SLV33A1).
Trafic endosomal
Les neurones absorbent des substances de leur environnement par endocytose. Les vésicules endocytaires fusionnent avec les endosomes afin de libérer leur contenu. Il y a trois compartiments principaux qui ont un trafic d'endosomes : Golgi vers/depuis les endosomes ; membrane plasmique vers/depuis les endosomes précoces (via le recyclage des endosomes) et les endosomes tardifs vers les lysosomes. Le dysfonctionnement du trafic endosomal peut avoir des conséquences graves dans les motoneurones avec de longs axones, comme rapporté dans HSP. Des mutations dans AP4B1 et KIAA0415 sont liées à des perturbations dans la formation des vésicules et le trafic membranaire, y compris l'absorption sélective de protéines dans les vésicules. Les deux gènes codent pour des protéines qui interagissent avec plusieurs autres protéines et perturbent les voies de sécrétion et d'endocytose.
Fonction mitochondriale
Les dysfonctionnements mitochondriaux ont été liés à des troubles neurologiques du développement et dégénératifs. Seuls quelques gènes HSP codent pour des protéines mitochondriales. Deux protéines résidentes mitochondriales sont mutées dans la HSP : la paraplégine et la chaperonine 60. La paraplégine est une métalloprotéase m-AAA de la membrane mitochondriale interne. Il fonctionne dans l'assemblage ribosomique et le contrôle de la qualité des protéines. L'activité altérée de la chaperonine 60 entraîne une altération du contrôle de la qualité mitochondriale. Deux gènes DDHD1 et CYP2U1 ont montré une altération de l'architecture mitochondriale dans les fibroblastes des patients. Ces gènes codent pour des enzymes impliquées dans le métabolisme des acides gras.
Diagnostic
Le diagnostic initial des HSP repose sur les antécédents familiaux, la présence ou l'absence de signes supplémentaires et l'exclusion d'autres causes non génétiques de spasticité, ces dernières étant particulièrement importantes dans les cas sporadiques.
L' IRM cérébrale et rachidienne est une procédure importante réalisée afin d'exclure d'autres affections neurologiques fréquentes, telles que la sclérose en plaques , mais également pour détecter des anomalies associées telles que l' atrophie cérébelleuse ou du corps calleux ainsi que des anomalies de la substance blanche . Le diagnostic différentiel de la HSP devrait également exclure la diplégie spastique qui se présente avec des effets quotidiens presque identiques et peut même être traitée avec des médicaments similaires tels que le baclofène et la chirurgie orthopédique ; parfois, ces deux conditions peuvent sembler si similaires que la seule différence perçue peut être la nature héréditaire de la HSP par rapport à la nature explicitement non héréditaire de la diplégie spastique (cependant, contrairement à la diplégie spastique et à d'autres formes de paralysie cérébrale spastique , la HSP ne peut pas être fiable traités par rhizotomie dorsale sélective ).
La confirmation ultime du diagnostic de HSP ne peut être fournie qu'en effectuant des tests génétiques ciblés sur des mutations génétiques connues .
Classification
Les paraplégies spastiques héréditaires peuvent être classées en fonction des symptômes ; mode d'héritage; l'âge du patient au début ; les gènes affectés ; et les voies biochimiques impliquées.
Traitement
Aucun traitement spécifique n'est connu qui empêcherait, ralentirait ou inverserait la HSP. Les thérapies disponibles consistent principalement en une prise en charge médicale symptomatique et en favorisant le bien-être physique et émotionnel. Les thérapies proposées aux patients HSP comprennent :
- Baclofène – un relaxant musculaire volontaire pour détendre les muscles et réduire le tonus. Celui-ci peut être administré par voie orale ou intrathécale. (Etudes en HSP)
- Tizanidine – pour traiter les spasmes nocturnes ou intermittents (études disponibles)
- Diazépam et clonazépam – pour diminuer l'intensité des spasmes
- Chlorure d'oxybutynine - un relaxant musculaire involontaire et un agent spasmolytique, utilisé pour réduire la spasticité de la vessie chez les patients ayant des problèmes de contrôle de la vessie
- Tartrate de toltérodine – un relaxant musculaire involontaire et un agent spasmolytique, utilisé pour réduire la spasticité de la vessie chez les patients ayant des problèmes de contrôle de la vessie
- Cro System – pour réduire l'hyperactivité musculaire (études existantes pour la spasticité)
- Toxine botulique - pour réduire l'hyperactivité musculaire (études existantes pour les patients HSP)
- Antidépresseurs (tels que les inhibiteurs sélectifs de la recapture de la sérotonine, les antidépresseurs tricycliques et les inhibiteurs de la monoamine oxydase) – pour les patients souffrant de dépression clinique
- Physiothérapie - pour restaurer et maintenir la capacité de se déplacer; réduire le tonus musculaire; maintenir ou améliorer l'amplitude des mouvements et la mobilité ; augmenter la force et la coordination; pour prévenir les complications, telles que les articulations gelées, les contractures ou les escarres.
Pronostic
Bien que la HSP soit une maladie évolutive, le pronostic des personnes atteintes de HSP varie considérablement. Elle affecte principalement les jambes, bien qu'il puisse y avoir une certaine atteinte du haut du corps chez certaines personnes. Certains cas sont gravement invalidants tandis que d'autres sont moins invalidants et sont compatibles avec une vie productive et bien remplie. La majorité des personnes atteintes de HSP ont une espérance de vie normale .
Épidémiologie
Dans le monde, la prévalence de toutes les paraplégies spastiques héréditaires combinées est estimée à 2 à 6 sur 100 000 personnes. Une étude norvégienne de plus de 2,5 millions de personnes publiée en mars 2009 a trouvé un taux de prévalence HSP de 7,4/100 000 de la population - un taux plus élevé, mais dans la même fourchette que les études précédentes. Aucune différence de taux liée au sexe n'a été trouvée et l'âge moyen au début était de 24 ans. Aux États-Unis , la paraplégie spastique héréditaire est répertoriée comme une « maladie rare » par l'Office of Rare Diseases (ORD) des National Institutes of Health, ce qui signifie que la maladie affecte moins de 200 000 personnes dans la population américaine.
Les références
Lectures complémentaires
- Entrée GeneReviews/NCBI/NIH/UW sur la paraplégie spastique 3A
- Entrée GeneReviews/NCBI/NIH/UW sur la paraplégie spastique héréditaire
- Warner, Tom (janvier-février 2007). « Paraplégie spastique héréditaire » (PDF) . Avancées en neurosciences cliniques et en réadaptation . 6 (6) : 16-17.
Liens externes
| Classification | |
|---|---|
| Ressources externes |