Hydrure - Hydride
En chimie , un hydrure est formellement l' anion d' un atome d' hydrogène , H - . Le terme est appliqué vaguement. À un extrême, tous les composés contenant des atomes H liés de manière covalente sont appelés hydrures : l' eau (H 2 O) est un hydrure d' oxygène , l' ammoniac est un hydrure d' azote , etc. Pour les chimistes inorganiques, les hydrures désignent des composés et des ions dans lesquels l'hydrogène est attaché de manière covalente à un élément moins électronégatif . Dans de tels cas, le centre H a un caractère nucléophile, qui contraste avec le caractère protique des acides. L'anion hydrure est très rarement observé.
Presque tous les éléments forment des composés binaires avec l'hydrogène , les exceptions étant He , Ne , Ar , Kr , Pm , Os , Ir , Rn , Fr et Ra . Des molécules exotiques telles que l'hydrure de positronium ont également été fabriquées.
Obligations
Les liaisons entre l'hydrogène et les autres éléments varient de fortement à quelque peu covalentes. Certains hydrures, par exemple les hydrures de bore , ne sont pas conformes aux règles classiques de comptage d'électrons et la liaison est décrite en termes de liaisons multicentriques, alors que les hydrures interstitiels impliquent souvent une liaison métallique . Les hydrures peuvent être des molécules discrètes , des oligomères ou des polymères , des solides ioniques , des monocouches chimisorbées , des métaux en vrac (interstitiels) ou d'autres matériaux. Alors que les hydrures réagissent traditionnellement comme des bases de Lewis ou des agents réducteurs , certains hydrures métalliques se comportent comme des donneurs d'atomes d'hydrogène et agissent comme des acides.
Applications

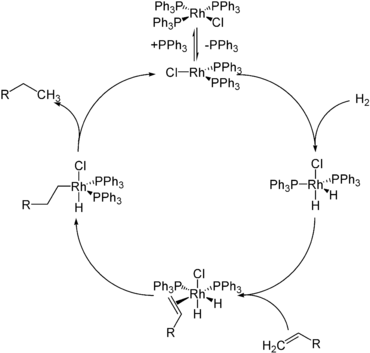
- Les hydrures tels que le borohydrure de sodium , l'hydrure de lithium et d'aluminium , l'hydrure de diisobutylaluminium (DIBAL) et le superhydrure , sont couramment utilisés comme agents réducteurs en synthèse chimique . L'hydrure s'ajoute à un centre électrophile, typiquement du carbone insaturé.
- Les hydrures tels que l'hydrure de sodium et l'hydrure de potassium sont utilisés comme bases fortes en synthèse organique . Les hydrures réagit avec les faibles acide de Bronsted libérant H 2 .
- Les hydrures tels que l'hydrure de calcium sont utilisés comme dessicants , c'est-à-dire des agents de séchage, pour éliminer les traces d'eau des solvants organiques. L'hydrure réagit avec l'eau en formant de l' hydrogène et un sel d' hydroxyde . Le solvant sec peut ensuite être distillé ou transféré sous vide du "pot de solvant".
- Les hydrures sont importants dans les technologies de batteries de stockage telles que les batteries nickel-hydrure métallique . Divers hydrures métalliques ont été examinés pour une utilisation comme moyen de stockage d'hydrogène pour les voitures électriques à pile à combustible et d'autres aspects visés d'une économie de l'hydrogène .
- Les complexes d'hydrure sont des catalyseurs et des intermédiaires catalytiques dans une variété de cycles catalytiques homogènes et hétérogènes. Des exemples importants comprennent l' hydrogénation , l' hydroformylation , l' hydrosilylation , les catalyseurs d' hydrodésulfuration . Même certaines enzymes, l' hydrogénase , fonctionnent via des intermédiaires hydrures. Le vecteur d'énergie nicotinamide adénine dinucléotide réagit en tant que donneur d'hydrure ou équivalent d'hydrure.
Ion hydrure
Les anions hydrure libres n'existent que dans des conditions extrêmes et ne sont pas invoqués pour une solution homogène. Au lieu de cela, de nombreux composés ont des centres d'hydrogène à caractère hydrique.
Hormis l' électride , l'ion hydrure est l' anion le plus simple possible , composé de deux électrons et d'un proton . L'hydrogène a une affinité électronique relativement faible , 72,77 kJ/mol et réagit de manière exothermique avec les protons en tant que base de Lewis puissante .
La faible affinité électronique de l'hydrogène et la force de la liaison H-H (Δ H BE = 436 kJ/mol) signifient que l'ion hydrure serait également un agent réducteur puissant
Types d'hydrures
Selon la définition générale, chaque élément du tableau périodique (à l'exception de certains gaz rares ) forme un ou plusieurs hydrures. Ces substances ont été classées en trois types principaux selon la nature de leur liaison :
- Les hydrures ioniques , qui ont un caractère de liaison ionique important .
- Les hydrures covalents , qui comprennent les hydrocarbures et de nombreux autres composés qui se lient de manière covalente aux atomes d'hydrogène.
- Hydrures interstitiels , qui peuvent être décrits comme ayant une liaison métallique .
Bien que ces divisions n'aient pas été utilisées universellement, elles sont toujours utiles pour comprendre les différences dans les hydrures.
hydrures ioniques
Ce sont des composés stoechiométriques de l'hydrogène. Les hydrures ioniques ou salins sont composés d'hydrure lié à un métal électropositif, généralement un métal alcalin ou alcalino-terreux . Les lanthanides divalents tels que l' europium et l' ytterbium forment des composés similaires à ceux des métaux alcalino-terreux plus lourds. Dans ces matériaux, l'hydrure est considéré comme un pseudohalogénure . Les hydrures salins sont insolubles dans les solvants conventionnels, reflétant leurs structures non moléculaires. Les hydrures ioniques sont utilisés comme bases et, occasionnellement, comme réactifs réducteurs en synthèse organique .
- C 6 H 5 C(O)CH 3 + KH → C 6 H 5 C(O)CH 2 K + H 2
Les solvants typiques pour de telles réactions sont les éthers . L'eau et d'autres solvants protiques ne peuvent pas servir de milieu pour les hydrures ioniques car l'ion hydrure est une base plus forte que l' hydroxyde et la plupart des anions hydroxyle . De l'hydrogène gazeux est libéré dans une réaction acide-base typique.
Souvent, les hydrures de métaux alcalins réagissent avec les halogénures de métaux. L'hydrure de lithium et d'aluminium (souvent abrégé en LAH) résulte des réactions de l'hydrure de lithium avec le chlorure d'aluminium .
- 4 LiH + AlCl 3 → LiAlH 4 + 3 LiCl
hydrures covalents
Selon certaines définitions, les hydrures covalents couvrent tous les autres composés contenant de l'hydrogène. Certaines définitions limitent les hydrures aux centres d'hydrogène qui réagissent formellement comme des hydrures, c'est-à-dire sont nucléophiles, et les atomes d'hydrogène liés aux centres métalliques. Ces hydrures sont formés par tous les vrais non-métaux (à l'exception des éléments du groupe zéro) et les éléments comme Al, Ga, Sn, Pb, Bi, Po, etc., qui sont normalement de nature métallique, c'est-à-dire que cette classe comprend les hydrures des éléments du bloc p. Dans ces substances, la liaison hydrure est formellement une liaison covalente tout comme la liaison faite par un proton dans un acide faible . Cette catégorie comprend les hydrures qui existent sous forme de molécules discrètes, de polymères ou d'oligomères, et l'hydrogène qui a été chimiquement adsorbé sur une surface. Un segment particulièrement important des hydrures covalents sont les hydrures métalliques complexes , de puissants hydrures solubles couramment utilisés dans les procédures de synthèse.
Les hydrures moléculaires impliquent souvent des ligands supplémentaires ; par exemple, l'hydrure de diisobutylaluminium (DIBAL) est constitué de deux centres d'aluminium pontés par des ligands hydrures. Les hydrures solubles dans les solvants courants sont largement utilisés en synthèse organique. Sont particulièrement fréquents du borohydrure de sodium (NaBH 4 ) et de l' hydrure de lithium - aluminium et à encombrement stérique réactifs tels que le DIBAL.
Hydrures interstitiels ou hydrures métalliques
Les hydrures interstitiels existent le plus souvent dans les métaux ou les alliages. Ils sont traditionnellement appelés « composés » même s'ils ne sont pas strictement conformes à la définition d'un composé, ressemblant plus étroitement à des alliages courants tels que l'acier. Dans de tels hydrures, l'hydrogène peut exister sous forme d'entités atomiques ou diatomiques. Un traitement mécanique ou thermique, tel qu'un pliage, un amorçage ou un recuit, peut entraîner la précipitation de l'hydrogène hors de la solution par dégazage. Leur liaison est généralement considérée comme métallique . De tels métaux de transition en vrac forment des hydrures binaires interstitiels lorsqu'ils sont exposés à l'hydrogène. Ces systèmes sont généralement non stoechiométriques , avec des quantités variables d'atomes d'hydrogène dans le réseau. En génie des matériaux, le phénomène de fragilisation par l'hydrogène résulte de la formation d'hydrures interstitiels. Les hydrures de ce type se forment selon l'un ou l'autre de deux mécanismes principaux. Le premier mécanisme implique l'adsorption du dihydrogène, suivie par le clivage de la liaison HH, la délocalisation des électrons de l'hydrogène, et enfin la diffusion des protons dans le réseau métallique. L'autre mécanisme principal implique la réduction électrolytique de l'hydrogène ionisé à la surface du réseau métallique, également suivie de la diffusion des protons dans le réseau. Le second mécanisme est responsable de l'expansion volumique temporaire observée de certaines électrodes utilisées dans les expériences électrolytiques.
Le palladium absorbe jusqu'à 900 fois son propre volume d'hydrogène à température ambiante, formant de l'hydrure de palladium . Ce matériau a été discuté comme un moyen de transporter de l'hydrogène pour les piles à combustible de véhicules . Les hydrures interstitiels sont prometteurs en tant que moyen de stockage sûr de l' hydrogène . Des études de diffraction des neutrons ont montré que les atomes d'hydrogène occupent aléatoirement les interstices octaédriques dans le réseau métallique (dans un réseau fcc, il y a un trou octaédrique par atome métallique). La limite d'absorption aux pressions normales est PdH0,7, indiquant qu'environ 70 % des trous octaédriques sont occupés.
De nombreux hydrures interstitiels ont été développés qui absorbent et déchargent facilement de l'hydrogène à température ambiante et à pression atmosphérique. Ils sont généralement à base de composés intermétalliques et d'alliages solides-solutions. Cependant, leur application est encore limitée, car ils ne sont capables de stocker qu'environ 2 % en poids d'hydrogène, ce qui est insuffisant pour les applications automobiles.
Complexes d'hydrures de métaux de transition
Les hydrures de métaux de transition comprennent des composés qui peuvent être classés comme des hydrures covalents . Certains sont même classés comme hydrures interstitiels et d'autres hydrures pontants. L'hydrure de métal de transition classique présente une liaison simple entre le centre d'hydrogène et le métal de transition. Certains hydrures de métaux de transition sont acides, par exemple HCo(CO) 4 et H 2 Fe(CO) 4 . Les anions [ReH 9 ] 2− et [FeH 6 ] 4− sont des exemples de la collection croissante d' hydrures métalliques homoleptiques moléculaires connus . En tant que pseudohalogénures , les ligands hydrures sont capables de se lier à des centres d'hydrogène polarisés positivement. Cette interaction, appelée liaison dihydrogène , est similaire à la liaison hydrogène , qui existe entre des protons polarisés positivement et des atomes électronégatifs avec des paires isolées ouvertes.
Deutérides
Les hydrures contenant du deutérium sont appelés deutérides . Certains deutérides, tels que le LiD , sont des combustibles de fusion importants dans les armes thermonucléaires et des modérateurs utiles dans les réacteurs nucléaires .
Composés anioniques mixtes
Il existe des composés anioniques mixtes qui contiennent de l'hydrure avec d'autres anions. Ceux-ci comprennent les hydrures de borure, les carbohydrures , les hydridonitrures , les oxyhydrures et autres.
Annexe sur la nomenclature
Protide , deuteride et tritiure sont utilisés pour décrire des ions ou des composés qui contiennent enrichi en hydrogène 1 , le deutérium ou le tritium , respectivement.
Au sens classique, l'hydrure fait référence à toute forme d'hydrogène composé avec d'autres éléments, allant des groupes 1 à 16 (les composés binaires de l'hydrogène ). Ce qui suit est une liste de la nomenclature pour les dérivés d'hydrure des composés du groupe principal selon cette définition :
- métaux alcalins et alcalino-terreux : hydrure métallique
- bore : borane , BH 3
- aluminium : alumine , AlH 3
- gallium : gallane , GaH 3
- indium : indigane , InH 3
- thallium : thallane , TlH 3
- carbone : alcanes , alcènes , alcynes et tous les hydrocarbures
- silicium : silane
- germanium : germane
- étain : stannane
- plomb : plombier
- azote : ammoniac ("azane" lorsqu'il est substitué ), hydrazine
- phosphore : phosphine (noter "phosphane" est le nom recommandé par l' IUPAC )
- arsenic : arsine (noter "arsane" est le nom recommandé par l' IUPAC )
- antimoine : stibine (noter "stibane" est le nom recommandé par l' IUPAC )
- bismuth : bismuthine (notez que "bismuthane" est le nom recommandé par l' IUPAC )
- hélium : hydrure d'hélium (n'existe que sous forme d'ion)
Selon la convention ci-dessus, les éléments suivants sont des « composés d'hydrogène » et non des « hydrures » :
- oxygène : eau ("oxidane" lorsqu'il est substitué ; synonyme : hydrure d'oxygène), peroxyde d'hydrogène
- soufre : sulfure d'hydrogène ("sulfane" lorsqu'il est substitué) synonyme : hydrure de soufre
- sélénium : hydrogène séléniure ("selane" lorsqu'il est substitué)
- tellure : tellurure d'hydrogène ("tellane" lorsqu'il est substitué)
- polonium : hydrogénopolonide ("polane" lorsqu'il est substitué)
- halogènes : halogénures d'hydrogène
Exemples:
- hydrure de nickel : utilisé dans les batteries NiMH
- hydrure de palladium : électrodes dans les expériences de fusion froide
- hydrure de lithium et d'aluminium : un puissant réducteur utilisé en chimie organique
- borohydrure de sodium : réducteur de spécialité sélective, stockage d'hydrogène dans des piles à combustible
- l'hydrure de sodium : une base puissante utilisée en chimie organique
- diborane : agent réducteur, carburant de fusée, dopant semi-conducteur, catalyseur, utilisé en synthèse organique ; aussi borane , pentaborane et décaborane
- arsine : utilisé pour le dopage des semi-conducteurs
- stibine : utilisé dans l' industrie des semi-conducteurs
- phosphine : utilisé pour la fumigation
- silane : nombreuses utilisations industrielles, par exemple fabrication de matériaux composites et hydrofuges
- ammoniac : liquide de refroidissement , carburant , engrais , de nombreuses autres utilisations industrielles
- sulfure d'hydrogène : composant du gaz naturel , source importante de soufre
- Chimiquement, même l' eau et les hydrocarbures pourraient être considérés comme des hydrures.
Tous les hydrures métalloïdes sont hautement inflammables. Tous les hydrures solides non métalliques, à l'exception de la glace, sont hautement inflammables. Mais lorsque l'hydrogène se combine avec des halogènes, il produit des acides plutôt que des hydrures, et ils ne sont pas inflammables.
Convention de préséance
Selon la convention IUPAC , par priorité (électronégativité stylisée), l'hydrogène se situe entre les éléments du groupe 15 et du groupe 16 . Par conséquent, nous avons NH 3 , « hydrure d'azote » (ammoniac), versus H 2 O, « oxyde d'hydrogène » (eau). Cette convention est parfois rompue pour le polonium, qui en raison de la métallicité du polonium est souvent appelé « hydrure de polonium » au lieu du « polonide d'hydrogène » attendu.
Voir également
- hydrure parent
- Hydrone (cation hydrogène)
- Hydronium
- Proton
- Ion hydrogène
- Compresseur à hydrure
- Superhydrures
Les références
Bibliographie
WM Mueller, JP Blackledge, GG Libowitz, Metal Hydrides , Academic Press, NY et Londres, (1968)
Liens externes
-
 Médias liés aux hydrures sur Wikimedia Commons
Médias liés aux hydrures sur Wikimedia Commons


