Réaction d'hydroboration-oxydation - Hydroboration–oxidation reaction
La réaction d'hydroboration-oxydation est une réaction d'hydratation en deux étapes qui convertit un alcène en un alcool . Le processus aboutit à l' addition syn d'un hydrogène et d'un groupe hydroxyle là où se trouvait la double liaison . L'hydroboration-oxydation est une réaction anti-Markovnikov , le groupe hydroxyle se fixant au carbone le moins substitué. La réaction fournit ainsi une alternative régiochimique plus stéréospécifique et complémentaire à d'autres réactions d'hydratation telles que l' addition catalysée par un acide et le processus d' oxymercuration-réduction . La réaction a été signalée pour la première fois par Herbert C. Brown à la fin des années 1950 et elle a été reconnue lorsqu'il a reçu le prix Nobel de chimie en 1979.
La forme générale de la réaction est la suivante :
Le tétrahydrofurane (THF) est le solvant archétypal utilisé pour l'hydroboration.
Mécanisme et portée
Étape d'hydroboration
Dans la première étape, le borane (BH 3 ) s'ajoute à la double liaison , transférant l'un des atomes d'hydrogène au carbone adjacent à celui qui se lie au bore . Cette hydroboration est répétée deux fois supplémentaires, faisant réagir successivement chaque liaison B-H de sorte que trois alcènes s'ajoutent à chaque BH 3 . Le trialkylborane résultant est traité avec du peroxyde d'hydrogène dans la deuxième étape. Ce processus remplace les liaisons BC par des liaisons HO-C. Le réactif au bore est converti en acide borique . La réaction a été initialement décrite par HC Brown en 1957 pour la conversion du 1-hexène en 1-hexanol .
Sachant que le groupe contenant le bore sera remplacé par un groupe hydroxyle, on voit que l'étape d'hydroboration initiale détermine la régiosélectivité. L'hydroboration se déroule de manière anti-Markovnikov . La séquence réactionnelle est également stéréospécifique , donnant une addition syn (sur la même face de l'alcène) : l'hydroboration est syn-sélective et l'oxydation remplace le bore par un hydroxyle ayant la même position géométrique. Ainsi, le 1-méthylcyclopentène réagit avec le diborane principalement pour donner du trans -1-hydroxy-2-méthylcyclopentane - les nouveaux H et OH ajoutés sont cis l'un par rapport à l'autre.
Jusqu'à ce que tous les hydrogènes attachés au bore aient été transférés, le groupe bore BH 2 continuera à s'ajouter à plus d'alcènes. Cela signifie qu'une mole d'hydroborane subira la réaction avec trois moles d'alcène. De plus, il n'est pas nécessaire que l'hydroborane ait plus d'un hydrogène. Par exemple, des réactifs de type R 2 BH sont couramment utilisés, où R can représente le reste de la molécule. De tels réactifs d'hydroboration modifiés comprennent le 9-BBN , le catécholborane et le disiamylborane .
Étape d'oxydation
Dans la deuxième étape de la séquence réactionnelle, l' anion hydroperoxyde nucléophile attaque l'atome de bore. La migration des alkyles vers l'oxygène donne l'alkyl borane avec maintien de la stéréochimie (en réalité, la réaction se fait via le trialkyl borate B(OR) 3 , plutôt que l'ester monoalkyl borinique BH 2 OR).
L'atome « H » dans la réaction provient de B 2 H 6 , l'atome « O » provient du peroxyde d'hydrogène (H 2 O 2 ) tandis que l'atome « H » attaché à O provient du solvant (voir mécanisme).
Hydroboration alcyne
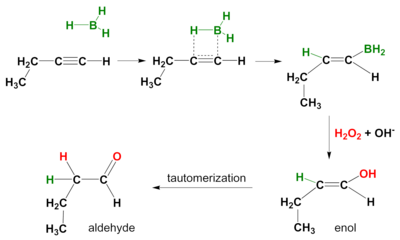
Une réaction d'hydroboration a également lieu sur les alcynes . Encore une fois, le mode d'action est syn et les produits de réaction secondaires sont des aldéhydes d'alcynes terminaux et des cétones d'alcynes internes. Afin d'empêcher l'hydroboration à travers les deux liaisons pi, un borane volumineux comme le disiamyl (di-sec-iso-amyl) borane est utilisé.
Oxydations alternatives
L'utilisation d'autres oxydants à la place du peroxyde d'hydrogène peut conduire à des produits carbonylés plutôt qu'à des alcools à partir d'alcènes. Le N- méthylmorpholine N- oxyde avec le perruthénate de tétrapropylammonium catalytique convertit l'alkylborane en un carbonyle, donc un produit cétone ou aldéhyde en fonction des autres groupes attachés à ce carbone dans l'alcène d'origine. Divers dichromates ou réactifs au chrome (VI) apparentés donnent également des cétones, mais donnent des acides carboxyliques au lieu d'aldéhydes pour les alcènes terminaux.
Les références
Liens externes
- Portail de la chimie organique. Hydroboration (y compris la littérature récente). https://www.organic-chemistry.org/namedreactions/brown-hydroboration.shtm