Hydrogénation - Hydrogenation

(1) Les réactifs s'adsorbent à la surface du catalyseur et H 2 se dissocie.
(2) Un atome H se lie à un atome C. L'autre atome de carbone est toujours attaché à la surface.
(3) Un deuxième atome C se lie à un atome H. La molécule quitte la surface.
| Type de processus | Chimique |
|---|---|
| Secteur(s) industriel(s) | L' industrie alimentaire, l' industrie pétrochimique , pharmaceutique industrie, l' industrie agricole |
| Principales technologies ou sous-processus | Divers catalyseurs de métaux de transition, technologie haute pression |
| Matières premières | Substrats insaturés et hydrogène ou donneurs d'hydrogène |
| Des produits) | Hydrocarbures saturés et dérivés |
| Inventeur | Paul Sabatier |
| Année d'invention | 1897 |
L'hydrogénation est une réaction chimique entre l' hydrogène moléculaire (H 2 ) et un autre composé ou élément, généralement en présence d'un catalyseur tel que le nickel , le palladium ou le platine . Le procédé est couramment utilisé pour réduire ou saturer les composés organiques . L'hydrogénation constitue généralement l'addition de paires d' atomes d' hydrogène à une molécule, souvent un alcène . Des catalyseurs sont nécessaires pour que la réaction soit utilisable ; l'hydrogénation non catalytique n'a lieu qu'à très haute température. L'hydrogénation réduit les doubles et triples liaisons dans les hydrocarbures .
Traiter
L'hydrogénation a trois composants, le substrat insaturé , l'hydrogène (ou source d'hydrogène) et, invariablement, un catalyseur. La réaction de réduction est effectuée à différentes températures et pressions en fonction du substrat et de l'activité du catalyseur.
Réactions connexes ou concurrentes
Les mêmes catalyseurs et conditions qui sont utilisés pour les réactions d'hydrogénation peuvent également conduire à l' isomérisation des alcènes de cis à trans . Ce procédé est d'un grand intérêt car la technologie d'hydrogénation génère la plupart des graisses trans dans les aliments (voir § Industrie alimentaire ci-dessous). Une réaction où les liaisons sont rompues tandis que l'hydrogène est ajouté s'appelle l' hydrogénolyse , une réaction qui peut se produire aux liaisons carbone-carbone et carbone-hétéroatome ( oxygène , azote ou halogène ). Certaines hydrogénations de liaisons polaires s'accompagnent d'hydrogénolyse.
Sources d'hydrogène
Pour l' hydrogénation, la source d'hydrogène est évident H 2 elle-même gaz, qui est généralement disponible dans le commerce à l'intérieur du support de stockage d'un cylindre sous pression. Le procédé d'hydrogénation utilise souvent supérieure à une atmosphère de H 2 , transportée habituellement des cylindres et parfois augmentée par « pompe booster ». L'hydrogène gazeux est produit industriellement à partir d'hydrocarbures par le procédé connu sous le nom de reformage à la vapeur . Pour de nombreuses applications, l'hydrogène est transféré à partir de molécules donneuses telles que l'acide formique, l'isopropanol et le dihydroanthracène . Ces donneurs d'hydrogène subissent une déshydrogénation en dioxyde de carbone, acétone et anthracène respectivement . Ces procédés sont appelés hydrogénations de transfert .
Substrats
Une caractéristique importante des hydrogénations d'alcènes et d'alcynes, à la fois les versions catalysées de manière homogène et hétérogène, est que l'addition d'hydrogène se produit avec une « addition syn », l'hydrogène entrant par le côté le moins encombré. Cette réaction peut être effectuée sur une variété de groupes fonctionnels différents .
| Substrat | Produit | commentaires | Chaleur d'hydrogénation (kJ/mol) |
|---|---|---|---|
| R 2 C=CR' 2 ( alcène ) |
R 2 CHCHR' 2 (alcane) |
grande application est la production de margarine | -90 à -130 |
| RC≡CR' ( alcyne ) |
RCH 2 CH 2 R' (alcane) |
la semihydrogénation donne cis -RHC=CHR' |
-300 (pour une hydrogénation complète) |
| RCHO ( aldéhyde ) |
RCH 2 OH (alcool primaire) |
utilise souvent l' hydrogénation par transfert | -60 à -65 |
| R 2 CO ( cétone ) |
R 2 CHOH (alcool secondaire) |
utilise souvent l' hydrogénation par transfert | -60 à -65 |
| RCO 2 R' ( ester ) |
RCH 2 OH + R'OH (deux alcools) |
s'applique souvent à la production d' alcools gras | −25 à −105 |
| RCO 2 H ( acide carboxylique ) |
RCH 2 OH (alcool primaire) |
applicable aux alcools gras | −25 à −75 |
| RNO 2 ( nitro ) |
RNH 2 (amine) |
application principale est l' aniline | -550 |
Catalyseurs
À de rares exceptions près, H 2 n'est pas réactif vis-à-vis des composés organiques en l'absence de catalyseurs métalliques. Le substrat insaturé est chimisorbé sur le catalyseur, la plupart des sites étant recouverts par le substrat. Dans les catalyseurs hétérogènes, l'hydrogène forme des hydrures de surface (MH) à partir desquels les hydrogènes peuvent être transférés vers le substrat chimisorbé. Le platine , le palladium , le rhodium et le ruthénium forment des catalyseurs hautement actifs, qui fonctionnent à des températures plus basses et à des pressions plus basses de H 2 . Des catalyseurs de métaux non précieux, en particulier ceux à base de nickel (tels que le nickel de Raney et le nickel d'Urushibara ) ont également été développés comme alternatives économiques, mais ils sont souvent plus lents ou nécessitent des températures plus élevées. Le compromis est l'activité (vitesse de réaction) par rapport au coût du catalyseur et au coût de l'appareil requis pour l'utilisation de hautes pressions. Notez que les hydrogénations catalysées par Raney-nickel nécessitent des pressions élevées :
Les catalyseurs sont généralement classés en deux grandes classes : les catalyseurs homogènes et les catalyseurs hétérogènes . Les catalyseurs homogènes se dissolvent dans le solvant qui contient le substrat insaturé. Les catalyseurs hétérogènes sont des solides qui sont en suspension dans le même solvant que le substrat ou qui sont traités avec un substrat gazeux.
Catalyseurs homogènes
Certains catalyseurs homogènes bien connus sont indiqués ci-dessous. Ce sont des complexes de coordination qui activent à la fois le substrat insaturé et le H 2 . Le plus souvent, ces complexes contiennent des métaux du groupe du platine, en particulier Rh et Ir.
- Catalyseurs d'hydrogénation homogènes et leurs précurseurs
Le dichlorotris(triphénylphosphine)ruthénium(II) est un précatalyseur à base de ruthénium.
Le catalyseur de Crabtree est un catalyseur hautement actif contenant de l'iridium.
Rh 2 Cl 2 (cod) 2 est un précurseur de nombreux catalyseurs homogènes.
(S)-iPr-PHOX est un ligand phosphine chélateur typique utilisé dans l'hydrogénation asymétrique.
Des catalyseurs homogènes sont également utilisés en synthèse asymétrique par hydrogénation de substrats prochiraux. Une première démonstration de cette approche a été l'hydrogénation catalysée par Rh des énamides en tant que précurseurs du médicament L-DOPA. Pour obtenir une réduction asymétrique, ces catalyseurs sont rendus chiraux à l'aide de ligands diphosphines chiraux. L'hydrogénation catalysée par le rhodium a également été utilisée dans la production d'herbicides de S-métolachlore, qui utilise un ligand de type Josiphos (appelé Xyliphos). En principe, l'hydrogénation asymétrique peut être catalysée par des catalyseurs hétérogènes chiraux, mais cette approche reste plus une curiosité qu'une technologie utile.
Catalyseurs hétérogènes
Les catalyseurs hétérogènes pour l'hydrogénation sont plus courants dans l'industrie. Dans l'industrie, les catalyseurs d'hydrogénation de métaux précieux sont déposés à partir d'une solution sous forme de poudre fine sur le support, qui est un matériau bon marché, volumineux, poreux, généralement granulaire, tel que le charbon actif , l' alumine , le carbonate de calcium ou le sulfate de baryum . Par exemple, le platine sur carbone est produit par réduction d' acide chloroplatinique in situ dans du carbone. Des exemples de ces catalyseurs sont 5% de ruthénium sur charbon actif , ou 1% de platine sur alumine . Les catalyseurs de métaux de base, tels que le nickel de Raney , sont généralement beaucoup moins chers et n'ont pas besoin de support. De plus, en laboratoire, des catalyseurs de métaux précieux non supportés (massifs) tels que le noir de platine sont encore utilisés, malgré leur coût.
Comme dans les catalyseurs homogènes, l'activité est ajustée par des changements dans l'environnement autour du métal, c'est-à-dire la sphère de coordination . Différentes faces d'un catalyseur hétérogène cristallin présentent par exemple des activités distinctes. Cela peut être modifié en mélangeant des métaux ou en utilisant différentes techniques de préparation. De même, les catalyseurs hétérogènes sont affectés par leurs supports.
Dans de nombreux cas, des modifications hautement empiriques impliquent des « poisons » sélectifs. Ainsi, un catalyseur soigneusement choisi peut être utilisé pour hydrogéner certains groupes fonctionnels sans en affecter d'autres, comme l'hydrogénation d'alcènes sans toucher les cycles aromatiques, ou l'hydrogénation sélective d' alcynes en alcènes à l'aide du catalyseur de Lindlar . Par exemple, lorsque le catalyseur palladium est placé sur du sulfate de baryum puis traité avec de la quinoléine , le catalyseur résultant réduit les alcynes uniquement jusqu'aux alcènes. Le catalyseur de Lindlar a été appliqué à la conversion du phénylacétylène en styrène .
- Hydrogénations illustratives
Hydrogénation sélective du groupe alcène le moins encombré dans la carvone à l' aide d'un catalyseur homogène (catalyseur de Wilkinson ).
Hydrogénation partielle du phénylacétylène à l'aide du catalyseur de Lindlar .
Hydrogénation d'une imine à l'aide d'un catalyseur au nickel de Raney , un catalyseur hétérogène populaire.
Hydrogénation partielle d'un dérivé du résorcinol à l' aide d'un catalyseur Raney-Nickel.
L' hydrogénation de l' acide maléique à l' acide succinique .
Transfert d'hydrogénation

L'hydrogénation par transfert utilise d'autres molécules donneuses d'hydrogène à la place de H 2 lui-même. Ces réactifs, qui peuvent également servir de solvants pour la réaction, comprennent l' hydrazine , le dihydronaphtalène , le dihydroanthracène, l' isopropanol et l'acide formique . La réaction implique un mécanisme de sphère externe .
En synthèse organique , l' hydrogénation par transfert est utile pour la réduction asymétrique de substrats polaires insaturés , tels que les cétones , les aldéhydes et les imines . L'hydrogénation de substrats polaires tels que les cétones et les aldéhydes nécessite généralement une hydrogénation par transfert, au moins des réactions qui utilisent des catalyseurs homogènes . Ces catalyseurs sont facilement générés sous des formes chirales, qui sont à la base de l'hydrogénation asymétrique des cétones.
Hydrogénation électrolytique
Les substrats polaires tels que les nitriles peuvent être hydrogénés électrochimiquement , en utilisant des solvants protiques et des équivalents réducteurs comme source d'hydrogène.
Thermodynamique et mécanisme
L'ajout d'hydrogène aux doubles ou triples liaisons dans les hydrocarbures est un type de réaction redox qui peut être thermodynamiquement favorable. Par exemple, l'ajout d'hydrogène à l'éthène a un changement d' énergie libre de Gibbs de -101 kJ·mol -1 , ce qui est hautement exothermique . Dans l'hydrogénation d'huiles végétales et d'acides gras, par exemple, la chaleur dégagée, environ 25 kcal par mole (105 kJ/mol), est suffisante pour élever la température de l'huile de 1,6 à 1,7 °C par baisse d' indice d'iode .
Cependant, la vitesse de réaction pour la plupart des réactions d'hydrogénation est négligeable en l'absence de catalyseurs. Le mécanisme de l'hydrogénation catalysée par un métal des alcènes et des alcynes a été largement étudié. Tout d' abord marquage isotopique utilisant deuterium confirme la régiosélectivité de l'addition:
- RCH=CH 2 + D 2 → RCHDCH 2 D
Catalyse hétérogène
Sur les solides, le mécanisme accepté est le mécanisme de Horiuti- Polanyi :
- Liaison de la liaison insaturée
- Dissociation de H 2 sur le catalyseur
- Ajout d'un atome d'hydrogène; cette étape est réversible
- Ajout du deuxième atome; effectivement irréversible.
Dans la troisième étape, le groupe alkyle peut redevenir alcène, qui peut se détacher du catalyseur. Par conséquent, le contact avec un catalyseur d'hydrogénation permet une isomérisation cis-trans . Le trans- alcène peut se réassocier à la surface et subir une hydrogénation. Ces détails sont révélés en partie à l'aide de D2 (deutérium), car les alcènes récupérés contiennent souvent du deutérium.
Pour les substrats aromatiques, la première hydrogénation est la plus lente. Le produit de cette étape est un cyclohexadiène, qui s'hydrogéne rapidement et est rarement détecté. De même, le cyclohexène est ordinairement réduit en cyclohexane.
Catalyse homogène
Dans de nombreux procédés d'hydrogénation homogène, le métal se lie aux deux composants pour donner un complexe intermédiaire alcène-métal (H) 2 . La séquence générale des réactions est supposée être la suivante ou une séquence d'étapes connexes :
- liaison de l'hydrogène pour donner un complexe dihydrure par addition oxydante (précédant l'addition oxydante de H 2 est la formation d'un complexe dihydrogène ) :
- L n M + H 2 → L n MH 2
- liaison de l'alcène :
- L n M(η 2 H 2 ) + CH 2 =CHR → L n-1 MH 2 (CH 2 =CHR) + L
- transfert d'un atome d'hydrogène du métal au carbone (insertion migratoire)
- L n-1 MH 2 (CH 2 =CHR) → L n-1 M(H)(CH 2 -CH 2 R)
- transfert du deuxième atome d'hydrogène du métal au groupe alkyle avec dissociation simultanée de l'alcane ("élimination réductrice")
- L n-1 M(H)(CH 2 -CH 2 R) → L n-1 M + CH 3 -CH 2 R
Substrats inorganiques
L'hydrogénation de l'azote pour donner de l'ammoniac est réalisée à grande échelle par le procédé Haber-Bosch , consommant environ 1% de l' approvisionnement énergétique mondial .
L'oxygène peut être partiellement hydrogéné pour donner du peroxyde d'hydrogène , bien que ce procédé n'ait pas été commercialisé. Une difficulté est d'empêcher les catalyseurs de déclencher la décomposition du peroxyde d'hydrogène pour former de l'eau.
Applications industrielles
L'hydrogénation catalytique a diverses utilisations industrielles. Le plus souvent, l'hydrogénation industrielle repose sur des catalyseurs hétérogènes.
Industrie alimentaire
L'industrie alimentaire hydrogéne les huiles végétales pour les convertir en graisses solides ou semi-solides qui peuvent être utilisées dans les pâtes à tartiner, les bonbons, les produits de boulangerie et d'autres produits comme le beurre . Les huiles végétales sont fabriquées à partir d'acides gras polyinsaturés (ayant plus d'une double liaison carbone-carbone). L'hydrogénation élimine certaines de ces doubles liaisons.
Industrie pétrochimique
Dans les procédés pétrochimiques, l'hydrogénation est utilisée pour convertir les alcènes et les aromatiques en alcanes saturés (paraffines) et cycloalcanes (naphtènes), moins toxiques et moins réactifs. Concernant les combustibles liquides qui sont parfois stockés pendant de longues périodes dans l'air, les hydrocarbures saturés présentent des propriétés de stockage supérieures. D'autre part, les alcènes ont tendance à former des hydroperoxydes , qui peuvent former des gommes qui interfèrent avec les équipements de manutention de carburant. Par exemple, la térébenthine minérale est généralement hydrogénée. L'hydrocraquage de résidus lourds en diesel est une autre application. Dans les procédés d' isomérisation et de reformage catalytique , une certaine pression d'hydrogène est maintenue pour hydrogénolyser le coke formé sur le catalyseur et empêcher son accumulation.
Chimie organique
L'hydrogénation est un moyen utile pour convertir des composés insaturés en dérivés saturés. Les substrats comprennent non seulement des alcènes et des alcynes, mais également des aldéhydes, des imines et des nitriles, qui sont convertis en composés saturés correspondants, c'est-à-dire des alcools et des amines. Ainsi, les alkylaldéhydes, qui peuvent être synthétisés avec le procédé oxo à partir de monoxyde de carbone et d'un alcène, peuvent être convertis en alcools. Par exemple, le 1-propanol est produit à partir de propionaldéhyde, produit à partir d'éthène et de monoxyde de carbone. Le xylitol , un polyol , est produit par hydrogénation du sucre xylose , un aldéhyde. Les amines primaires peuvent être synthétisées par hydrogénation de nitriles , tandis que les nitriles sont facilement synthétisés à partir de cyanure et d'un électrophile approprié. Par exemple, l'isophorone diamine, un précurseur du monomère polyuréthane isophorone diisocyanate , est produit à partir d'isophorone nitrile par une hydrogénation tandem de nitrile/amination réductrice par l'ammoniac, dans laquelle l'hydrogénation convertit à la fois le nitrile en une amine et l'imine formée à partir de l'aldéhyde et de l'ammoniac en une autre amine.
Hydrogénation du charbon
Histoire
Hydrogénation catalytique hétérogène
La première hydrogénation est celle de l' addition catalysée au platine d'hydrogène à l'oxygène dans la lampe de Döbereiner , un dispositif commercialisé dès 1823. Le chimiste français Paul Sabatier est considéré comme le père du procédé d'hydrogénation. En 1897, s'appuyant sur les travaux antérieurs de James Boyce , un chimiste américain travaillant dans la fabrication de produits de savon, il découvrit que des traces de nickel catalysaient l'addition d'hydrogène aux molécules d'hydrocarbures gazeux dans ce qui est maintenant connu sous le nom de procédé Sabatier . Pour ce travail, Sabatier a partagé le prix Nobel de chimie en 1912 . Wilhelm Normann a obtenu un brevet en Allemagne en 1902 et en Grande-Bretagne en 1903 pour l'hydrogénation d'huiles liquides, ce qui a marqué le début de ce qui est aujourd'hui une industrie mondiale. Le procédé Haber-Bosch d' importance commerciale , décrit pour la première fois en 1905, implique l'hydrogénation de l'azote. Dans le procédé Fischer-Tropsch , signalé en 1922, le monoxyde de carbone, qui est facilement dérivé du charbon, est hydrogéné en combustibles liquides.
En 1922, Voorhees et Adams ont décrit un appareil pour effectuer l'hydrogénation sous des pressions supérieures à une atmosphère. L'agitateur Parr, le premier produit à permettre l'hydrogénation à l'aide de pressions et de températures élevées, a été commercialisé en 1926 sur la base des recherches de Voorhees et Adams et reste largement utilisé. En 1924, Murray Raney a développé une forme de nickel en poudre fine, qui est largement utilisée pour catalyser des réactions d'hydrogénation telles que la conversion de nitriles en amines ou la production de margarine.
Hydrogénation catalytique homogène
Dans les années 1930, Calvin a découvert que les complexes de cuivre(II) oxydaient H 2 . Les années 1960 ont vu le développement de catalyseurs homogènes bien définis utilisant des complexes de métaux de transition, par exemple le catalyseur de Wilkinson (RhCl(PPh 3 ) 3 ). Peu de temps après, les cations Rh et Ir catalysent l'hydrogénation des alcènes et des carbonyles. Dans les années 1970, l'hydrogénation asymétrique a été démontrée dans la synthèse de L-DOPA , et les années 1990 ont vu l'invention de l' hydrogénation asymétrique de Noyori . Le développement de l'hydrogénation homogène a été influencé par les travaux commencés dans les années 1930 et 1940 sur le procédé oxo et la polymérisation Ziegler-Natta .
Hydrogénation sans métal
Pour la plupart des applications pratiques, l'hydrogénation nécessite un catalyseur métallique. L'hydrogénation peut cependant provenir de certains donneurs d'hydrogène sans catalyseurs, des exemples de donneurs d'hydrogène étant le diimide et l'isopropoxyde d'aluminium , ce dernier illustré par la réduction de Meerwein-Ponndorf-Verley . Certains systèmes catalytiques sans métal ont été étudiés dans la recherche universitaire. Un tel système pour la réduction des cétones se compose de tert- butanol et de tert-butoxyde de potassium et à des températures très élevées. La réaction décrite ci-dessous décrit l'hydrogénation de la benzophénone :
Une étude de cinétique chimique a révélé que cette réaction est de premier ordre dans les trois réactifs, suggérant un état de transition cyclique à 6 chaînons .
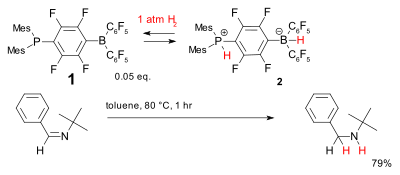
Un autre système d'hydrogénation sans métal est basé sur le composé 1 phosphine - borane , que l'on a appelé une paire de Lewis frustrée . Il accepte de manière réversible le dihydrogène à des températures relativement basses pour former le borate de phosphonium 2 qui peut réduire les imines encombrées simples .
Il a été rapporté que la réduction du nitrobenzène en aniline était catalysée par le fullerène , son mono-anion, l'hydrogène atmosphérique et la lumière UV.
Équipement utilisé pour l'hydrogénation
Le chimiste de paillasse d'aujourd'hui a trois choix principaux d'équipements d'hydrogénation :
- Hydrogénation discontinue dans des conditions atmosphériques
- Hydrogénation discontinue à température et/ou pression élevées
- Hydrogénation en flux
Hydrogénation discontinue dans des conditions atmosphériques
Forme d'hydrogénation originale et encore couramment pratiquée dans les laboratoires d'enseignement, ce processus est généralement effectué en ajoutant un catalyseur solide dans un ballon à fond rond de réactif dissous qui a été évacué à l'aide d' azote ou d' argon gazeux et en scellant le mélange avec un joint en caoutchouc pénétrable. L'hydrogène gazeux est ensuite fourni à partir d'un ballon rempli de H 2 . Le mélange triphasique résultant est agité pour favoriser le mélange. L'absorption d'hydrogène peut être surveillée, ce qui peut être utile pour surveiller la progression d'une hydrogénation. Ceci est réalisé soit en utilisant un tube gradué contenant un liquide coloré, généralement du sulfate de cuivre aqueux , soit avec des jauges pour chaque récipient de réaction.
Hydrogénation discontinue à température et/ou pression élevées
Étant donné que de nombreuses réactions d'hydrogénation telles que l' hydrogénolyse des groupes protecteurs et la réduction des systèmes aromatiques se déroulent extrêmement lentement à la température et à la pression atmosphériques, les systèmes sous pression sont populaires. Dans ces cas, le catalyseur est ajouté à une solution de réactif sous atmosphère inerte dans un récipient sous pression . L'hydrogène est ajouté directement à partir d'un cylindre ou d'une source d'hydrogène de laboratoire intégrée, et la suspension sous pression est secouée mécaniquement pour fournir l'agitation, ou un panier tournant est utilisé. Les progrès récents de la technologie de l' électrolyse ont conduit au développement de générateurs d'hydrogène à haute pression , qui génèrent de l'hydrogène jusqu'à 100 bar (1400 PSI) à partir d'eau. La chaleur peut également être utilisée, car la pression compense la réduction associée de la solubilité du gaz.
Hydrogénation en flux
L'hydrogénation en flux est devenue une technique populaire au laboratoire et de plus en plus à l'échelle du processus. Cette technique consiste à faire circuler en continu un courant dilué de réactif dissous sur un catalyseur à lit fixe en présence d'hydrogène. Utilisant la technologie HPLC établie , cette technique permet l'application de pressions allant de l'atmosphérique à 1 450 psi (100 bar). Des températures élevées peuvent également être utilisées. À l'échelle du laboratoire, les systèmes utilisent une gamme de catalyseurs pré-emballés qui élimine le besoin de peser et de filtrer les catalyseurs pyrophoriques .
Réacteurs industriels
L'hydrogénation catalytique est effectuée dans un réacteur tubulaire à écoulement piston (PFR) garni d'un catalyseur supporté. Les pressions et les températures sont généralement élevées, bien que cela dépende du catalyseur. La charge de catalyseur est généralement beaucoup plus faible que dans l'hydrogénation discontinue en laboratoire, et divers promoteurs sont ajoutés au métal, ou des métaux mélangés sont utilisés, pour améliorer l'activité, la sélectivité et la stabilité du catalyseur. L'utilisation du nickel est courante malgré sa faible activité, en raison de son faible coût par rapport aux métaux précieux.
Les réacteurs à induction gaz-liquide (hydrogénateur) sont également utilisés pour effectuer l'hydrogénation catalytique.
Voir également
Les références
Lectures complémentaires
- Jang ES, Jung MY, Min DB (2005). "Hydrogénation pour les acides gras à faible teneur en trans et à haute teneur conjuguée" (PDF) . Examens complets de la science alimentaire et de la sécurité alimentaire . 1 . Archivé de l'original (PDF) le 17/12/2008.
- exemples d'hydrogénation à partir de synthèses organiques :
- premiers travaux sur l'hydrogénation par transfert :
- Davies, RR ; Hodgson, HH (1943). "76. Réduction catalytique par l'acide formique sous pression. Partie II. Une comparaison du cuivre et du nickel comme catalyseurs". J. Chem. Soc. : 281. doi : 10.1039/jr9430000281 .
- Leggether, BE; Brown, RK (1960). "Réduction des nitrobenzènes monohalogénés avec de l'hydrazine et du nickel de Raney. Une préparation pratique d'anilines halogénées" . Pouvez. J. Chem . 38 (12) : 2363. doi : 10.1139/v60-320 .
- Kuhn, LP (1951). "Réduction catalytique à l'hydrazine". Confiture. Chem. Soc. 73 (4) : 1510. doi : 10.1021/ja01148a029 .
Liens externes
- "The Magic of Hydro" , Popular Mechanics , juin 1931, pp. 107-109 - premier article pour le grand public sur l'hydrogénation du pétrole produit dans les années 1930






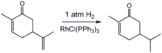
![Hydrogénation de l'azote {\displaystyle {\ce {{\underset {azote}{N{\equiv }N}}+{\underset {hydrogène \atop (200atm)}{3H2}}->[{\ce {Fe\ catalyseur}} ][350-550^{\circ }{\ce {C}}]{\underset {ammoniac}{2NH3}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2dd5645111a3ad991987a7b9e10599029c287e98)