Idébénone - Idebenone
 | |
| Donnée clinique | |
|---|---|
| Appellations commerciales | Catena, Raxone, Sovrima |
| AHFS / Drugs.com | Noms internationaux des médicaments |
| Données de licence | |
| Code ATC | |
| Statut légal | |
| Statut légal | |
| Données pharmacocinétiques | |
| Biodisponibilité | <1% ( effet de premier passage haut ) |
| Liaison protéique | > 99% |
| Demi-vie d' élimination | 18 heures |
| Excrétion | Urine (80%) et fèces |
| Identifiants | |
| |
| Numero CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Tableau de bord CompTox ( EPA ) | |
| Données chimiques et physiques | |
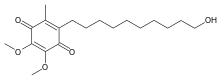
| Formule | C 19 H 30 O 5 |
| Masse molaire | 338,444 g · mol −1 |
| Modèle 3D ( JSmol ) | |
| |
| |
| (Vérifier) | |
L'idébénone (prononcé eye- deb -eh-connu, noms commerciaux Catena , Raxone , Sovrima , entre autres) est un médicament initialement développé par Takeda Pharmaceutical Company pour le traitement de la maladie d'Alzheimer et d'autres défauts cognitifs . Cela a rencontré un succès limité. La société suisse Santhera Pharmaceuticals a commencé à l'étudier pour le traitement des maladies neuromusculaires . En 2010, les premiers essais cliniques pour le traitement de l'ataxie de Friedreich et de la dystrophie musculaire de Duchenne ont été achevés. Depuis décembre 2013, le médicament n'est pas approuvé pour ces indications en Amérique du Nord ou en Europe. Il est approuvé par l' Agence européenne des médicaments (EMA) pour une utilisation dans la neuropathie optique héréditaire de Leber (LHON) et a été désigné médicament orphelin en 2007.
Chimiquement, l'idébénone est un composé organique de la famille des quinones . Il est également commercialisé en tant qu'analogue synthétique de la coenzyme Q 10 (CoQ 10 ).
Les usages
Indications qui sont ou ont été approuvées dans certains territoires
Effets nootropes et maladie d'Alzheimer
L'idébénone a amélioré l'apprentissage et la mémoire lors d'expériences sur des souris. Chez l'homme, l'évaluation des paramètres de substitution tels que l' électrorétinographie , les potentiels évoqués auditifs et les échelles analogiques visuelles a également suggéré des effets nootropes positifs , mais des études plus importantes avec des paramètres difficiles sont manquantes.
Les recherches sur l'idébénone en tant que traitement potentiel de la maladie d'Alzheimer ont été incohérentes, mais il peut y avoir une tendance à un léger avantage. En mai 1998, l'homologation de cette indication a été annulée au Japon en raison de l'absence d'effets prouvés. Dans certains pays européens, le médicament est disponible pour le traitement de patients individuels dans des cas particuliers.
Ataxie de Friedreich (Sovrima)
Des tests préliminaires ont été effectués chez l'homme et ont révélé que l'idébénone était un traitement sûr pour l'ataxie de Friedreich (AF), présentant un effet positif sur l'hypertrophie cardiaque et la fonction neurologique. Ce dernier n'était significativement amélioré que chez les jeunes patients. Dans une expérience différente, un test d'un an sur huit patients, l'idébénone a réduit le taux de détérioration de la fonction cardiaque, mais sans arrêter la progression de l' ataxie .
Le médicament a été approuvé pour l'AF au Canada en 2008 sous certaines conditions, y compris une preuve d'efficacité dans d'autres essais cliniques. Cependant, le 27 février 2013, Santé Canada a annoncé que l'idébénone serait volontairement rappelée à compter du 30 avril 2013 par son fabricant canadien, Santhera Pharmaceuticals, en raison de l'échec du médicament à démontrer son efficacité dans les autres essais cliniques qui ont été menés. En 2008, l' Agence européenne des médicaments (EMA) a refusé une autorisation de mise sur le marché pour cette indication. En 2013, le médicament n'était pas approuvé pour l'AF en Europe ni aux États-Unis, où il n'y a pas de traitement approuvé.
Neuropathie optique héréditaire de Leber (Raxone)
La neuropathie optique héréditaire de Leber (LHON) est une dégénérescence héréditaire mitochondriale (de la mère à tous les descendants) des cellules ganglionnaires rétiniennes (CGR) et de leurs axones qui conduit à une perte aiguë ou subaiguë de la vision centrale; cela affecte principalement les jeunes hommes adultes. Santhera a terminé un essai clinique de phase III dans cette indication en Europe avec des résultats positifs et a déposé une demande de commercialisation du médicament auprès des régulateurs européens en juillet 2011. Il est approuvé par l'EMA pour cette indication et a été désigné médicament orphelin en 2007.
Indications explorées
Dystrophie musculaire de Duchenne (Catena)
Après des expériences chez la souris et des études préliminaires chez l'homme, l'idébénone est entrée dans les essais cliniques de phase II en 2005 et de phase III en 2009.
Autres maladies neuromusculaires
Les essais cliniques de phase I et II pour le traitement de la MELAS (encéphalomyopathie mitochondriale, acidose lactique et épisodes de type AVC) et de la sclérose en plaques progressive primaire sont en cours depuis décembre 2013.
Mode de vie
L'idébénone aurait des propriétés similaires à la CoQ 10 dans ses propriétés antioxydantes , et a donc été utilisée dans l' anti-vieillissement sur la base de la théorie des radicaux libres . Les preuves cliniques de cette utilisation font défaut. Il a été utilisé dans des applications topiques pour traiter les rides .
Pharmacologie
Dans les modèles cellulaires et tissulaires, l'idébénone agit comme un transporteur dans la chaîne de transport d'électrons des mitochondries et augmente ainsi la production d' adénosine triphosphate (ATP) qui est la principale source d'énergie pour les cellules, et inhibe également la formation de lipoperoxyde . Des effets positifs sur le foyer énergétique des mitochondries ont également été observés dans des modèles animaux. La pertinence clinique de ces résultats n'a pas été établie.
Pharmacocinétique
L'idébénone est bien absorbée par l'intestin mais subit un métabolisme de premier passage excessif dans le foie, de sorte que moins de 1% atteignent la circulation. Ce taux peut être amélioré avec des formulations spéciales ( suspensions ) d'idébénone et en l'administrant avec de la nourriture grasse; mais même en prenant ces mesures, la biodisponibilité semble encore être considérablement inférieure à 14% chez l'homme. Plus de 99% du médicament en circulation sont liés aux protéines plasmatiques . Les métabolites de l'idébénone comprennent les glucuronides et les sulfates , qui sont principalement (~ 80%) excrétés par l'urine.
