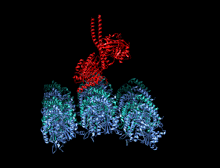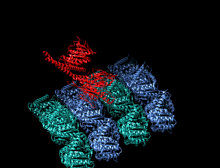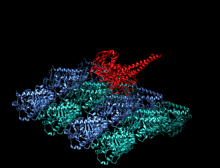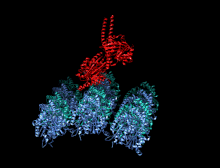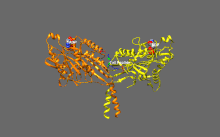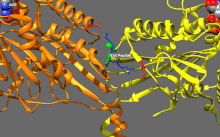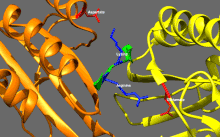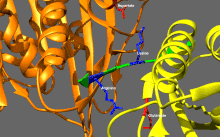Kinésine - Kinesin
Une kinésine est une protéine appartenant à une classe de protéines motrices présentes dans les cellules eucaryotes .
Les kinésines se déplacent le long des filaments des microtubules (MT) et sont alimentées par l'hydrolyse de l' adénosine triphosphate (ATP) (ainsi, les kinésines sont des ATPases , un type d'enzyme). Le mouvement actif des kinésines soutient plusieurs fonctions cellulaires, notamment la mitose , la méiose et le transport de la cargaison cellulaire, comme dans le transport axonal . La plupart des kinésines se dirigent vers l'extrémité positive d'un microtubule, ce qui, dans la plupart des cellules, implique le transport de marchandises telles que les protéines et les composants membranaires du centre de la cellule vers la périphérie. Cette forme de transport est connue sous le nom de transport antérograde . En revanche, les dynéines sont des protéines motrices qui se déplacent vers l'extrémité négative d'un microtubule en transport rétrograde .
Découverte
Les kinésines ont été découvertes en 1985, sur la base de leur motilité dans le cytoplasme extrudé de l'axone géant du calmar.
Ils se sont avérés être des moteurs de transport intracellulaire antérograde basés sur la MT. Le membre fondateur de cette superfamille, la kinésine-1, a été isolé en tant que moteur de transport d'organites axonal rapide hétérotétramère composé de 2 sous-unités motrices identiques (KHC) et de 2 « chaînes légères » (KLC) via une purification par affinité microtubulaire à partir d'extraits de cellules neuronales. Par la suite, un moteur à base de MT hétérotrimérique plus dirigé vers l'extrémité nommé kinésine-2, composé de 2 sous-unités motrices distinctes liées au KHC et d'une sous-unité "KAP" accessoire, a été purifié à partir d'extraits d'œufs/embryons d'échinodermes et est surtout connu pour son rôle dans le transport des complexes protéiques (particules IFT) le long des axonèmes au cours de la biogenèse du cil . Les approches génétiques moléculaires et génomiques ont conduit à la reconnaissance du fait que les kinésines forment une superfamille diversifiée de moteurs qui sont responsables de multiples événements de motilité intracellulaire dans les cellules eucaryotes. Par exemple, les génomes des mammifères codent pour plus de 40 protéines kinésines, organisées en au moins 14 familles nommées kinésine-1 à kinésine-14.
Structure
Structure globale
Les membres de la superfamille des kinésines varient en forme, mais le moteur prototypique de la kinésine-1 se compose de deux molécules de chaîne lourde de kinésine (KHC) qui forment un dimère protéique (paire de molécules) qui lie deux chaînes légères (KLC), qui sont uniques pour différentes cargaisons.
La chaîne lourde de la kinésine-1 comprend une tête globulaire (le domaine moteur) à l'extrémité amino-terminale connectée via un lien de cou court et flexible à la tige - un long domaine central enroulé en hélice alpha - qui se termine par un terminal carboxy domaine de queue qui s'associe aux chaînes légères. Les tiges de deux KHC s'entrelacent pour former une bobine enroulée qui dirige la dimérisation des deux KHC. Dans la plupart des cas, la cargaison transportée se lie aux chaînes légères de la kinésine, au niveau de la séquence du motif TPR du KLC, mais dans certains cas, la cargaison se lie aux domaines C-terminaux des chaînes lourdes.
Domaine moteur kinésin
| Domaine moteur kinésin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
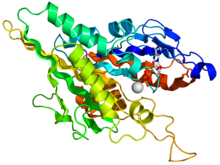 Structure cristallographique du domaine moteur de la kinésine humaine représentée sous la forme d'un dessin animé aux couleurs de l'arc-en-ciel ( N-terminal = bleu, C-terminal = rouge) complexé avec ADP (schéma de bâton, carbone = blanc, oxygène = rouge, azote = bleu, phosphore = orange) et un ion magnésium (sphère grise).
| |||||||||
| Identifiants | |||||||||
| symbole | Domaine moteur kinésin | ||||||||
| Pfam | PF00225 | ||||||||
| InterPro | IPR001752 | ||||||||
| INTELLIGENT | SM00129 | ||||||||
| PROSITE | PS50067 | ||||||||
| SCOP2 | 1bg2 / SCOPe / SUPFAM | ||||||||
| CDD | cd00106 | ||||||||
| |||||||||
La tête est la signature de la kinésine et sa séquence d'acides aminés est bien conservée parmi les différentes kinésines. Chaque tête possède deux sites de liaison distincts : un pour le microtubule et l'autre pour l'ATP. La liaison et l'hydrolyse d'ATP ainsi que la libération d' ADP modifient la conformation des domaines de liaison aux microtubules et l'orientation du linker du cou par rapport à la tête ; il en résulte le mouvement de la kinésine. Plusieurs éléments structurels de la tête, y compris un domaine central en feuillet bêta et les domaines Switch I et II, ont été impliqués comme médiateurs des interactions entre les deux sites de liaison et le domaine du cou. Les kinésines sont structurellement liées aux protéines G , qui hydrolysent le GTP au lieu de l'ATP. Plusieurs éléments structuraux sont partagés entre les deux familles, notamment le domaine Switch I et Switch II.

Régulation de base de la kinésine
Les kinésines ont tendance à avoir une faible activité enzymatique basale qui devient significative lorsqu'elle est activée par les microtubules. De plus, de nombreux membres de la superfamille des kinésines peuvent être auto-inhibés par la liaison du domaine de la queue au domaine moteur. Une telle auto-inhibition peut ensuite être levée par une réglementation supplémentaire telle que la liaison à la cargaison ou aux adaptateurs de cargaison.
Transport de marchandises
Dans la cellule, de petites molécules, telles que les gaz et le glucose , diffusent là où elles sont nécessaires. Grosses molécules synthétisées dans le corps cellulaire, les composants intracellulaires tels que les vésicules et les organites tels que les mitochondries sont trop gros (et le cytosol trop encombré) pour pouvoir diffuser vers leurs destinations. Les protéines motrices remplissent le rôle de transport de grandes cargaisons autour de la cellule vers leurs destinations requises. Les kinésines sont des protéines motrices qui transportent une telle cargaison en marchant de manière unidirectionnelle le long des pistes de microtubules hydrolysant une molécule d' adénosine triphosphate (ATP) à chaque étape. On pensait que l' hydrolyse de l' ATP alimentait chaque étape, l'énergie libérée propulsant la tête vers le site de liaison suivant. Cependant, il a été proposé que la tête diffuse vers l'avant et que la force de liaison au microtubule soit ce qui entraîne la cargaison. De plus, les virus, le VIH par exemple, exploitent les kinésines pour permettre la navette des particules virales après assemblage.
Il existe des preuves significatives que les cargaisons in vivo sont transportées par plusieurs moteurs.
Sens du mouvement
Les protéines motrices se déplacent dans une direction spécifique le long d'un microtubule. Les microtubules sont polaires ; ce qui signifie que les têtes ne se lient au microtubule que dans une seule orientation, tandis que la liaison ATP donne à chaque étape sa direction grâce à un processus connu sous le nom de fermeture à glissière du lien du cou.
On savait auparavant que la kinésine déplace la cargaison vers l'extrémité plus (+) d'un microtubule, également connue sous le nom de transport antérograde/transport orthograde. Cependant, il a été récemment découvert que dans les cellules de levure en herbe, la kinésine Cin8 (un membre de la famille Kinesin-5) peut également se déplacer vers l'extrémité négative, ou un transport rétrograde. Cela signifie que ces homotétramères de kinésine de levure uniques ont la nouvelle capacité de se déplacer dans les deux sens. La kinésine, jusqu'à présent, n'a montré qu'elle se déplaçait vers l'extrémité moins lorsqu'elle était en groupe, les moteurs glissant dans le sens antiparallèle pour tenter de séparer les microtubules. Cette double directionnalité a été observée dans des conditions identiques où les molécules Cin8 libres se déplacent vers l'extrémité moins, mais la réticulation Cin8 se déplace vers les extrémités plus de chaque microtubule réticulé. Une étude spécifique a testé la vitesse à laquelle les moteurs Cin8 se déplaçaient, leurs résultats ont donné une plage d'environ 25-55 nm/s, dans la direction des pôles de la broche. Sur une base individuelle, il a été constaté qu'en faisant varier les conditions ioniques, les moteurs Cin8 peuvent devenir aussi rapides que 380 nm/s. Il est suggéré que la bidirectionnalité des moteurs de levure kinésine-5 tels que Cin8 et Cut7 est le résultat du couplage avec d'autres moteurs Cin8 et aide à remplir le rôle de la dynéine dans la levure en herbe, par opposition à l'homologue humain de ces moteurs, le plus dirigé Eg5. Cette découverte dans les protéines de la famille de la kinésine-14 (telles que Drosophila melanogaster NCD, la levure bourgeonnante KAR3 et Arabidopsis thaliana ATK5) permet à la kinésine de marcher dans la direction opposée, vers l'extrémité moins des microtubules. Ce n'est pas typique de la kinésine, c'est plutôt une exception à la direction normale du mouvement.
Un autre type de protéine motrice, appelée dynéine , se déplace vers l'extrémité négative du microtubule. Ainsi, ils transportent des marchandises de la périphérie de la cellule vers le centre. Un exemple de ceci serait le transport se produisant des boutons terminaux d'un axone neuronal au corps cellulaire (soma). C'est ce qu'on appelle le transport rétrograde .
Mécanismes de mouvement proposés
La kinésine effectue le transport en "marchant" le long d'un microtubule. Deux mécanismes ont été proposés pour rendre compte de ce mouvement.
- Dans le mécanisme "main sur main", les têtes de kinésine se croisent en alternant la position de tête.
- Dans le mécanisme "inchworm", une tête de kinésine mène toujours, avançant d'un pas avant que la tête arrière ne rattrape.
Malgré une certaine controverse, de plus en plus de preuves expérimentales indiquent que le mécanisme de la main sur la main est plus probable.
La liaison et l'hydrolyse de l'ATP provoquent le déplacement de la kinésine via un « mécanisme de bascule » autour d'un point de pivot. Ce mécanisme de bascule explique les observations selon lesquelles la liaison de l'ATP à l'état sans nucléotide lié aux microtubules entraîne une inclinaison du domaine moteur de la kinésine par rapport au microtubule. De manière critique, avant cette inclinaison, le segment de liaison du cou est incapable d'adopter sa conformation orientée vers l'avant et la tête motrice ancrée. L'inclinaison induite par l'ATP offre la possibilité au lien du cou de s'arrimer dans cette conformation orientée vers l'avant. Ce modèle est basé sur les modèles CRYO-EM de la structure de la kinésine liée aux microtubules qui représentent les états de début et de fin du processus, mais ne peuvent pas résoudre les détails précis de la transition entre les structures.
Modélisation théorique
Un certain nombre de modèles théoriques de la protéine motrice moléculaire kinésine ont été proposés. De nombreux défis sont rencontrés dans les études théoriques étant donné les incertitudes restantes sur les rôles des structures protéiques, la manière précise dont l'énergie de l'ATP est transformée en travail mécanique et les rôles joués par les fluctuations thermiques. C'est un domaine de recherche assez actif. Il existe notamment un besoin d'approches faisant mieux le lien avec l'architecture moléculaire de la protéine et les données issues d'investigations expérimentales.
La dynamique d'une molécule unique est déjà bien décrite, mais il semble que ces machines à l'échelle nanométrique fonctionnent généralement en grandes équipes.
La dynamique d'une molécule unique est basée sur les états chimiques distincts du moteur et des observations sur ses étapes mécaniques. Pour de faibles concentrations d'adénosine diphosphate, le comportement du moteur est régi par la compétition de deux cycles moteurs chimiomécaniques qui déterminent la force de décrochage du moteur. Un troisième cycle devient important pour les grandes concentrations d'ADP. Des modèles avec un seul cycle ont également été discutés. Seiferth et al. ont démontré comment des quantités telles que la vitesse ou la production d'entropie d'un moteur changent lorsque des états adjacents sont fusionnés dans un modèle multicyclique jusqu'à ce que le nombre de cycles soit finalement réduit.
Des recherches expérimentales récentes ont montré que les kinésines, tout en se déplaçant le long des microtubules, interagissent les unes avec les autres, les interactions étant à courte portée et faiblement attractives (1,6±0,5 K B T). Un modèle qui a été développé prend en compte ces interactions de particules, où les vitesses dynamiques changent en fonction de l'énergie d'interaction. Si l'énergie est positive, le taux de création de liaisons (q) sera plus élevé tandis que le taux de rupture de liaisons (r) sera plus faible. On peut comprendre que les taux d'entrée et de sortie dans le microtubule seront également modifiés par l'énergie (Voir figure 1 en référence 30). Si le deuxième site est occupé, le taux d'entrée sera α*q et si l'avant-dernier site est occupé, le taux de sortie sera β*r. Cette approche théorique est en accord avec les résultats des simulations de Monte Carlo pour ce modèle, en particulier pour le cas limite de très grande énergie négative. Le processus normal d'exclusion simple totalement asymétrique pour les résultats (ou TASEP) peut être récupéré à partir de ce modèle rendant l'énergie égale à zéro.
Mitose
Ces dernières années, il a été découvert que les moteurs moléculaires à base de microtubules (y compris un certain nombre de kinésines) ont un rôle dans la mitose (division cellulaire). Les kinésines sont importantes pour la bonne longueur du fuseau et sont impliquées dans le glissement des microtubules dans le fuseau pendant la prométaphase et la métaphase, ainsi que dans la dépolymérisation des microtubules moins les extrémités au niveau des centrosomes pendant l'anaphase. Plus précisément, les protéines de la famille Kinesin-5 agissent dans le fuseau pour séparer les microtubules, tandis que la famille Kinesin 13 agit pour dépolymériser les microtubules.
Membres de la superfamille Kinesin
Les membres de la superfamille des kinésines humaines comprennent les protéines suivantes, qui, dans la nomenclature standardisée développée par la communauté des chercheurs en kinésine, sont organisées en 14 familles nommées kinésine-1 à kinésine-14 :
- 1A – KIF1A , 1B – KIF1B , 1C – KIF1C = kinésine-3
- 2A – KIF2A , 2C – KIF2C = kinésine-13
- 3B – KIF3B ou 3C – KIF3C 3A - KIF3A = kinésine-2
- 4A – KIF4A , 4B – KIF4B = kinésine-4
- 5A – KIF5A , 5B – KIF5B , 5C – KIF5C = kinésine-1
- 6 – KIF6 = kinésine-9
- 7 – KIF7 = kinésine-4
- 9 – KIF9 = kinésine-9
- 11 – KIF11 = kinésine-5
- 12 – KIF12 = kinésine-12
- 13A – KIF13A , 13B – KIF13B = kinésine-3
- 14 – KIF14 = kinésine-3
- 15 – KIF15 = kinésine-12
- 16B – KIF16B = kinésine-3
- 17 – KIF17 = kinésine-2
- 18A – KIF18A , 18B – KIF18B = kinésine-8
- 19 – KIF19 = kinésine-8
- 20A – KIF20A , 20B – KIF20B = kinésine-6
- 21A – KIF21A , 21B – KIF21B = kinésine-4
- 22 – KIF22 = kinésine-10
- 23 – KIF23 = kinésine-6
- 24 – KIF24 = kinésine-13
- 25 – KIF25 = kinésine-14
- 26A – KIF26A , 26B – KIF26B = kinésine-11
- 27 – KIF27 = kinésine-4
- C1 – KIFC1 , C2 – KIFC2 , C3 – KIFC3 = kinésine-14
chaînes légères de la kinésine-1 :
protéine associée à la kinésine-2 :
- KIFAP3 (également connu sous le nom de KAP-1, KAP3)
Voir également
- Transport axonal
- Dynéine
- Transport intraflagellaire le long des cils
- Kinésine 8
- Kinésine 13
- KRP
- Moteur moléculaire
- Transport par des protéines multi-motrices
Les références
Lectures complémentaires
- Lawrence CJ, Dawe RK, Christie KR, Cleveland DW, Dawson SC, Endow SA, Goldstein LS, Goodson HV, Hirokawa N, Howard J, Malmberg RL, McIntosh JR, Miki H, Mitchison TJ, Okada Y, Reddy AS, Saxton WM , Schliwa M, Scholey JM, Vale RD, Walczak CE, Wordeman L (octobre 2004). "Une nomenclature standardisée de la kinésine" . Le Journal de biologie cellulaire . 167 (1) : 19-22. doi : 10.1083/jcb.200408113 . PMC 2041940 . PMID 15479732 .
Liens externes
- MBInfo - Kinesin transporte une cargaison le long des microtubules
- Modèle animé de marche kinésine
- Séminaire de Ron Vale : "Molecular Motor Proteins"
- Animation du mouvement de la kinésine Bibliothèque d'images ASCB
- Murphy, VF (2004-05-12). "Mouvement basé sur les microtubules" . tissu.medicalengineer.co.uk . Archivé de l'original le 2007-07-22 . Récupéré le 10/12/2015 .
- La vie intérieure d'une cellule, animation 3D mettant en scène une kinésine transportant une vésicule
- La page d'accueil de Kinesin
- Kinesin à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis
- CE 3.6.4.4
- CE 3.6.4.5
- Structures de microscopie électronique 3D de la kinésine de la banque de données EM (EMDB)