Acide magique - Magic acid
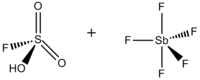 Acide fluorosulfurique-pentafluorure d'antimoine 1: 1
|
|
| Identifiants | |
|---|---|
|
Modèle 3D ( JSmol )
|
|
| ChemSpider | |
| Carte Info ECHA |
100.041.727 |
|
PubChem CID
|
|
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| HSbF 6 SO 3 | |
| Masse molaire | 316,82 g / mol |
| Apparence | Liquide |
| Dangers | |
| Phrases R (obsolètes) | R14 R15 / 29 R16 R17 R18 R19 R26 / 27/28 R30 R31 R32 R33 R34 |
| Phrases S (obsolètes) | S26 S27 S36 / 37/39 S38 S40 S41 S42 S43 S45 |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Références Infobox | |
L'acide magique ( FSO 3 H · SbF 5 ) est un superacide constitué d'un mélange, le plus souvent dans un rapport molaire 1: 1, d' acide fluorosulfurique (HSO 3 F) et de pentafluorure d'antimoine (SbF 5 ). Ce système de superacides Brønsted - Lewis conjugué a été développé dans les années 1960 par le laboratoire George Olah de la Case Western Reserve University , et a été utilisé pour stabiliser les carbocations et les ions carbonium hypercoordonnés dans les milieux liquides. L'acide magique et d'autres superacides sont également utilisés pour catalyser l'isomérisation des hydrocarbures saturés, et il a été démontré qu'ils protonent même les bases faibles, y compris le méthane, le xénon, les halogènes et l'hydrogène moléculaire.
Histoire
Le terme «superacide» a été utilisé pour la première fois en 1927 lorsque James Bryant Conant a découvert que l'acide perchlorique pouvait protoner les cétones et les aldéhydes pour former des sels en solution non aqueuse. Le terme lui-même a été inventé par RJ Gillespie plus tard, après que Conant ait combiné l'acide sulfurique avec l'acide fluorosulfurique , et a trouvé la solution plusieurs millions de fois plus acide que l'acide sulfurique seul. Le système d'acide magique a été développé dans les années 1960 par George Olah et devait être utilisé pour étudier les carbocations stables. Gillespie a également utilisé le système acide pour générer des cations inorganiques déficients en électrons. Le nom est né après une fête de Noël en 1966, lorsqu'un membre du laboratoire Olah a placé une bougie de paraffine dans l'acide et a constaté qu'elle se dissolvait assez rapidement. L' examen de la solution avec de 1 H-RMN a montré un tert - butyle cation, ce qui suggère que la chaîne de paraffine qui forme la cire avait été clivé, alors isomérisé en le carbocation tertiaire relativement stable. Le nom est apparu dans un article publié par le laboratoire Olah.
Propriétés
Structure
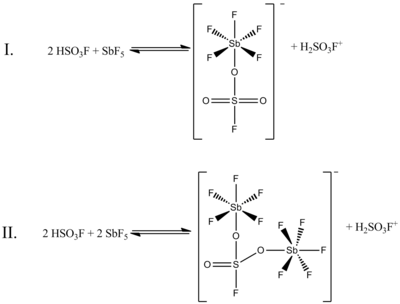
Bien qu'un rapport molaire 1: 1 de HSO 3 F et SbF 5 génère le mieux des ions carbonium, les effets du système à d'autres rapports molaires ont également été documentés. Lorsque le rapport SbF 5 : HSO 3 F est inférieur à 0,2, les deux équilibres suivants, déterminés par spectroscopie RMN 19 F, sont les plus importants en solution:
(Dans ces deux structures, le soufre a une coordination tétraédrique, pas planaire. Les doubles liaisons entre le soufre et l'oxygène sont plus correctement représentées comme des liaisons simples, avec des charges négatives formelles sur les atomes d'oxygène et une charge formelle plus deux sur le soufre. les atomes d'antimoine auront également une charge formelle de moins un.)
Dans la figure ci-dessus, l'équilibre I représente 80% des données RMN, tandis que l'équilibre II représente environ 20%. Lorsque le rapport des deux composés augmente de 0,4 à 1,4, de nouveaux signaux RMN apparaissent et augmentent en intensité avec des concentrations croissantes de SbF 5 . La résolution des signaux diminue également, en raison de la viscosité croissante du système liquide.
Force
Tous les acides producteurs de protons plus puissants que l'acide sulfurique à 100% sont considérés comme des superacides et se caractérisent par de faibles valeurs de la fonction d'acidité de Hammett . Par exemple, l'acide sulfurique, H 2 SO 4 , a une fonction d'acidité de Hammett, H 0 , de -12, l'acide perchlorique , HClO 4 , a une fonction d'acidité de Hammett, de -13, et celle du système d'acide magique 1: 1 , HSO 3 F · SbF 5 , vaut -23. On pense que l'acide fluoroantimonique , le superacide connu le plus fort, atteint des valeurs extrapolées de H 0 jusqu'à -28.
Les usages
Observations de carbocations stables
L'acide magique a une faible nucléophilicité, ce qui permet une stabilité accrue des carbocations en solution. Le carbocation trivalent "classique" peut être observé dans le milieu acide, et s'est avéré planaire et sp 2 -hybridé. Parce que le carbone est entouré de seulement six électrons de valence, il est fortement déficient en électrons et électrophile. Il est facilement décrit par les structures de points de Lewis car il ne contient que des liaisons à deux électrons et à deux carbones. De nombreux cations cycloalkyles tertiaires peuvent également être formés dans des solutions superacides. Un tel exemple est le cation 1-méthyl-1-cyclopentyle, qui est formé à la fois du cyclopentane et du cyclohexane précurseur. Dans le cas du cyclohexane , le cation cyclopentyle est formé par isomérisation du carbocation secondaire en carbocation tertiaire, plus stable. Des ions cyclopropylcarbénium, des cations alcényle et des cations arénium ont également été observés.
Cependant, à mesure que l'utilisation du système d'acide magique devenait plus répandue, des carbocations de coordonnées plus élevées ont été observées. Les carbocations de coordonnées penta, également décrits comme des ions non classiques , ne peuvent pas être représentés en utilisant uniquement des liaisons à deux électrons et à deux centres, et nécessitent, à la place, une liaison à deux électrons, trois (ou plus) centres. Dans ces ions, deux électrons sont délocalisés sur plus de deux atomes, ce qui rend ces centres de liaison si déficients en électrons qu'ils permettent aux alcanes saturés de participer à des réactions électrophiles. La découverte de carbocations hypercoordonnés a alimenté la controverse ionique non classique des années 50 et 60. En raison de l'échelle de temps lente de 1 H-RMN, les charges positives d' équilibrage rapide sur des atomes d'hydrogène iraient probablement non détectée. Cependant, la spectroscopie IR , la spectroscopie Raman et la RMN 13 C ont été utilisées pour étudier les systèmes de carbocation pontés. Un cation controversé, le cation norbornyle, a été observé dans plusieurs milieux, dont l'acide magique.
L'atome de carbone du méthylène de pontage est pentacoordonné, avec trois liaisons à deux électrons à deux centres et une liaison à deux électrons à trois centres avec son orbitale sp 3 restante . Les calculs de mécanique quantique ont également montré que le modèle classique n'est pas un minimum d'énergie.
Réactions avec les alcanes
L'acide magique est capable de protoner les alcanes . Par exemple, le méthane réagit pour former le CH +
5 ion à 140 ° C et à la pression atmosphérique, bien que certains ions hydrocarbonés de poids moléculaire plus élevé soient également formés comme sous-produits. L'hydrogène gazeux est un autre sous-produit de la réaction.
En présence de FSO 3 D plutôt que de FSO 3 H, il a été démontré que le méthane échangeait des atomes d'hydrogène contre des atomes de deutérium, et HD est libéré plutôt que H 2 . C'est une preuve qui suggère que dans ces réactions, le méthane est en effet une base et peut accepter un proton du milieu acide pour former CH +
5 . Cet ion est ensuite déprotoné, expliquant l'échange d'hydrogène, ou perd une molécule d'hydrogène pour former CH +
3 - l'ion carbonium. Cette espèce est assez réactive et peut produire plusieurs nouveaux carbocations, illustrés ci-dessous.
Les alcanes plus grands, tels que l'éthane, sont également réactifs dans l'acide magique, et tous deux échangent des atomes d'hydrogène et se condensent pour former des carbocations plus grands, tels que le néopentane protoné. Cet ion est ensuite clivé à des températures plus élevées, et réagit pour libérer de l'hydrogène gazeux et forme le cation t-amyle à des températures plus basses.
C'est sur cette note que George Olah suggère de ne plus prendre comme synonymes les noms «alcane» et «paraffine». Le mot «paraffine» est dérivé du latin «parum affinis», qui signifie «manquant d'affinité». Il dit: «C'est cependant avec une certaine nostalgie que nous faisons cette recommandation, car les« gaz inertes »ont au moins maintenu leur« noblesse »au fur et à mesure que leur réactivité chimique devenait apparente, mais se référer aux« hydrocarbures nobles »semble inapproprié. "
Catalyse aux hydroperoxydes
L'acide magique catalyse les réactions de clivage-réarrangement des hydroperoxydes tertiaires et des alcools tertiaires. La nature des expériences utilisées pour déterminer le mécanisme, à savoir le fait qu'elles se sont déroulées en milieu superacide, a permis d'observer les intermédiaires de carbocation formés. Il a été déterminé que le mécanisme dépend de la quantité d'acide magique utilisée. Proche de l'équivalence molaire, seul le clivage O – O est observé, mais avec un excès croissant d'acide magique, le clivage C – O entre en compétition avec le clivage O – O. L'excès d'acide désactive probablement le peroxyde d'hydrogène formé lors de l'hétérolyse C – O.
L'acide magique catalyse également l'hydroxylation électrophile de composés aromatiques avec du peroxyde d'hydrogène, ce qui donne une préparation à haut rendement de produits monohydroxylés. Les phénols existent en tant qu'espèces complètement protonées dans les solutions de superacides, et lorsqu'ils sont produits dans la réaction, ils sont ensuite désactivés en vue d'une attaque électrophile supplémentaire. Le peroxyde d'hydrogène protoné est l'agent hydroxylant actif.
Catalyse avec l'ozone
L'oxygénation des alcanes peut être catalysée par une solution d' acide magique – SO 2 ClF en présence d' ozone . Le mécanisme est similaire à celui de la protolyse des alcanes, avec une insertion électrophile dans les liaisons σ simples de l'alcane. L'état de transition du complexe hydrocarbure-ozone a la forme d'un ion penta-coordonné.
Les alcools, les cétones et les aldéhydes sont également oxygénés par insertion électrophile.
Sécurité
Comme pour tous les acides forts, et en particulier les superacides, un équipement de protection individuelle approprié doit être utilisé. En plus des gants et des lunettes obligatoires, l'utilisation d'un écran facial et d'un respirateur facial est également recommandée. Comme on pouvait s'y attendre, l'acide magique est hautement toxique lors de l'ingestion et de l'inhalation, provoque de graves brûlures de la peau et des yeux et est toxique pour la vie aquatique.
Voir également
- Acide fluoroantimonique , le superacide le plus fort