Ions métalliques en solution aqueuse - Metal ions in aqueous solution
Un ion métallique en solution aqueuse ou aqua ion est un cation , dissous dans l' eau , de formule chimique [M(H 2 O) n ] z+ . Le nombre de solvatation , n , déterminé par diverses méthodes expérimentales est 4 pour Li + et Be 2+ et 6 pour les éléments des périodes 3 et 4 du tableau périodique . Lanthanides et actinides ions aqua ont un certain nombre de solvatation de 8 ou 9. La résistance des liaisons entre les molécules de l' ion métallique et l' eau dans le primaire enveloppe de solvatation augmente avec la charge électrique, z , sur l'ion métallique et diminue à mesure que son rayon ionique , r , augmente. Les ions aquatiques sont sujets à l'hydrolyse. Le logarithme de la première constante d'hydrolyse est proportionnel à z 2 / r pour la plupart des ions aquatiques.
L'ion aquatique est associé, par liaison hydrogène , à d' autres molécules d'eau dans une couche de solvatation secondaire. Les molécules d'eau dans la première coque d'hydratation échangent avec des molécules dans la seconde coque de solvatation et des molécules dans le liquide en vrac. Le temps de séjour d'une molécule dans la première couche varie parmi les éléments chimiques d'environ 100 picosecondes à plus de 200 ans. Les ions aquatiques sont prédominants en électrochimie .
Introduction aux ions métalliques aquatiques
Éléments qui forment des ions aquatiques H Il Li Être B C N O F Ne N / A mg Al Si P S Cl Ar K Californie Sc Ti V Cr Mn Fe Co Ni Cu Zn Géorgie Gé* Comme Se Br Kr Rb Sr Oui Zr Nb Mo Tc Ru Rhésus PD Ag CD Dans Sn Sb* Te je Xe Cs Ba La Ce Pr nd après-midi SM UE Dieu To Dy Ho Euh Tm Yb Lu Hf Ta W Ré Os Je pt Au Hg Tl Pb Bi Po* À Rn Ve* Ra* c.a. E Pennsylvanie U Np Pu Un m Cm Noir Cf. Es* FM* Maryland* Non* G / D*
- * Aucune information expérimentale concernant les structures d'ions aquatiques
La plupart des éléments chimiques sont métalliques . Les composés des éléments métalliques forment généralement des ions aquatiques simples de formule [M(H 2 O) n ] z+ dans les faibles états d'oxydation . Avec les états d'oxydation les plus élevés, les ions aquatiques simples se dissocient en perdant des ions hydrogène pour donner des complexes contenant à la fois des molécules d'eau et des ions hydroxyde ou oxyde, tels que l' espèce vanadium (IV) [VO(H 2 O) 5 ] 2+ . Dans les états d'oxydation les plus élevés, seuls les oxyanions , tels que l' ion permanganate (VII), MnO−
4, sont connus. Certains éléments, tels que l' étain et l' antimoine sont clairement des métaux, mais ne forment que des composés covalents dans les états d'oxydation les plus élevés. Les transactinides ont été laissés de côté en raison d'un manque de données expérimentales.

En solution aqueuse, les molécules d'eau directement attachées à l'ion métallique appartiennent à la première sphère de coordination , également connue sous le nom de première couche de solvatation. La liaison entre une molécule d'eau et l'ion métallique est une liaison covalente dative , l'atome d'oxygène donnant les deux électrons à la liaison. Chaque molécule d'eau coordonnée peut être attachée par des liaisons hydrogène à d'autres molécules d'eau. Ces derniers sont dits résider dans la deuxième sphère de coordination. La deuxième sphère de coordination n'est pas une entité bien définie pour les ions de charge 1 ou 2. Dans les solutions diluées, elle se fond dans la structure de l'eau dans laquelle il existe un réseau irrégulier de liaisons hydrogène entre les molécules d'eau. Avec les ions tripositifs, la charge élevée du cation polarise les molécules d'eau dans la première couche de solvatation à un point tel qu'elles forment des liaisons hydrogène suffisamment fortes avec les molécules de la seconde couche pour former une entité plus stable.
La force de la liaison métal-oxygène peut être estimée de diverses manières. L'enthalpie d'hydratation, bien que basée indirectement sur des mesures expérimentales, est la mesure la plus fiable. L'échelle des valeurs est basée sur un zéro choisi arbitrairement, mais cela n'affecte pas les différences entre les valeurs de deux métaux. D'autres mesures incluent la fréquence de vibration M–O et la longueur de liaison M–O. La force de la liaison MO a tendance à augmenter avec la charge et à diminuer à mesure que la taille de l'ion métallique augmente. En fait, il existe une très bonne corrélation linéaire entre l'enthalpie d'hydratation et le rapport de la charge au carré sur le rayon ionique, z 2 /r. Pour les ions en solution, le "rayon ionique effectif" de Shannon est la mesure la plus souvent utilisée.
Les molécules d'eau dans les première et deuxième coquilles de solvatation peuvent changer de place. Le taux d'échange varie énormément selon le métal et son état d'oxydation. Les ions aqueux métalliques sont toujours accompagnés en solution d'anions solvatés, mais on en sait beaucoup moins sur la solvatation des anions que sur la solvatation des cations.
La compréhension de la nature des ions d' aqua est aidé par avoir des informations sur la nature des cations solvatées dans des solvants mixtes et non aqueuses de solvants , tels que l' ammoniac liquide , le méthanol , le diméthylformamide et le diméthylsulfoxyde mentionner quelques - uns.
Occurrence dans la nature
Les ions aquatiques sont présents dans la plupart des eaux naturelles. Na + , K + , Mg 2+ et Ca 2+ sont les principaux constituants de l' eau de mer .
Ions aquatiques dans l'eau de mer ( salinité = 35) Ion N / A+
K+
mg2+
Californie2+
Concentration
(mol kg −1 )0,469 0,0102 0,0528 0,0103
De nombreux autres ions aquatiques sont présents dans l'eau de mer à des concentrations allant de ppm à ppt . Les concentrations de sodium, potassium, magnésium et calcium dans le sang sont similaires à celles de l'eau de mer. Le sang a également des concentrations plus faibles d' éléments essentiels tels que le fer et le zinc. La boisson pour sportifs est conçue pour être isotonique et contient également les minéraux qui sont perdus dans la transpiration .
Les ions magnésium et calcium sont des constituants courants de l'eau domestique et sont respectivement responsables de la dureté permanente et temporaire . On les trouve souvent dans l'eau minérale .
méthodes expérimentales
Les informations obtenues sur la nature des ions en solution varient selon la nature de la méthode expérimentale utilisée. Certaines méthodes révèlent directement les propriétés du cation, d'autres révèlent des propriétés qui dépendent à la fois du cation et de l'anion. Certaines méthodes fournissent des informations de nature statique, une sorte d'instantané des propriétés moyennes, d'autres donnent des informations sur la dynamique de la solution.
Résonance magnétique nucléaire (RMN)
Les ions pour lesquels le taux d'échange d'eau est lent sur l' échelle de temps RMN donnent des pics séparés pour les molécules de la première couche de solvatation et pour les autres molécules d'eau. Le nombre de solvatation est obtenu en tant que rapport des aires de pic. Ici, il fait référence au nombre de molécules d'eau dans la première couche de solvatation. Les molécules de la deuxième couche de solvatation échangent rapidement avec les molécules de solvant, ce qui entraîne un léger changement dans la valeur de déplacement chimique des molécules d'eau non coordonnées par rapport à celle de l'eau elle-même. Le principal inconvénient de cette méthode est qu'elle nécessite des solutions assez concentrées, avec le risque associé de formation de paires d' ions avec l'anion.
| Ion | Être 2+ | mg 2+ | Tout 3+ | Ga 3+ | En 3+ | Fe 2+ | Co 2+ | Ni 2+ | Zn 2+ | J 4+ |
|---|---|---|---|---|---|---|---|---|---|---|
| Numéro | 4 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 9 |
| Noyau | 1 H 17 O | 1 heure | 1 heure | 1 H 17 O | 1 heure | 17 O | 1 heure | 1 H 17 O | 1 heure | 1 heure |
Diffraction des rayons X (DRX)
Une solution contenant un ion aquatique n'a pas l'ordre à longue distance qui serait présent dans un cristal contenant le même ion, mais il existe un ordre à courte distance. La diffraction des rayons X sur les solutions donne une fonction de distribution radiale à partir de laquelle le nombre de coordination de l'ion métallique et de la distance métal-oxygène peut être dérivé. Avec des ions aquatiques de charge élevée, certaines informations sont obtenues sur la deuxième couche de solvatation.
Cette technique nécessite l'utilisation de solutions relativement concentrées. Les rayons X sont diffusés par les électrons, la puissance de diffusion augmente donc avec le numéro atomique. Cela rend les atomes d'hydrogène pratiquement invisibles à la diffusion des rayons X.
La diffusion des rayons X aux grands angles a été utilisée pour caractériser la seconde couche de solvatation avec des ions trivalents tels que Cr 3+ et Rh 3+ . La deuxième enveloppe d'hydratation de Cr 3+ s'est avérée avoir13 ± 1 molécules à une distance moyenne de402 ± 20h . Cela implique que chaque molécule de la première coque d'hydratation est liée à l'hydrogène à deux molécules de la seconde coque.
Diffraction des neutrons
La diffraction par les neutrons donne également une fonction de distribution radiale . Contrairement à la diffraction des rayons X, les neutrons sont diffusés par les noyaux et il n'y a aucune relation avec le numéro atomique. En effet, on peut exploiter le fait que différents isotopes d'un même élément peuvent avoir des pouvoirs de diffusion très différents. Dans une expérience classique, des mesures ont été effectuées sur quatre solutions de chlorure de nickel en utilisant des combinaisons d' isotopes 58 Ni, 60 Ni, 35 Cl et 37 Cl pour donner une image très détaillée de la solvatation des cations et des anions. Les données pour un certain nombre de sels métalliques montrent une certaine dépendance vis-à-vis de la concentration en sel.
| sel | LiCl | CaCl 2 | NiCl 2 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Molalité du sel | 27,77 | 9,95 | 3.57 | 4.49 | 2,80 | 1,0 | 3.05 | 0,85 | 0,46 | 0,086 |
| Numéro d'hydratation Cation † | 2.3 (2) | 3,0 (5) | 5,5 (3) | 6.4 (3) | 7.2 (2) | 10,0 (6) | 5,8 (2) | 6,6 (5) | 6,8 (8) | 6,8 (8) |
| /deg ‡ | 75 (5) | 52 (5) | 40 (5) | 34 (9) | 34 (9) | 38 (9) | 42 (8) | 27 (10) | 17 (10) | 0 (20) |
| sel | Ni(ClO 4 ) 2 | Cu(ClO 4 ) 2 | Fe(NO 3 ) 3 | NdCl 3 | DyCl 3 |
|---|---|---|---|---|---|
| Molalité du sel | 3,80 | 2,00 | 2.0 | 2,85 | 2,38 |
| Numéro d'hydratation Cation † | 5,8 (2) | 4,9 (3) | 5,0 (2) | 8,5 (2) | 7.4 (5) |
| /deg ‡ | 42 (8) | 38 (6) | 22 (4) | 24 (4) | 17 (3) |
- † Les chiffres entre parenthèses sont les écarts - types sur le dernier chiffre significatif de la valeur. ‡ angle entre un M-OH 2 liaison et le plan de la molécule d'eau.
La plupart de ces données se réfèrent à des solutions concentrées dans lesquelles il y a très peu de molécules d'eau qui ne sont pas dans les sphères d'hydratation primaires du cation ou de l'anion, ce qui peut expliquer une partie de la variation du nombre de solvatation avec la concentration même s'il n'y a pas d'ion de contact. appariement. L'angle donne l'angle d'inclinaison des molécules d'eau par rapport à un plan dans l'ion aquatique. Cet angle est affecté par les liaisons hydrogène formées entre les molécules d'eau dans les couches de solvatation primaire et secondaire.
Le nombre de solvatation mesuré est une valeur moyenne dans le temps pour la solution dans son ensemble. Lorsqu'un nombre de solvatation primaire mesuré est fractionnaire, il existe deux espèces ou plus avec des nombres de solvatation intégraux présents en équilibre les unes avec les autres. Cela s'applique également aux nombres de solvatation qui sont des nombres entiers, dans les limites de l'erreur expérimentale. Par exemple, le nombre de solvatation de 5,5 pour une solution de chlorure de lithium pourrait être interprété comme étant dû à la présence de deux ions aquatiques différents avec des concentrations égales.
- [Li(H 2 O) 6 ] + [Li(H 2 O) 5 ] + + H 2 O
Une autre possibilité est qu'il y ait une interaction entre un cation solvaté et un anion, formant une paire d'ions . Ceci est particulièrement pertinent lorsque les mesures sont effectuées sur des solutions salines concentrées. Par exemple, un nombre de solvatation de 3 pour une solution de chlorure de lithium pourrait être interprété comme étant dû à l'équilibre
- [Li(H 2 O) 4 ] + + Cl − ⇌ [Li(H 2 O) 3 Cl] + H 2 O
entièrement en faveur de la paire d'ions.
Spectres vibratoires
Les spectres infrarouges et les spectres Raman peuvent être utilisés pour mesurer la fréquence d'étirement MO dans les ions aqua métalliques. La spectroscopie Raman est particulièrement utile car le spectre Raman de l'eau est faible alors que le spectre infrarouge de l'eau est intense. L'interprétation des fréquences de vibration est quelque peu compliquée par la présence, dans les ions octaédriques et tétraédriques, de deux vibrations, une symétrique mesurée dans le spectre Raman et une antisymétrique, mesurée dans le spectre infrarouge.
| ions métalliques | Être 2+ | mg 2+ | Mn 2+ | Fe 2+ | Ni 2+ | Cu 2+ | Zn 2+ | Hg 2+ | Tout 3+ | Ga 3+ | En 3+ |
|---|---|---|---|---|---|---|---|---|---|---|---|
| nombre d'onde /cm -1 | 530-543 | 360-365 | 395 | 389 | 405 | 440 | 385-400 | 380 | 520-526 | 475 | 400 |
Bien que la relation entre la fréquence de vibration et la constante de force ne soit pas simple, la conclusion générale qui peut être tirée de ces données est que la force de la liaison MO augmente avec l'augmentation de la charge ionique et la diminution de la taille ionique. La fréquence d'étirement MO d'un ion aquatique en solution peut être comparée à sa contrepartie dans un cristal de structure connue. Si les fréquences sont très similaires, on peut conclure que le nombre de coordination de l'ion métallique est le même en solution que dans un composé à l'état solide.
Méthodes dynamiques
Des données telles que la conductivité , la mobilité électrique et la diffusion se rapportent au mouvement des ions à travers une solution. Lorsqu'un ion se déplace à travers une solution, il a tendance à emporter avec lui les première et deuxième couches de solvatation. Par conséquent, les nombres de solvatation mesurés à partir des propriétés dynamiques ont tendance à être beaucoup plus élevés que ceux obtenus à partir des propriétés statiques.
Nombres d'hydratation mesurés par des méthodes dynamiques Li + Non + Cs + mg 2+ Environ 2+ Ba 2+ Zn 2+ Cr 3+ Tout 3+ Numéro de transport ionique 13-22 7-13 4 12-14 8-12 3-5 10-13 Mobilité ionique 3-21 2-10 10-13 7-11 5-9 10-13 La diffusion 5 3 1 9 9 8 11 17 13
Nombres et structures de solvatation
Hydrogène
L'hydrogène n'est pas un métal, mais comme eux, il a tendance à perdre son électron de valence dans les réactions chimiques, formant un cation H + . En solution aqueuse, celui-ci s'attache immédiatement à une molécule d'eau, formant une espèce généralement symbolisée par H 3 O + (parfois vaguement écrite H + ). Une telle hydratation forme des cations qui peuvent essentiellement être considérés comme [H(OH 2 ) n ] + .
La solvatation de H + dans l'eau n'est pas entièrement caractérisée et de nombreuses structures différentes ont été suggérées. Deux structures bien connues sont le cation Zundel et le cation Eigen . La structure de solvatation Eigen a l'ion hydronium au centre d'un H
9O+
4complexe dans lequel l'hydronium est fortement lié hydrogène à trois molécules d'eau voisines. Dans le Zundel H
5O+
2complexe le proton est partagé à parts égales par deux molécules d'eau dans une liaison hydrogène symétrique .
Métaux alcalins
Des nombres de solvatation de 3 à 6 ont été trouvés pour les ions lithium aqua. Les nombres de solvatation inférieurs à 4 peuvent être le résultat de la formation de paires d'ions de contact . Les nombres de solvatation plus élevés peuvent être interprétés en termes de molécules d'eau qui s'approchent de [Li(H 2 O) 4 ] + à travers une face du tétraèdre, bien que des simulations de dynamique moléculaire puissent indiquer l'existence d'un ion aqua octaédrique. Il y a très probablement six molécules d'eau dans la sphère de solvatation primaire de l' ion sodium . Le potassium et le rubidium sont très probablement antiprismatiques carrés à 8 coordonnées, le césium étant probablement à 12 coordonnées.
Métaux alcalino-terreux
| [Be(H 2 O) 4 ] 2+ | [Mg(H 2 O) 6 ] 2+ | Ca 2+ (aq) | Sr 2+ (aq) | Ba 2+ (aq) | |
|---|---|---|---|---|---|
| Distance MO (après-midi) | 167 | 209 | 242 § | 263 § | 281 § |
| solvatation (kJ mol −1 ) | 2494 | 1921 | 1577 | 1443 | 1305 |
- § Valeurs extrapolées à partir des données pour les structures cristallines à l'état solide
Le cation béryllium [Be(H 2 O) 4 ] 2+ a une couche de solvatation primaire très bien définie avec un noyau tétraédrique BeO 4 . Pour le magnésium , [Mg(H 2 O) 6 ] 2+ est également une espèce bien caractérisée, avec un noyau octaédrique de MgO 6 . La situation pour le calcium est plus compliquée. Les données de diffraction des neutrons ont donné un indice de solvatation pour le chlorure de calcium, CaCl 2 , qui dépend fortement de la concentration :10,0 ± 0,6 à 1 mol·dm −3 , décroissant jusqu'à6,4 ± 0,3 à 2,8 mol·dm -3 . L'enthalpie de solvatation diminue avec l'augmentation du rayon ionique. Divers hydrates solides sont connus avec une coordination 8 en antiprisme carré et géométrie dodécaédrique . Dans l'eau, le calcium (II), le strontium (II) et le baryum (II) sont des antiprismatiques carrés de 8 coordonnées. Les calculs suggèrent que l'indice d'hydratation du radium (II) est de 6 à 9, bien qu'il n'ait pas été observé expérimentalement.
Métaux du groupe 3, lanthanides et actinides
L'yttrium (III) est un antiprismatique carré de 8 coordonnées. Les ions lanthanides trivalents diminuent régulièrement de taille du lanthane au lutétium , un effet connu sous le nom de contraction du lanthanide . Du lanthane au dysprosium , le nombre de coordination est maintenu à 9 avec une structure prismatique trigonale tricoiffée, bien qu'à partir du samarium, les molécules d'eau coiffantes ne soient plus également fortement liées. Un déficit hydrique apparaît alors pour l' holmium au lutétium avec un nombre moyen de coordination tombant à 8,2 au lutétium(III). Scandium (III) est similaire avec un numéro de coordination moyen de 8,0. La configuration est maintenue malgré la petite taille des cations et le déficit en eau, probablement dû à une forte liaison hydrogène. Le cérium (IV) est un antiprismatique carré de 8 coordonnées; l'europium (II) semble avoir le numéro de coordination 8, mais sa structure n'est pas connue.
On pense que des nombres de solvatation de 9 ou plus s'appliquent aux ions actinides dans les états d'oxydation +3 et +4. Ceci n'est connu que pour l' actinium (III), le thorium (IV), l' uranium (IV), le neptunium (IV), le plutonium (III) et (IV), l' américium (III) et le curium (III). Le thorium(IV), l'uranium(IV), le neptunium(IV) et le plutonium(IV) sont probablement des prismatiques triangulaires à trois coiffes. Les études sur le nombre et/ou la structure de coordination à ce jour s'étendent uniquement à californium . On s'attend à ce que les nombres de coordination diminuent pour les actinides tardifs, de la même manière que pour les lanthanides tardifs.
Métaux du groupe 4-12
Les ions de ces métaux aux états d'oxydation +2 et +3 ont un nombre de solvatation de 6. Tous ont une structure octaédrique régulière, à l'exception des ions aqua de chrome (II) et de cuivre (II) qui sont sujets à la distorsion de Jahn-Teller . Dans le cas du cuivre, les deux distances Cu-O axiales sont de 238 pm, alors que les quatre distances Cu-O équatoriales sont de 195 pm à l'état solide. Cependant, il n'est pas clair si Cu 2+ a un nombre de solvatation de 5 ou 6 en solution aqueuse, avec des rapports expérimentaux contradictoires. L'argent (I) est probablement à 4 coordonnées, [Ag(H 2 O) 4 ] + .
Un nombre de solvatation de 6 avec une structure octaédrique est bien établi pour le zinc (II) et le cadmium (II) dans des solutions diluées. Dans les solutions concentrées, l' ion Zn 2+ peut adopter une structure tétraédrique à 4 coordonnées, mais la preuve n'est pas concluante en raison de la possibilité d'appariement d'ions et/ou d'hydrolyse. Le nombre de solvatation du mercure (II) est probablement égal à 6.
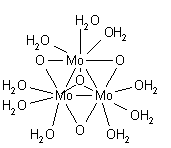
La structure bis aqua de l'ion mercure(I), [(H 2 O)-Hg-Hg-(OH 2 ] + , trouvé dans les composés solides, se trouve également en solution. Une autre espèce aquatique dans laquelle il y a un métal- la liaison métallique est l' espèce de molybdène (II) formulée sous la forme [(H 2 O) 4 Mo≣Mo(H 2 O) 4 ] 4+ . Chaque molybdène est entouré de quatre molécules d'eau dans un arrangement carré-plan, dans une structure similaire à celle de la structure connue du complexe chloré [Mo 2 Cl 8 ] 4- La présence d'une cinquième molécule d'eau en position axiale n'est cependant pas exclue.
Il existe quelques ions aquatiques divalents et trivalents de métaux de transition dans les deuxième et troisième séries de transition : le ruthénium (II) et (III), l' osmium (II), le rhodium (III) et l' iridium (III), tous octaédriques. Le molybdène (III) est fortement hydrolysé en solution aqueuse et le molybdène (II) se dimérise. On pensait à l'origine que les ions aqua palladium (II) et platine (II) étaient carrés, mais sont en réalité octaédriques fortement allongés de manière tétragonale. L'argent (I) forme un tétraèdre déformé, l' or (I) linéaire et l'or (III) un octaèdre déformé. Le cuivre (I) est extrapolé pour être tétraédrique. La distorsion se produit pour les métaux de faible coordonnée avec de fortes tendances covalentes en raison de l'effet Jahn-Teller de second ordre. Avec l'état d'oxydation 4, cependant, les seules espèces non hydrolysées sont le zirconium antiprismatique carré (IV), [Zr(H 2 O) 8 ] 4+ , et l' hafnium (IV), [Hf(H 2 O) 8 ] 4+ , et même elles sont extrêmement sujettes à l'hydrolyse : un tel cation zirconium ne se forme que dans des solutions diluées de Zr IV dans un acide fort. En pratique, les espèces cationiques rencontrées du zirconium et de l'hafnium sont polynucléaires.
Métaux du groupe 13-17
L' ion aqua aluminium (III), [Al(H 2 O) 6 ] 3+ est très bien caractérisé en solution et à l'état solide. Le noyau AlO 6 a une symétrie octaédrique, groupe ponctuel O h . Les ions aqua du gallium (III), de l' indium (III) et du thallium (III) ont également un nombre de solvatation de 6. L'ion aqua du thallium(I) est souvent supposé être de 6 coordonnées, mais cette hypothèse n'est pas basée sur preuves expérimentales solides. Le rayon de Shannon de Tl + , à 150 pm, n'est pas très différent de celui de K + , à 138 pm, donc une certaine similitude entre la chimie Tl + et K + est à la fois attendue et observée. Il semble y avoir deux distances de liaisons Tl–O différentes, mais le nombre de coordination et la structure n'ont pas encore été déterminés expérimentalement.
L'étain (II) et le plomb (II) sont respectivement hémiorientés à 3 et 6 coordonnées. Pour l'étain (II), la première sphère de coordination est calculée pour se diviser en deux hémisphères à des distances différentes de l'ion. En pratique, ces cations ont tendance à être polynucléaires. Le bismuth (III) est un antiprismatique carré déformé à 8 coordonnées.
Les ions aquatiques des éléments proches de la ligne de séparation métal-non-métal sont très facilement hydrolysés et ne peuvent pas être facilement étudiés expérimentalement. Il existe des preuves que des ions aqueux de germanium (II) peuvent se former dans les milieux d' acide perchlorique . Cependant, celui-ci est facilement oxydé en germanium (IV). Les ions antimoine (III) aquatiques peuvent également exister dans des solutions diluées d'antimoine (III) dans des acides concentrés, mais il n'y a aucune preuve directe de cela. Des calculs de mécanique quantique suggèrent l'existence d'ions aqua germanium(II) et antimoine(III) : ils montrent une distorsion extrême de la première sphère de coordination en raison de la densité de charge élevée et des paires isolées stéréochimiquement actives. Pour le germanium (II), la première coque est calculée pour avoir généralement un nombre de solvatation de 6, mais les nombres 4 à 7 sont également possibles et la coque se divise en deux avec des distances différentes du Ge 2+ central . Des recherches similaires pour l'antimoine (III) révèlent un nombre de solvatation de 8, la première sphère de coordination se divisant en deux hémisphères d'hydratation contenant chacun 4 molécules d'eau. Les calculs pour le polonium (IV) indiquent un nombre de solvatation compris entre 8 et 9.
L'arsenic (III) et l' astatine (I) ne semblent pas former de cations aquatiques : l'arsenic (III) est calculé pour former uniquement des espèces hydrolysées, et les preuves d'électromigration montrent que l'astate (I) forme de l'acide hypoastatique protoné [H 2 OAt] + en acide solutions (montrant l'analogie avec l'iode). L'espèce d'arsenic(III) cationique stable dans l'eau est calculée comme étant [As(OH) 2 ] + . À l'état d'oxydation +4, seules les espèces hydrolysées sont attendues pour le germanium(IV), l'étain(IV) et le plomb(IV). Le tellure cationique (IV) semble être [Te(OH) 3 ] + .
Bien que les structures du thallium(I), du germanium(II), de l'étain(II), du plomb(II) et de l'antimoine(III) soient affectées par les paires isolées, ce n'est pas le cas pour le bismuth(III).
Oxo-aqua-cations
Certains éléments dans des états d'oxydation supérieurs à 3 forment des ions oxo stables et aquatés. Des exemples bien connus sont les ions vanadyle (IV) et uranyle (VI). Ils peuvent être considérés comme des produits d'hydrolyse particulièrement stables dans une réaction hypothétique telle que
- [V(H 2 O) 6 ] 4+ → [VO(H 2 O) 5 ] 2+ + 2H +
Le vanadium a un environnement octaédrique déformé ( groupe ponctuel C 4v ) d'un ion oxyde et de 5 molécules d'eau. Le titane, TiO 2+ , a une structure similaire. On pense que le vanadium(V) existe sous forme d'ion dioxo [VO 2 (H 2 O) 4 ] + à un pH inférieur à 2, mais la preuve de cet ion dépend de la formation de complexes, tels que des complexes d' oxalate qui ont été montré avoir le VO+
2unité, avec des liaisons cis -VO, à l'état solide. L' ion chrome (IV) [CrO(H 2 O) 5 ] 2+ , similaire à l'ion vanadium a été proposé sur la base de preuves indirectes.
L'ion uranyle, UO2+
2, a une structure trans . L'aqua-ion UO2+
2(aq) a été supposé, sur la base de preuves indirectes, avoir cinq molécules d'eau dans le plan perpendiculaire à l'axe OUO dans une structure bipyramide pentagonale , groupe ponctuel D 5h . Cependant il est également possible qu'il y ait 6 molécules d'eau dans le plan équatorial, bipyramide hexagonale , groupe ponctuel D 6h , car de nombreux complexes avec cette structure sont connus. L'état de solvatation de l' ion plutonyle , PuO2+
2, n'est pas connu.
Thermodynamique
L'objectif principal de la thermodynamique dans ce contexte est de dériver des estimations de quantités thermodynamiques d'ions uniques telles que l' enthalpie d' hydratation et l' entropie d' hydratation . Ces quantités se rapportent à la réaction
- M z+ (gaz) + solvant → M z+ (en solution)
L'enthalpie de cette réaction n'est pas directement mesurable, car toutes les mesures utilisent des solutions salines qui contiennent à la fois des cations et des anions. La plupart des mesures expérimentales portent sur la chaleur dégagée lorsqu'un sel se dissout dans l'eau, ce qui donne la somme des enthalpies de solvatation des cations et des anions. Ensuite, en considérant les données pour différents anions avec le même cation et différents cations avec le même anion, des valeurs d'ions uniques par rapport à un zéro arbitraire sont dérivées.
Enthalpie d'hydratation standard d'ion unique /kJ mol −1 Li +
-514,6Être 2+
-2487,0Na +
-404,6Mg 2+
-1922,1Al 3+
-4659,7K +
-320,9Ca 2+
-1592.4Sc 3+
-3960.2... Ga 3+
-4684,8Rb +
-296.2Sr 2+
-1444.7Oui 3+
-3620,0... En 3+
-4108.7Sn 2+
-1554,4Cs +
-263,2Ba 2+
-1303,7La 3+
-3282,8... Tl 3+
-4184,0Pb 2+
-1479.9
Les autres valeurs incluent Zn 2+ -2044,3, Cd 2+ -1805,8 et Ag + -475,3 kJ mol -1 .
Il existe une excellente corrélation linéaire entre l'enthalpie d'hydratation et le rapport de la charge au carré, z 2 , à la distance MO, r eff .
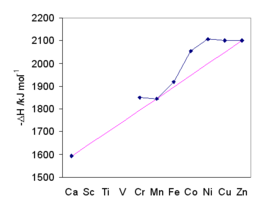
Les valeurs des métaux de transition sont affectées par la stabilisation du champ cristallin . La tendance générale est représentée par la raie magenta qui passe par Ca 2+ , Mn 2+ et Zn 2+ , pour lesquels il n'y a pas de stabilisation dans un champ cristallin octaédrique. L'énergie d'hydratation augmente à mesure que la taille diminue. La division du champ cristallin confère une stabilité supplémentaire à l'ion aquatique. L'énergie maximale de stabilisation du champ cristallin se produit à Ni 2+ . L'accord des enthalpies d'hydratation avec les prédictions a fourni une base pour l'acceptation générale de la théorie des champs cristallins.
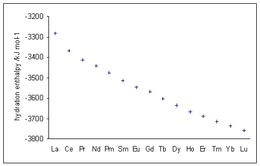
Les enthalpies d'hydratation des ions lanthanides trivalents montrent des valeurs de plus en plus négatives à l'augmentation du numéro atomique, en ligne avec la diminution du rayon ionique connue sous le nom de contraction des lanthanides .
L'entropie d'hydratation d'un seul ion peut être dérivée. Les valeurs sont indiquées dans le tableau suivant. Plus la valeur est négative, plus il y a d'ordre dans la formation de l'ion aquatique. Il est à noter que les métaux alcalins lourds ont des valeurs d'entropie plutôt faibles, ce qui suggère que les première et deuxième couches de solvatation sont quelque peu indistinctes.
Entropie d'hydratation standard à ion unique à 25 °C /J deg −1 mol −1 Li +
-118,8Na +
-87,4Mg 2+
-267.8Al 3+
-464,4K +
-51,9Ca 2+
-209,2... Ga 3+
-510,4Rb +
-40,2Sr 2+
-205,0... En 3+
-426.8Cs +
-36,8Ba 2+
-159,0La 3+
-368.2...
Hydrolyse des ions aquatiques
Il existe deux manières d'envisager un équilibre impliquant l'hydrolyse d'un ion aquatique. Considérant l'équilibre de dissociation
- [M(H 2 O) n ] z+ - H + ⇌ [M(H 2 O) n-1 (OH)] (z-1)+
l' activité du produit d'hydrolyse, en omettant les molécules d'eau, est donnée par
L'alternative est d'écrire l'équilibre comme une réaction de complexation ou de substitution
- [M(H 2 O) n ] z+ +OH − ⇌ :[M(H 2 O) n-1 (OH)] (z-1)+ + H 2 O
Dans quel cas
La concentration d'ions hydrogène et hydroxyde est liée par l' auto-ionisation de l'eau , K w = {H + } {OH − } donc les deux constantes d'équilibre sont liées comme
En pratique, la première définition est plus utile car les constantes d'équilibre sont déterminées à partir des mesures des concentrations en ions hydrogène. En général,
les redevances sont omises par souci de généralité et les activités ont été remplacées par des concentrations. sont des constantes d'hydrolyse cumulatives .
La modélisation des réactions d'hydrolyse qui se produisent en solution est généralement basée sur la détermination de constantes d'équilibre à partir de données de titrage potentiométriques (pH). Le processus est loin d'être simple pour diverses raisons. Parfois, les espèces en solution peuvent être précipitées sous forme de sels et leur structure confirmée par cristallographie aux rayons X. Dans d'autres cas, les sels précipités n'ont aucun rapport avec ce qui est supposé être en solution, car une substance cristalline particulière peut avoir à la fois une faible solubilité et une très faible concentration dans les solutions.
Première constante d'hydrolyse
Le logarithme de la constante d'hydrolyse, K 1,-1 , pour l'élimination d'un proton d'un ion aquatique
- [M(H 2 O) n ] z+ - H + ⇌ [M(H 2 O) n-1 (OH)] (z-1)+
- [ [M(OH)] {(z-1)+ ] = K 1,-1 [M z+ ] [H + ] -1
montre une relation linéaire avec le rapport entre la charge et la distance MO, z/d. Les ions se répartissent en quatre groupes. La pente de la droite est la même pour tous les groupes, mais l'intersection A est différente.
log K 1,-1 = A + 11,0 z/d cation UNE Mg 2+ , Ca 2+ , Sr 2+ , Ba 2+
Al 3+ , Y 3+ , La 3+−22,0 ± 0,5 Li + , Na + , K +
Be 2+ , Mn 2+ , Fe 2+ , Co 2+ , Ni 2+ , Cu 2+ , Zn 2+ , Cd 2+
Sc 3+ , Ti 3+ , V 3+ , Cr 3+ , Fe 3+ , Rh 3+ , Ga 3+ , In 3+
Ce 4+ , Th 4+ , Pa 4+ , U 4+ , Np 4+ , Pu 4+ ,−19,8 ± 1 Ag + , Tl +
Pb 2+
Ti 3+ , Bi 3+ ,−15,9 ± 1 Sn 2+ , Hg 2+ , Sn 2+ , Pd 2+ Californie. 12
Les cations les plus résistants à l'hydrolyse pour leur taille et leur charge sont les ions métalliques durs de pré-transition ou les ions lanthanides. Le groupe légèrement moins résistant comprend les ions de métaux de transition. Le troisième groupe contient principalement des ions mous de métaux de post-transition. Les ions qui montrent la plus forte tendance à s'hydrolyser pour leur charge et leur taille sont Pd 2+ , Sn 2+ et Hg 2+ .
La variation d'enthalpie standard pour la première étape d'hydrolyse n'est généralement pas très différente de celle de la dissociation de l'eau pure. Par conséquent, le changement d'enthalpie standard pour la réaction de substitution
- [M(H 2 O) n ] z+ +OH − ⇌ :[M(H 2 O) n-1 (OH)] (z-1)+ + H 2 O
est proche de zéro. Ceci est typique des réactions entre un cation dur et un anion dur, tel que l'ion hydroxyde. Cela signifie que la charge d'entropie standard est le principal contributeur au changement d'énergie libre standard et donc à la constante d'équilibre.
Le changement de charge ionique est responsable de l'effet car l'ion aqua a un effet d'ordre plus important sur la solution que le complexe hydroxo moins fortement chargé.
Réactions d'hydrolyse multiples
L'hydrolyse du béryllium présente de nombreuses caractéristiques typiques des réactions d'hydrolyse multiples. Les concentrations de diverses espèces, y compris les espèces polynucléaires avec ponts en ions hydroxyde, évoluent en fonction du pH jusqu'à la précipitation d'un hydroxyde insoluble. L'hydrolyse du béryllium est inhabituelle en ce que la concentration de [Be(H 2 O) 3 (OH)] + est trop faible pour être mesurée. Au lieu de cela, un trimère ([Be 3 (H 2 O) 6 (OH 3 )) 3+ est formé, dont la structure a été confirmée dans les sels solides. La formation d'espèces polynucléaires est entraînée par la réduction de la densité de charge au sein de la molécule dans son ensemble. L'environnement local des ions béryllium se rapproche de [Be(H 2 O) 2 (OH) 2 ] + . La diminution de la charge effective libère de l'énergie libre sous la forme d'une diminution de l'entropie d'ordre aux centres de charge.
Certains produits d'hydrolyse polynucléaire Formule de l'espèce cations structure M 2 (OH) + Be 2+ , Mn 2+ , Co 2+ , Ni 2+
Zn 2+ , Cd 2+ , Hg 2+ , Pb 2+pont hydroxyde unique entre deux cations M 2 (OH)(2z-2)+
2Cu 2+ , Sn 2+
Al 3+ , Sc 3+ , Ln 3+ , Ti 3+ , Cr 3+
Th 4+
VO 2+ , UO2+
2, NpO2+
2, PuO2+
2double pont hydroxyde entre deux cations M
3(OH)3+
3Être 2+ , Hg 2+ cycle à six chaînons avec des groupes alternés M n+ et OH − M
3(OH)(3z-4)+
4Sn 2+ , Pb 2+
Al 3+ , Cr 3+ , Fe 3+ , In 3+Cube avec sommets alternés des groupes M n+ et OH − , un sommet manquant M
4(OH)4+
4Mg 2+ , Co 2+ , Ni 2+ , Cd 2+ , Pb 2+ Cube à sommets alternés des groupes M n+ et OH − M
4(OH)8+
8Zr 4+ , Th 4+ Carré d' ions M n+ avec doubles ponts hydroxyde de chaque côté du carré
Le produit d'hydrolyse de l' aluminium formulé sous la forme [Al 13 O 4 (OH) 24 (H 2 O) 12 ] 7+ est très bien caractérisé et peut être présent dans la nature dans l'eau à pH ca. 5.4.
La réaction globale pour la perte de deux protons d'un ion aquatique peut être écrite comme
- [M(H 2 O) n ] z+ - 2 H + ⇌ [M(H 2 O) n-2 (OH) 2 ] (z-2)+
Cependant, la constante d'équilibre pour la perte de deux protons s'applique aussi bien à l'équilibre
- [M(H 2 O) n ] z+ - 2 H + ⇌ [MO(H 2 O) n-2 ] (z-2)+ + H 2 O
car la concentration de l'eau est supposée constante. Ceci s'applique en général : toute constante d'équilibre est aussi valable pour un produit avec un ion oxyde que pour le produit avec deux ions hydroxyle. Les deux possibilités ne peuvent être distinguées qu'en déterminant la structure d'un sel à l'état solide. Les ponts oxo ont tendance à se produire lorsque l'état d'oxydation du métal est élevé. Un exemple est fourni par le complexe de molybdène (IV) [Mo 3 O 4 (H 2 O) 9 ] 4+ dans lequel il y a un triangle d'atomes de molybdène reliés par des liaisons σ- avec un pont d'oxyde sur chaque bord du triangle et un quatrième oxyde qui relie les trois atomes de Mo.
Oxyanoions
Il y a très peu d'ions oxo-aqua de métaux à l'état d'oxydation +5 ou plus. Au lieu de cela, les espèces trouvées en solution aqueuse sont des oxyanions monomères et polymères. Les oxyanions peuvent être considérés comme les produits finaux de l'hydrolyse, dans laquelle il n'y a pas de molécules d'eau attachées au métal, seulement des ions oxyde.
Cinétique d'échange
Une molécule d'eau dans la première couche de solvatation d'un ion aquatique peut échanger des places avec une molécule d'eau dans le solvant en vrac. On suppose généralement que l' étape déterminant la vitesse est une réaction de dissociation .
- [M(H 2 O) n ] z+ → [M(H 2 O) n-1 ] z+ * + H 2 O
Le symbole * signifie qu'il s'agit de l' état de transition dans une réaction chimique. La vitesse de cette réaction est proportionnelle à la concentration de l'ion aquatique, [A].
- .
La constante de proportionnalité, k , est appelée constante de vitesse du premier ordre à la température T. L'unité de la vitesse de réaction pour l'échange d'eau est généralement prise comme mol dm -3 s -1 .
La demi-vie de cette réaction est égale à log e 2 / k. Cette quantité à la dimension du temps est utile car elle est indépendante de la concentration. La quantité 1/k, également dimensionnée dans le temps, égale à la demi-vie divisée par 0,6932, est appelée temps de séjour ou constante de temps .
Le temps de séjour pour l'échange d'eau varie d'environ 10 -10 s pour Cs + à environ 10 +10 s (plus de 200 y ) pour Ir 3+ . Cela dépend de facteurs tels que la taille et la charge de l'ion et, dans le cas des ions de métaux de transition, des effets de champ cristallin . Les réactions très rapides et très lentes sont difficiles à étudier. La plupart des informations sur la cinétique d'un échange d'eau proviennent de systèmes avec un temps de séjour compris entre environ 1 s et 1 s. L'enthalpie et l'entropie d'activation, ΔH ‡ et ΔS ‡ peuvent être obtenues en observant la variation de la constante de vitesse avec la température.
Paramètres cinétiques (à 25 °C) pour l'échange d'eau : ions divalents, M 2+ (aq) Être mg V Cr Mn Fe Co Ni Cu Zn UO 2 Temps de séjour (μs) 0,001 2 0,00013 0,0032 0,0316 0,32 0,79 40 0,0005 0,032 1.3 H ‡ (kJ mol −1 ) 43 69 13 34 32 33 43 23 S ‡ (J deg −1 mol −1 ) 8 21 -13 12 -13 -17 -22 25
Notez l'augmentation générale du temps de séjour du vanadium au nickel, qui reflète la diminution de la taille des ions avec l'augmentation du nombre atomique, qui est une tendance générale dans le tableau périodique , bien qu'on lui donne un nom spécifique uniquement dans le cas de la contraction des lanthanides . Les effets de l' énergie de stabilisation du champ cristallin se superposent à la tendance périodique.
Paramètres cinétiques (à 25 °C) pour l'échange d'eau - ions trivalents, M 3+ (aq) Al Ti Cr Fe Géorgie Rhésus Dans La temps de séjour (μs) 6,3×10 6 16 2.0×10 12 316 501 3.2×10 13 50 0,050 H ‡ (kJ mol −1 ) 11 26 109 37 26 134 17 S ‡ (J deg −1 mol −1 ) 117 -63 0 -54 -92 59
L'échange de solvant est généralement plus lent pour les ions trivalents que pour les ions divalents, car la charge électrique plus élevée sur le cation crée des liaisons M-OH 2 plus fortes et, par conséquent, une énergie d'activation plus élevée pour l'étape de réaction dissociative, [M(H 2 O) n ] 3+ → [M(H 2 O) n-1 ] 3+ + H 2 O. Les valeurs du tableau montrent que cela est dû à la fois aux facteurs d'enthalpie d'activation et d'entropie.
L'ion [Al(H 2 O) 6 ] 3+ est relativement inerte aux réactions de substitution car ses électrons sont effectivement dans une configuration électronique à couche fermée, [Ne] 3s 2 3p 6 , faisant de la dissociation une réaction coûteuse en énergie. Cr 3+ , qui a une structure octaédrique et une configuration électronique ad 3 est également relativement inerte, tout comme Rh 3+ et Ir 3+ qui ont une configuration à faible spin d 6 .
Formation de complexes
Les ions métalliques aquatiques sont souvent impliqués dans la formation de complexes . La réaction peut s'écrire
- pM x+ (aq) + qL y− → [M p L q ] (px-qy)+
En réalité, il s'agit d'une réaction de substitution dans laquelle une ou plusieurs molécules d'eau de la première couche d'hydratation de l'ion métallique sont remplacées par des ligands, L. Le complexe est décrit comme un complexe de sphère interne. Un complexe tel que [ML] (pq)+ peut être décrit comme une paire d'ions de contact .
Lorsque la ou les molécules d'eau de la deuxième couche d'hydratation sont remplacées par des ligands, le complexe est dit être un complexe de sphère externe ou une paire d'ions partagée par le solvant. La formation de paires d'ions partagés avec le solvant ou de contact est particulièrement pertinente pour la détermination des nombres de solvatation des ions aquatiques par des méthodes qui nécessitent l'utilisation de solutions concentrées de sels, car l'appariement des ions dépend de la concentration. Considérons par exemple la formation du complexe [MgCl] + dans les solutions de MgCl 2 . La constante de formation K du complexe est d'environ 1 mais varie avec la force ionique. La concentration du complexe plutôt faible passe d'environ 0,1% pour une solution 10mM à environ 70% pour une solution 1M (1M = 1 mol dm -3 ).
Électrochimie
Le potentiel d'électrode standard pour l'équilibre de la demi-cellule M z+ + z e − ⇌ M( s ) a été mesuré pour tous les métaux à l'exception des éléments transuraniens les plus lourds.
Potentiels d'électrode standard /V pour les couples M z+ /M(s) H +
0Li +
−3.040Être 2+
−1.85Na +
-2,71Mg 2+
−2,372Al 3+
-1,66K +
−2.931Ca 2+
−2,868Sc 3+
-2,90... Zn 2+
−0,751Ga 3+
−0,53Ge 2+
+0.1Rb +
-2,98Sr 2+
−2.899Y 3+
-2,37... Cd 2+
−0.403En 3+
−0.342Sn 2+
−0.136Sb 3+
+0.15Cs +
−3.026Ba 2+
−2.912Lu 3+
−2.25... Hg 2+
-0,854Tl 3+
+0,73Pb 2+
−0,126Bi 3+
+0.16Po 4+
+0,76Fr +
−2.9Ra 2+
-2,8Lr 3+
-1,96La 3+
−2,52Ce 3+
−2.32Pr 3+
-2,34Sd 3+
−2,32Pm 3+
-2,30Sm 3+
-2,28Eu 3+
-1,98Gd 3+
−2.27Tb 3+
-2,27Jour 3+
−2,32Ho 3+
-2,37Er 3+
−2.33Tm 3+
-2,30Yb 3+
-2,23Ac 3+
-2,18Th 4+
−1.83Pa 4+
-1,46U 4+
−1,51Np 4+
−1.33Pu 4+
-1,80Suis 3+
-2,06cm 3+
-2,07Bk 3+
−2.03Cf 3+
-2,01Es 3+
-1,99FM 3+
-1,97Md 3+
-1,65Non 3+
-1,20
Potentiels d'électrode standard /V pour le 1er. rangée d'ions de métaux de transition Coupler Ti V Cr Mn Fe Co Ni Cu M 2+ / M −1.63 -1,18 -0,91 -1,18 -0,473 −0.28 −0.228 +0.345 M 3+ / M −1.37 -0,87 −0.74 −0.28 −0,06 +0.41
Divers potentiels d'électrodes standards /V Ag + / Ag Pd 2+ / Pd Point 2+ / Point Zr 4+ / Zr Hf 4+ / Hf Au 3+ / Au Ce 4+ / Ce +0.799 +0.915 +1.18 −1.53 -1,70 +1.50 −1.32
Comme le potentiel de l'électrode standard est plus négatif, l'ion aquatique est plus difficile à réduire . Par exemple, en comparant les potentiels du zinc (-0,75 V) avec ceux du fer (Fe(II) -0,47 V, Fe(III) -0,06 V), on constate que les ions fer sont plus facilement réduits que les ions zinc. C'est la base de l'utilisation du zinc pour la protection anodique de grandes structures en fer ou pour la protection de petites structures par galvanisation .
Les références
Bibliographie
- Baes, FC ; Mesmer, RE (1986) [1976]. L'hydrolyse des cations . Malabar, Floride : Robert E. Krieger. ISBN 978-0-89874-892-5.
- Burgess, John (1978). Ions métalliques en solution . Chichester : Ellis Horwood. ISBN 978-0-85312-027-8.
- Richens, David. T. (1997). La chimie des ions aquatiques . Wiley. ISBN 978-0-471-97058-3.
- Stumm, Werner ; Morgan, James J. (1995). Chimie aquatique - Équilibres chimiques et taux dans les eaux naturelles (3e éd.). Wiley-Blackwell. ISBN 978-0-471-51185-4.
- Schweitzer, George K. ; Pesterfield, Lester L. (2010). La chimie aqueuse des éléments . Oxford : OUP. ISBN 978-0-19-539335-4.
Lectures complémentaires
- HL Friedman, F. Franks, Solutions aqueuses d'électrolytes simples, Springer; réimpression de l'édition 1973, 2012 ISBN 1468429574






![{\displaystyle \{[{\ce {M(OH)}}]^{(z-1)+}\}=K_{1,-1}\{{\ce {M}}^{z+}\ }\{{\ce {H}}^{+}\}^{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e176d25b98e44f238e312388c7778c2dd0da6fa5)
![{\displaystyle \{[{\ce {M(OH)}}]^{(z-1)+}\}=K_{1,1}\{{\ce {M}}^{z+}\} \{{\ce {OH}}^{-}\}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fd140779b1efcea8279dd45e357bccbb9703423e)

![{\displaystyle [{\ce {M}}_{x}({\ce {OH}})_{y}]=\beta _{x,-y}*[{\ce {M}}]^ {x}[{\ce {H}}]^{-y}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a0f51eff3529039469fab7a042189cb722207509)




![{\mathrm {rate}}=-\left({\frac {d[A]}{dt}}\right)_{T}=k[A]](https://wikimedia.org/api/rest_v1/media/math/render/svg/b55c4231b71d8a68c7ed0c741392e23a2ae8c18b)