Méthane -Methane

|
|||
|
|
|||
| Des noms | |||
|---|---|---|---|
|
Nom IUPAC préféré
Méthane |
|||
|
Nom IUPAC systématique
Carbane (jamais recommandé) |
|||
| Autres noms | |||
| Identifiants | |||
|
Modèle 3D ( JSmol )
|
|||
| 3DMet | |||
| 1718732 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Carte d'information de l'ECHA | 100.000.739 | ||
| Numéro CE | |||
| 59 | |||
| KEGG | |||
| Engrener | Méthane | ||
|
CID PubChem
|
|||
| Numéro RTECS | |||
| UNII | |||
| Numéro ONU | 1971 | ||
|
Tableau de bord CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriétés | |||
| C H 4 | |||
| Masse molaire | 16,043 g · mol -1 | ||
| Apparence | Gaz incolore | ||
| Odeur | Inodore | ||
| Densité | |||
| Point de fusion | −182,456 ° C (−296,421 ° F; 90,694 K) | ||
| Point d'ébullition | −161,5 ° C (−258,7 ° F; 111,6 K) | ||
| Point critique ( T , P ) | 190,56 K, 4,5992 MPa | ||
| 22,7 mg·L −1 | |||
| Solubilité | Soluble dans l' éthanol , l'éther diéthylique , le benzène , le toluène , le méthanol , l'acétone et insoluble dans l'eau | ||
| journal P | 1.09 | ||
|
Constante de la loi de Henry ( k H ) |
14 nmol·Pa −1 ·kg −1 | ||
| Acide conjugué | Méthanium | ||
| Base conjuguée | Anion méthyle | ||
| −17,4 × 10 −6 cm 3 ·mol −1 | |||
| Structure | |||
| T d | |||
| Tétraèdre | |||
| 0 D | |||
| Thermochimie | |||
|
Capacité calorifique ( C )
|
35,7 J·(K·mol) −1 | ||
|
Entropie molaire standard ( S |
186,3 J·(K·mol) −1 | ||
|
Enthalpie standard de
formation (Δ f H ⦵ 298 ) |
−74,6 kJ·mol −1 | ||
|
Énergie libre de Gibbs (Δ f G ˚)
|
−50,5 kJ·mol −1 | ||
|
Enthalpie de
combustion standard (Δ c H ⦵ 298 ) |
−891 kJ·mol −1 | ||
| Dangers | |||
| Étiquetage SGH : | |||

|
|||
| Danger | |||
| H220 | |||
| P210 | |||
| NFPA 704 (diamant de feu) | |||
| point de rupture | −188 ° C (−306,4 ° F; 85,1 K) | ||
| 537 ° C (999 ° F; 810 K) | |||
| Limites explosives | 4,4–17 % | ||
| Composés apparentés | |||
|
Alcanes apparentés
|
|||
| Page de données supplémentaires | |||
| Méthane (page de données) | |||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa).
|
|||
Le méthane ( US : / ˈ m ɛ θ eɪ n / , UK : / ˈ m iː θ eɪ n / ) est un composé chimique de formule chimique CH 4 (un atome de carbone lié à quatre atomes d'hydrogène ). C'est un hydrure du groupe 14 , l' alcane le plus simple et le principal constituant du gaz naturel . La relative abondance du méthane sur Terre en fait un combustible économiquement intéressant , bien que sa capture et son stockage posent des défis techniques en raison de son état gazeux dans des conditions normales de température et de pression .
Le méthane d'origine naturelle se trouve à la fois sous le sol et sous le fond marin et est formé par des processus géologiques et biologiques. Le plus grand réservoir de méthane se trouve sous le fond marin sous la forme de clathrates de méthane . Lorsque le méthane atteint la surface et l' atmosphère , on parle de méthane atmosphérique . La concentration atmosphérique de méthane de la Terre a augmenté d'environ 150 % depuis 1750 et représente 20 % du forçage radiatif total de tous les gaz à effet de serre à longue durée de vie et mélangés à l'échelle mondiale . Il a également été détecté sur d'autres planètes, dont Mars , ce qui a des implications pour la recherche en astrobiologie .
Propriétés et collage
Le méthane est une molécule tétraédrique avec quatre liaisons C–H équivalentes . Sa structure électronique est décrite par quatre orbitales moléculaires (MO) de liaison résultant du chevauchement des orbitales de valence sur C et H . Le MO de plus basse énergie est le résultat du chevauchement de l'orbitale 2s sur le carbone avec la combinaison en phase des orbitales 1s sur les quatre atomes d'hydrogène. Au-dessus de ce niveau d'énergie se trouve un ensemble triplement dégénéré de MO qui impliquent un chevauchement des orbitales 2p sur le carbone avec diverses combinaisons linéaires des orbitales 1s sur l'hydrogène. Le schéma de liaison "trois sur un" résultant est cohérent avec les mesures spectroscopiques photoélectroniques.
Le méthane est un gaz inodore et semble incolore. Il absorbe la lumière visible, en particulier à l'extrémité rouge du spectre en raison des bandes harmoniques , mais l'effet n'est perceptible que si le trajet lumineux est très long. C'est ce qui donne à Uranus et à Neptune leurs couleurs bleues ou vert bleuté, car la lumière traverse leurs atmosphères contenant du méthane et est ensuite rediffusée.
L'odeur familière du gaz naturel tel qu'il est utilisé dans les maisons est obtenue par l'ajout d'un odorant , généralement des mélanges contenant du tert-butylthiol , par mesure de sécurité. Le méthane a un point d'ébullition de -161,5 °C à une pression d'une atmosphère . En tant que gaz, il est inflammable sur une gamme de concentrations (5,4 à 17 %) dans l'air à la pression standard .
Le méthane solide existe sous plusieurs formes . Actuellement neuf sont connus. Le refroidissement du méthane à pression normale entraîne la formation de méthane I. Cette substance cristallise dans le système cubique ( groupe d'espace Fm 3 m). Les positions des atomes d'hydrogène ne sont pas fixes dans le méthane I, c'est-à-dire que les molécules de méthane peuvent tourner librement. Il s'agit donc d'un cristal plastique .
Réactions chimiques
Les principales réactions chimiques du méthane sont la combustion , le reformage à la vapeur en gaz de synthèse et l' halogénation . En général, les réactions du méthane sont difficiles à contrôler.
Oxydation sélective
L' oxydation partielle du méthane en méthanol , un carburant liquide plus pratique, est difficile car la réaction progresse généralement jusqu'au dioxyde de carbone et à l'eau , même avec un apport insuffisant en oxygène . L' enzyme méthane monooxygénase produit du méthanol à partir du méthane, mais ne peut pas être utilisée pour des réactions à l'échelle industrielle. Certains systèmes à catalyse homogène et systèmes hétérogènes ont été développés, mais tous présentent des inconvénients importants. Ceux-ci fonctionnent généralement en générant des produits protégés à l'abri de la suroxydation. Les exemples incluent le système Catalytica , les zéolites de cuivre et les zéolites de fer stabilisant le site actif alpha-oxygène .
Un groupe de bactéries catalyse l'oxydation du méthane avec le nitrite comme oxydant en l'absence d' oxygène , donnant lieu à ce que l'on appelle l'oxydation anaérobie du méthane .
Réactions acido-basiques
Comme les autres hydrocarbures , le méthane est un acide extrêmement faible . Son pKa dans le DMSO est estimé à 56. Il ne peut pas être déprotoné en solution, mais la base conjuguée est connue sous des formes telles que le méthyllithium .
Une variété d' ions positifs dérivés du méthane ont été observés, principalement en tant qu'espèces instables dans des mélanges de gaz à basse pression. Ceux-ci incluent le méthénium ou le cation méthyle CH+
3, cation méthane CH+
4, et le méthanium ou méthane protoné CH+
5. Certains d'entre eux ont été détectés dans l'espace extra-atmosphérique . Le méthanium peut également être produit sous forme de solutions diluées à partir de méthane avec des superacides . Cations avec une charge plus élevée, comme CH2+
6et CH3+
7, ont été étudiées théoriquement et supposées stables.
Malgré la force de ses liaisons C–H, il existe un intérêt intense pour les catalyseurs qui facilitent l'activation des liaisons C–H dans le méthane (et d'autres alcanes de nombre inférieur ).
La combustion
La chaleur de combustion du méthane est de 55,5 MJ/kg. La combustion du méthane est une réaction en plusieurs étapes résumée comme suit :
La chimie en quatre étapes de Peters est une chimie en quatre étapes systématiquement réduite qui explique la combustion du méthane.
Réactions radicalaires du méthane
Dans des conditions appropriées, le méthane réagit avec les radicaux halogène comme suit :
- X• + CH 4 → HX + CH 3 •
- CH 3 • + X 2 → CH 3 X + X•
où X est un halogène : fluor (F), chlore (Cl), brome (Br), ou iode (I). Ce mécanisme de ce processus est appelé halogénation radicalaire . Il est initié lorsque la lumière UV ou un autre initiateur radicalaire (comme les peroxydes ) produit un atome d' halogène . Une réaction en chaîne en deux étapes s'ensuit dans laquelle l'atome d'halogène extrait un atome d'hydrogène d'une molécule de méthane, entraînant la formation d'une molécule d'halogénure d'hydrogène et d'un radical méthyle (CH 3 •). Le radical méthyle réagit alors avec une molécule d'halogène pour former une molécule d'halométhane, avec un nouvel atome d'halogène comme sous-produit. Des réactions similaires peuvent se produire sur le produit halogéné, conduisant au remplacement d'atomes d'hydrogène supplémentaires par des atomes d'halogène par des structures dihalométhane , trihalométhane et, finalement, tétrahalométhane , en fonction des conditions de réaction et du rapport halogène sur méthane.
Les usages
Le méthane est utilisé dans les procédés chimiques industriels et peut être transporté sous forme de liquide réfrigéré (gaz naturel liquéfié ou GNL ). Alors que les fuites d'un récipient de liquide réfrigéré sont initialement plus lourdes que l'air en raison de la densité accrue du gaz froid, le gaz à température ambiante est plus léger que l'air. Les gazoducs distribuent de grandes quantités de gaz naturel, dont le méthane est le principal composant.
Le carburant
Le méthane est utilisé comme combustible pour les fours, les maisons, les chauffe-eau, les fours, les automobiles, les turbines, etc. Le charbon actif est utilisé pour stocker le méthane. Le méthane liquide raffiné est utilisé comme carburant de fusée , lorsqu'il est combiné avec de l'oxygène liquide , comme dans les moteurs BE-4 et Raptor .
En tant que principal constituant du gaz naturel , le méthane est important pour la production d' électricité en le brûlant comme combustible dans une turbine à gaz ou un générateur de vapeur . Comparé à d'autres combustibles hydrocarbonés , le méthane produit moins de dioxyde de carbone pour chaque unité de chaleur dégagée. À environ 891 kJ/mol, la chaleur de combustion du méthane est inférieure à celle de tout autre hydrocarbure. Cependant, il produit plus de chaleur par masse (55,7 kJ/g) que toute autre molécule organique en raison de sa teneur relativement importante en hydrogène, qui représente 55 % de la chaleur de combustion mais ne contribue qu'à 25 % de la masse moléculaire du méthane. Dans de nombreuses villes, le méthane est canalisé dans les maisons pour le chauffage domestique et la cuisine. Dans ce contexte, il est généralement connu sous le nom de gaz naturel , qui est considéré comme ayant une teneur énergétique de 39 mégajoules par mètre cube, ou 1 000 BTU par pied cube standard . Le gaz naturel liquéfié (GNL) est principalement du méthane (CH 4 ) converti sous forme liquide pour faciliter le stockage ou le transport.
En tant que carburant de fusée liquide , le méthane offre l'avantage par rapport au kérosène de produire de petites molécules d'échappement. Cela dépose moins de suie sur les pièces internes des moteurs-fusées, ce qui réduit la difficulté de réutilisation des boosters. Le poids moléculaire inférieur de l'échappement augmente également la fraction de l'énergie thermique qui se présente sous la forme d'énergie cinétique disponible pour la propulsion, augmentant l' impulsion spécifique de la fusée. Le méthane liquide a également une plage de température (91–112 K) presque compatible avec l'oxygène liquide (54–90 K).
Matière première chimique
Le gaz naturel , composé majoritairement de méthane, est utilisé pour produire de l'hydrogène gazeux à l'échelle industrielle. Le reformage du méthane à la vapeur (SMR), ou simplement connu sous le nom de reformage à la vapeur, est la méthode industrielle standard de production d'hydrogène gazeux en vrac commercial. Plus de 50 millions de tonnes métriques sont produites annuellement dans le monde (2013), principalement à partir du SMR du gaz naturel. Une grande partie de cet hydrogène est utilisée dans les raffineries de pétrole , dans la production de produits chimiques et dans la transformation des aliments. De très grandes quantités d'hydrogène sont utilisées dans la synthèse industrielle de l'ammoniac .
A haute température (700-1100 °C) et en présence d'un catalyseur à base de métal ( le nickel ), la vapeur réagit avec le méthane pour donner un mélange de CO et de H 2 , appelé « water gas » ou « syngas » :
Cette réaction est fortement endothermique (consomme de la chaleur, Δ H r = 206 kJ/mol). L'hydrogène supplémentaire est obtenu par la réaction du CO avec l'eau via la réaction de conversion eau-gaz :
- CO + H 2 O ⇌ CO 2 + H 2
Cette réaction est légèrement exothermique (produit de la chaleur, Δ H r = -41 kJ/mol).
Le méthane est également soumis à une chloration radicalaire dans la production de chlorométhanes, bien que le méthanol soit un précurseur plus typique.
Génération
Routes géologiques
Les deux principales voies de génération de méthane géologique sont (i) organique (généré thermiquement ou thermogénique) et (ii) inorganique ( abiotique ). Le méthane thermogénique se produit en raison de la décomposition de la matière organique à des températures et des pressions élevées dans les couches sédimentaires profondes . La plupart du méthane dans les bassins sédimentaires est thermogénique ; par conséquent, le méthane thermogénique est la source la plus importante de gaz naturel. Les composants thermogéniques du méthane sont généralement considérés comme des reliques (d'une époque antérieure). Généralement, la formation de méthane thermogénique (en profondeur) peut se produire par rupture de matière organique ou synthèse organique. Les deux voies peuvent impliquer des micro-organismes ( méthanogénèse ), mais peuvent également se produire de manière inorganique. Les processus impliqués peuvent également consommer du méthane, avec et sans micro-organismes.
La source la plus importante de méthane en profondeur (roche mère cristalline) est abiotique. Abiotique signifie que le méthane est créé à partir de composés inorganiques, sans activité biologique, soit par des processus magmatiques, soit par des réactions eau-roche qui se produisent à basses températures et pressions, comme la serpentinisation .
Itinéraires biologiques
La majeure partie du méthane de la Terre est biogénique et est produite par méthanogenèse , une forme de respiration anaérobie connue uniquement pour être menée par certains membres du domaine Archaea . Les méthanogènes occupent les décharges et autres sols , les ruminants (par exemple, le bétail ), les entrailles des termites et les sédiments anoxiques sous le fond marin et le fond des lacs. Les rizières génèrent également de grandes quantités de méthane pendant la croissance des plantes. Ce processus en plusieurs étapes est utilisé par ces micro-organismes pour l'énergie. La réaction nette de la méthanogenèse est :
- CO 2 + 4 H 2 → CH 4 + 2 H 2 O
La dernière étape du processus est catalysée par l'enzyme méthyl coenzyme M réductase (MCR).

Ruminants
Les ruminants, comme les bovins, crachent du méthane, ce qui représente environ 22 % des émissions annuelles de méthane dans l'atmosphère aux États-Unis. Une étude a rapporté que le secteur de l'élevage en général (principalement les bovins, les poulets et les porcs) produit 37 % de tout le méthane d'origine humaine. Une étude de 2013 a estimé que le bétail représentait 44% du méthane d'origine humaine et environ 15% des émissions de gaz à effet de serre d'origine humaine. De nombreux efforts sont en cours pour réduire la production de méthane du bétail, tels que des traitements médicaux et des ajustements alimentaires, et pour piéger le gaz afin d'utiliser son énergie de combustion.
Sédiments du fond marin
La majeure partie du sous-sol est anoxique car l'oxygène est éliminé par des micro-organismes aérobies dans les premiers centimètres du sédiment . Sous le fond marin riche en oxygène, les méthanogènes produisent du méthane qui est soit utilisé par d'autres organismes, soit piégé dans des hydrates de gaz . Ces autres organismes qui utilisent le méthane comme source d'énergie sont connus sous le nom de méthanotrophes (« mangeurs de méthane ») et sont la principale raison pour laquelle peu de méthane généré en profondeur atteint la surface de la mer. Des consortiums d'archées et de bactéries se sont avérés oxyder le méthane via l'oxydation anaérobie du méthane (AOM); les organismes responsables sont les archées anaérobies méthanotrophes (ANME) et les bactéries sulfato-réductrices (SRB).
Itinéraires industriels
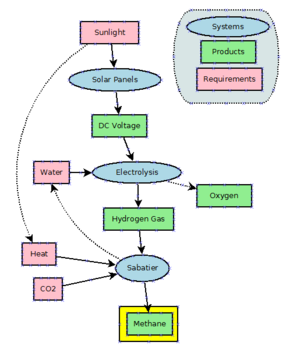
Compte tenu de son abondance bon marché en gaz naturel, il y a peu d'incitations à produire du méthane de manière industrielle. Le méthane peut être produit en hydrogénant du dioxyde de carbone par le procédé Sabatier . Le méthane est également un sous-produit de l'hydrogénation du monoxyde de carbone dans le procédé Fischer-Tropsch , qui est pratiqué à grande échelle pour produire des molécules à chaîne plus longue que le méthane.
Un exemple de gazéification à grande échelle du charbon en méthane est l' usine Great Plains Synfuels , lancée en 1984 à Beulah, dans le Dakota du Nord, dans le but de développer d'abondantes ressources locales de lignite de faible qualité , une ressource autrement difficile à transporter. son poids, sa teneur en cendres , son faible pouvoir calorifique et sa propension à la combustion spontanée pendant le stockage et le transport. Un certain nombre d'usines similaires existent dans le monde, bien que la plupart de ces usines soient destinées à la production d'alcanes à longue chaîne à utiliser comme essence , diesel ou matière première pour d'autres procédés.
Power to methane est une technologie qui utilise l'énergie électrique pour produire de l'hydrogène à partir d'eau par électrolyse et utilise la réaction de Sabatier pour combiner l'hydrogène avec le dioxyde de carbone pour produire du méthane. À partir de 2021, cela est principalement en cours de développement et non utilisé à grande échelle. Théoriquement, le processus pourrait être utilisé comme tampon pour l'électricité excédentaire et hors pointe générée par les éoliennes et les panneaux solaires très fluctuants . Cependant, comme actuellement de très grandes quantités de gaz naturel sont utilisées dans les centrales électriques (par exemple CCGT ) pour produire de l'énergie électrique, les pertes de rendement ne sont pas acceptables.
Laboratoire de synthèse
Le méthane peut être produit par protonation de méthyllithium ou d'un réactif de méthylGrignard tel que le chlorure de méthylmagnésium . Il peut également être fabriqué à partir d'acétate de sodium anhydre et d'hydroxyde de sodium sec , mélangés et chauffés au-dessus de 300 ° C (avec du carbonate de sodium comme sous-produit). Dans la pratique, une exigence de méthane pur peut facilement être satisfaite par une bouteille de gaz en acier provenant de fournisseurs de gaz standard.
Occurrence
Le méthane a été découvert et isolé par Alessandro Volta entre 1776 et 1778 lors de l'étude du gaz des marais du lac Majeur . C'est le composant majeur du gaz naturel, environ 87% en volume. La principale source de méthane est l'extraction de gisements géologiques connus sous le nom de gisements de gaz naturel , l'extraction de gaz de houille devenant une source majeure (voir extraction de méthane de houille , une méthode d'extraction du méthane d'un gisement de charbon , tandis que la récupération améliorée du méthane de houille est un méthode de récupération du méthane des veines de charbon non exploitables). Il est associé à d'autres carburants hydrocarbonés , et parfois accompagné d' hélium et d'azote . Le méthane est produit à des niveaux peu profonds (basse pression) par désintégration anaérobie de la matière organique et du méthane retravaillé depuis les profondeurs de la surface de la Terre. En général, les sédiments qui génèrent du gaz naturel sont enfouis plus profondément et à des températures plus élevées que ceux qui contiennent du pétrole .
Le méthane est généralement transporté en vrac par pipeline sous sa forme gaz naturel, ou par méthaniers sous sa forme liquéfiée ; peu de pays le transportent par camion.
Méthane atmosphérique
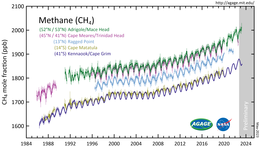
En 2010, les niveaux de méthane dans l'Arctique ont été mesurés à 1850 nmol/mol. Ce niveau est plus de deux fois plus élevé qu'à tout moment au cours des 400 000 dernières années. Les concentrations historiques de méthane dans l'atmosphère mondiale ont varié entre 300 et 400 nmol/mol pendant les périodes glaciaires communément appelées périodes glaciaires , et entre 600 et 700 nmol/mol pendant les périodes interglaciaires chaudes . Les océans de la Terre sont une source potentielle importante de méthane arctique.
Le méthane est un important gaz à effet de serre avec un potentiel de réchauffement global de 34 par rapport au CO 2 (potentiel de 1) sur une période de 100 ans, et de 72 sur une période de 20 ans.
La concentration atmosphérique de méthane de la Terre a augmenté d'environ 150 % depuis 1750 et représente 20 % du forçage radiatif total de tous les gaz à effet de serre à longue durée de vie et mélangés à l'échelle mondiale. L' AR6 du GIEC stipule : "Les augmentations observées des concentrations de gaz à effet de serre (GES) bien mélangés depuis environ 1750 sont sans équivoque causées par les activités humaines. Depuis 2011 (mesures rapportées dans l'AR5), les concentrations ont continué d'augmenter dans l'atmosphère, atteignant moyennes de 410 ppm pour le dioxyde de carbone (CO 2 ), 1866 ppb pour le méthane (CH 4 ) et 332 ppb pour le protoxyde d'azote (N 2 O) en 2019. (…) En 2019, les concentrations atmosphériques de CO 2 étaient plus élevées qu'à n'importe quel autre depuis au moins 2 millions d'années (confiance élevée) et les concentrations de CH 4 et de N 2 O étaient plus élevées qu'à tout moment depuis au moins 800 000 ans (confiance très élevée) . Les concentrations de CH 4 (156 %) dépassent de loin et les augmentations de N 2 O (23 %) sont similaires aux changements naturels multimillénaires entre les périodes glaciaires et interglaciaires au cours des 800 000 dernières années au moins (degré de confiance très élevé) ».
De 2015 à 2019, de fortes hausses des niveaux de méthane atmosphérique ont été enregistrées. En février 2020, il a été signalé que les émissions fugitives et les évacuations de gaz de l' industrie des combustibles fossiles pourraient avoir été considérablement sous-estimées.
Le changement climatique peut augmenter les niveaux de méthane atmosphérique en augmentant la production de méthane dans les écosystèmes naturels, formant une rétroaction du changement climatique .
Clathrates
Les clathrates de méthane (également connus sous le nom d'hydrates de méthane) sont des cages solides de molécules d'eau qui piègent des molécules uniques de méthane. D'importants réservoirs de clathrates de méthane ont été trouvés dans le pergélisol arctique et le long des marges continentales sous le plancher océanique dans la zone de stabilité des clathrates de gaz , situés à des pressions élevées (1 à 100 MPa; l'extrémité inférieure nécessite une température plus basse) et basses températures (< 15 ° C ; l'extrémité supérieure nécessite une pression plus élevée). Les clathrates de méthane peuvent se former à partir de méthane biogénique, de méthane thermogénique ou d'un mélange des deux. Ces gisements sont à la fois une source potentielle de méthane et un contributeur potentiel au réchauffement climatique. La masse globale de carbone stockée dans les clathrates de gaz est encore incertaine et a été estimée à 12 500 Gt de carbone et à 500 Gt de carbone. L'estimation a diminué au fil du temps avec une estimation la plus récente d'environ 1800 Gt de carbone. Une grande partie de cette incertitude est due à notre manque de connaissances sur les sources et les puits de méthane et la distribution des clathrates de méthane à l'échelle mondiale. Par exemple, une source de méthane a été découverte relativement récemment dans une dorsale à propagation ultra -lente dans l'Arctique. Certains modèles climatiques suggèrent que le régime actuel d'émission de méthane du fond de l'océan est potentiellement similaire à celui de la période du maximum thermique paléocène-éocène ( PETM ) il y a environ 55,5 millions d'années, bien qu'il n'y ait aucune donnée indiquant que le méthane issu de la dissociation des clathrates atteint actuellement l'atmosphère. La libération de méthane arctique par le pergélisol et les clathrates de méthane des fonds marins est une conséquence potentielle et une cause supplémentaire du réchauffement climatique ; c'est ce qu'on appelle l' hypothèse du pistolet à clathrate . Les données de 2016 indiquent que le pergélisol arctique dégèle plus rapidement que prévu.
Méthane extraterrestre
Milieu interstellaire
Le méthane est abondant dans de nombreuses parties du système solaire et pourrait potentiellement être récolté à la surface d'un autre corps du système solaire (en particulier, en utilisant la production de méthane à partir de matériaux locaux trouvés sur Mars ou Titan ), fournissant du carburant pour un voyage de retour.
Mars
Le méthane a été détecté sur toutes les planètes du système solaire et sur la plupart des plus grosses lunes. À l'exception peut-être de Mars , on pense qu'elle est issue de processus abiotiques .

Le rover Curiosity a documenté les fluctuations saisonnières des niveaux de méthane atmosphérique sur Mars. Ces fluctuations ont culminé à la fin de l'été martien à 0,6 partie par milliard.
Le méthane a été proposé comme propulseur de fusée possible sur les futures missions martiennes en partie en raison de la possibilité de le synthétiser sur la planète par l'utilisation des ressources in situ . Une adaptation de la réaction de méthanation de Sabatier peut être utilisée avec un lit catalytique mixte et un changement eau-gaz inverse dans un seul réacteur pour produire du méthane à partir des matières premières disponibles sur Mars, en utilisant l'eau du sous- sol martien et le dioxyde de carbone dans l' atmosphère martienne . .
Le méthane pourrait être produit par un processus non biologique appelé serpentinisation impliquant de l'eau, du dioxyde de carbone et le minéral olivine , qui est connu pour être commun sur Mars.
Histoire
En novembre 1776, le méthane a été scientifiquement identifié pour la première fois par le physicien italien Alessandro Volta dans les marais du lac Majeur à cheval sur l'Italie et la Suisse . Volta a été inspiré pour rechercher la substance après avoir lu un article écrit par Benjamin Franklin sur "l'air inflammable". Volta a recueilli le gaz s'élevant du marais et, en 1778, avait isolé du méthane pur. Il a également démontré que le gaz pouvait être enflammé avec une étincelle électrique.
À la suite de la catastrophe de la mine Felling en 1812 au cours de laquelle 92 hommes périrent, Sir Humphry Davy établit que le grisou redouté était en fait en grande partie du méthane.
Le nom « méthane » a été inventé en 1866 par le chimiste allemand August Wilhelm von Hofmann . Le nom est dérivé du méthanol .
Étymologie
Étymologiquement, le mot « méthane » est issu du suffixe chimique « -ane », qui désigne des substances appartenant à la famille des alcanes ; et le mot « methyl », qui dérive de l'allemand « methyl » (1840) ou directement du français « méthyle », qui est une contre-formation du français « méthylène » (correspondant à l'anglais « methylene »), le dont la racine a été inventée par Jean-Baptiste Dumas et Eugène Péligot en 1834 à partir du grec « methy » (vin) (apparenté à l'anglais « hydromel ») et « hyle » (signifiant « bois »). Le radical tire son nom du fait qu'il a été détecté pour la première fois dans le méthanol , un alcool d'abord isolé par distillation du bois. Le suffixe chimique " -ane " provient du suffixe chimique de coordination " -ine " qui est du suffixe féminin latin " -ina " qui est appliqué pour représenter des résumés. La coordination de "-ane", "-ene", "-one", etc. a été proposée en 1866 par le chimiste allemand August Wilhelm von Hofmann (1818–1892).
Abréviations
L'abréviation CH 4 -C peut signifier la masse de carbone contenue dans une masse de méthane, et la masse de méthane est toujours 1,33 fois la masse de CH 4 -C. CH 4 -C peut aussi signifier le rapport méthane-carbone, qui est de 1,33 en masse. Le méthane à l'échelle de l'atmosphère est couramment mesuré en téragrammes (Tg CH 4 ) ou en millions de tonnes métriques (MMT CH 4 ), ce qui veut dire la même chose. D'autres unités standard sont également utilisées, telles que nanomole (nmol, un milliardième de mole), mole (mol), kilogramme et gramme .
Sécurité
Le méthane n'est pas toxique , mais il est extrêmement inflammable et peut former des mélanges explosifs avec l'air. Le méthane est également un asphyxiant si la concentration en oxygène est réduite en dessous d'environ 16% par déplacement, car la plupart des gens peuvent tolérer une réduction de 21% à 16% sans effets néfastes . La concentration de méthane à laquelle le risque d'asphyxie devient important est bien supérieure à la concentration de 5 à 15 % dans un mélange inflammable ou explosif. Les effluents gazeux de méthane peuvent pénétrer à l'intérieur des bâtiments à proximité des décharges et exposer les occupants à des niveaux importants de méthane. Certains bâtiments ont des systèmes de récupération spécialement conçus sous leurs sous-sols pour capter activement ce gaz et l'évacuer loin du bâtiment.
Les explosions de gaz méthane sont responsables de nombreuses catastrophes minières mortelles. Une explosion de gaz méthane a été la cause de la catastrophe de la mine de charbon Upper Big Branch en Virginie-Occidentale le 5 avril 2010, tuant 29 personnes.
Voir également
- Catastrophe minière de Zasyadko en 2007
- Origine pétrolière abiogène
- Production aérobie de méthane
- Digestion anaérobique
- Respiration anaérobie
- Émissions de méthane dans l'Arctique
- Biogaz
- Champ de suintement Coal Oil Point
- Densité d'énergie
- Émissions de gaz fugitifs
- Initiative mondiale sur le méthane
- Thomas Gold
- Halométhane , dérivés halogénés du méthane.
- Cycle de l'hydrogène
- Gaz industriel
- Lac Kivu (plus général : éruption limnique )
- Liste des alcanes à chaîne droite
- Méthanisation
- Émissions de méthane
- Méthane sur Mars :
- Méthanogène , archées produisant du méthane.
- Méthanogenèse , microbes qui produisent du méthane.
- Méthanotrophes , bactéries qui se développent avec le méthane.
- Groupe méthyle , un groupe fonctionnel lié au méthane.
Notes d'explication
Citations
Sources citées
- Haynes, William M., éd. (2016). CRC Handbook of Chemistry and Physics (97e éd.). CRC Appuyez sur . ISBN 9781498754293.
Liens externes
- Méthane au tableau périodique des vidéos (Université de Nottingham)
- Carte internationale de sécurité chimique 0291
- Hydrates de gaz (méthane) - Une nouvelle frontière - United States Geological Survey
- En ligneLunsford, Jack H. (2000). "Conversion catalytique du méthane en produits chimiques et carburants plus utiles: un défi pour le 21e siècle". La catalyse aujourd'hui . 63 (2–4) : 165–174. doi : 10.1016/S0920-5861(00)00456-9 .
- CDC - Manuel pour le contrôle du méthane dans l'exploitation minière