Mitochondrie - Mitochondrion
| Biologie cellulaire | |
|---|---|
| Diagramme de cellules animales | |
 Composants d'une cellule animale typique :
|
A mitochondrie ( / ˌ m aɪ t ə k ɒ n d r i ə n / ; . Pl des mitochondries ) est une double membrane liØe organite trouvé dans la plupart des eucaryotes organismes. Les mitochondries génèrent la majeure partie de l' approvisionnement de la cellule en adénosine triphosphate (ATP), utilisée comme source d' énergie chimique . Ils ont été découverts pour la première fois par Albert von Kölliker en 1880 dans les muscles volontaires des insectes. La mitochondrie est communément surnommée la « centrale électrique de la cellule », une expression inventée pour la première fois par Philip Siekevitz dans un article de 1957 du même nom.
Certaines cellules de certains organismes multicellulaires manquent de mitochondries (par exemple, les globules rouges matures des mammifères ). Un grand nombre d' organismes unicellulaires , comme les microsporidies , les parabasalides et les diplomonades , ont réduit ou transformé leurs mitochondries en d' autres structures . Un eucaryote , Monocercomoniides , est connu pour avoir complètement perdu ses mitochondries, et un organisme multicellulaire, Henneguya salminicola , est connu pour avoir conservé des organites liés aux mitochondries en association avec une perte complète de leur génome mitochondrial.
Les mitochondries ont généralement une superficie comprise entre 0,75 et 3 m 2 , mais varient considérablement en taille et en structure. À moins qu'elles ne soient spécifiquement colorées , elles ne sont pas visibles. En plus de fournir de l'énergie cellulaire, les mitochondries sont impliquées dans d'autres tâches, telles que la signalisation , la différenciation cellulaire et la mort cellulaire , ainsi que dans le maintien du contrôle du cycle cellulaire et de la croissance cellulaire . La biogenèse mitochondriale est à son tour temporellement coordonnée avec ces processus cellulaires. Les mitochondries ont été impliquées dans plusieurs troubles et affections humaines, tels que les maladies mitochondriales , le dysfonctionnement cardiaque , l'insuffisance cardiaque et l' autisme .
Le nombre de mitochondries dans une cellule peut varier considérablement selon l' organisme , le tissu et le type de cellule. Un globule rouge mature n'a pas de mitochondries, alors qu'une cellule hépatique peut en avoir plus de 2000. La mitochondrie est composée de compartiments qui remplissent des fonctions spécialisées. Ces compartiments ou régions comprennent la membrane externe, l'espace intermembranaire , la membrane interne , les crêtes et la matrice .
Bien que la majeure partie de l' ADN d'une cellule soit contenue dans le noyau de la cellule , la mitochondrie possède son propre génome ("mitogénome") qui est sensiblement similaire aux génomes bactériens . Les protéines mitochondriales (protéines transcrites à partir de l'ADN mitochondrial) varient selon le tissu et l'espèce. Chez l'homme, 615 types distincts de protéines ont été identifiés dans les mitochondries cardiaques , alors que chez le rat , 940 protéines ont été rapportées. On pense que le protéome mitochondrial est régulé dynamiquement.
Structure
Les mitochondries peuvent avoir plusieurs formes différentes. Une mitochondrie contient des membranes externes et internes composées de bicouches phospholipidiques et de protéines . Les deux membranes ont des propriétés différentes. En raison de cette organisation à double membrane, une mitochondrie comporte cinq parties distinctes :
- La membrane mitochondriale externe,
- L'espace intermembranaire (l'espace entre les membranes externe et interne),
- La membrane mitochondriale interne,
- L' espace des crêtes (formé par les replis de la membrane interne), et
- La matrice (espace à l'intérieur de la membrane interne), qui est un fluide.
Les mitochondries se replient pour augmenter la surface, ce qui à son tour augmente la production d'ATP (Adenosine Tri Phosphate). Les mitochondries dépourvues de leur membrane externe sont appelées mitoplastes .
Membrane extérieure
La membrane mitochondriale externe , qui entoure l'ensemble de l'organite, a une épaisseur de 60 à 75 angströms (Å). Il a un rapport protéine/phospholipide similaire à celui de la membrane cellulaire (environ 1:1 en poids). Il contient un grand nombre de protéines membranaires intégrales appelées porines . Une protéine de trafic majeure est le canal anionique dépendant de la tension (VDAC) formant des pores . Le VDAC est le principal transporteur de nucléotides , d' ions et de métabolites entre le cytosol et l'espace intermembranaire. Il se présente sous la forme d'un tonneau bêta qui s'étend sur la membrane externe, semblable à celui de la membrane bactérienne à Gram négatif . Des protéines plus grosses peuvent entrer dans la mitochondrie si une séquence de signalisation à leur extrémité N se lie à une grande protéine multi- sous- unité appelée translocase dans la membrane externe , qui les déplace ensuite activement à travers la membrane. Les proprotéines mitochondriales sont importées via des complexes de translocation spécialisés.
La membrane externe contient également des enzymes impliquées dans des activités aussi diverses que l'allongement des acides gras , l' oxydation de l' épinéphrine et la dégradation du tryptophane . Ces enzymes comprennent la monoamine oxydase , la NADH-cytochrome c-réductase insensible à la roténone , la kynurénine hydroxylase et l'acide gras Co-A ligase . La rupture de la membrane externe permet aux protéines de l'espace intermembranaire de s'infiltrer dans le cytosol, entraînant la mort cellulaire. La membrane externe mitochondriale peut s'associer à la membrane du réticulum endoplasmique (RE), dans une structure appelée MAM (membrane ER associée aux mitochondries). Ceci est important dans la signalisation calcique du RE et des mitochondries et est impliqué dans le transfert des lipides entre le RE et les mitochondries. En dehors de la membrane externe, il y a de petites particules (diamètre : 60 Å) appelées sous-unités de Parson.
Espace membranaire
L' espace intermembranaire mitochondrial est l'espace entre la membrane externe et la membrane interne. Il est également connu sous le nom d'espace périmitochondrial. Parce que la membrane externe est librement perméable aux petites molécules, les concentrations de petites molécules, telles que les ions et les sucres, dans l'espace intermembranaire sont les mêmes que dans le cytosol . Cependant, les grandes protéines doivent avoir une séquence de signalisation spécifique pour être transportées à travers la membrane externe, de sorte que la composition protéique de cet espace est différente de la composition protéique du cytosol . Une protéine qui est ainsi localisée dans l'espace intermembranaire est le cytochrome c .
Membrane intérieure
La membrane mitochondriale interne contient des protéines avec trois types de fonctions :
- Ceux qui effectuent les réactions d' oxydoréduction de la chaîne de transport d'électrons
- ATP synthase , qui génère de l' ATP dans la matrice
- Protéines de transport spécifiques qui régulent le passage des métabolites dans et hors de la matrice mitochondriale
Il contient plus de 151 polypeptides différents et présente un rapport protéine/phospholipide très élevé (plus de 3:1 en poids, soit environ 1 protéine pour 15 phospholipides). La membrane interne abrite environ 1/5 de la protéine totale dans une mitochondrie. De plus, la membrane interne est riche en un phospholipide inhabituel, la cardiolipine . Ce phospholipide a été initialement découvert dans le cœur des vaches en 1942 et est généralement caractéristique des membranes plasmiques mitochondriales et bactériennes. La cardiolipine contient quatre acides gras au lieu de deux et peut contribuer à rendre la membrane interne imperméable. Contrairement à la membrane externe, la membrane interne ne contient pas de porines et est hautement imperméable à toutes les molécules. Presque tous les ions et molécules nécessitent des transporteurs membranaires spéciaux pour entrer ou sortir de la matrice. Les protéines sont transportées dans la matrice via le complexe translocase de la membrane interne (TIM) ou via OXA1L . De plus, il existe un potentiel membranaire à travers la membrane interne, formé par l'action des enzymes de la chaîne de transport d'électrons . La fusion membranaire interne est médiée par la protéine membranaire interne OPA1 .
Cristae

La membrane mitochondriale interne est compartimentée en de nombreux replis appelés crêtes , qui élargissent la surface de la membrane mitochondriale interne, améliorant ainsi sa capacité à produire de l'ATP. Pour les mitochondries hépatiques typiques, la surface de la membrane interne est environ cinq fois plus grande que la membrane externe. Ce rapport est variable et les mitochondries des cellules qui ont une plus grande demande en ATP, telles que les cellules musculaires, contiennent encore plus de crêtes. Les mitochondries au sein d'une même cellule peuvent avoir une densité de crête sensiblement différente, celles qui sont nécessaires pour produire plus d'énergie ayant une surface de membrane de crête beaucoup plus importante. Ces plis sont parsemés de petits corps ronds appelés particules F 1 ou oxysomes.
Matrice
La matrice est l'espace délimité par la membrane interne. Il contient environ 2/3 des protéines totales dans une mitochondrie. La matrice est importante dans la production d'ATP à l'aide de l'ATP synthase contenue dans la membrane interne. La matrice contient un mélange hautement concentré de centaines d'enzymes, de ribosomes mitochondriaux spéciaux , d' ARNt et de plusieurs copies du génome de l' ADN mitochondrial . Parmi les enzymes, les principales fonctions comprennent l'oxydation du pyruvate et des acides gras et le cycle de l'acide citrique . Les molécules d'ADN sont conditionnées en nucléoïdes par des protéines, dont TFAM .
Fonction
Les rôles les plus importants des mitochondries sont de produire la monnaie énergétique de la cellule, l' ATP (c'est-à-dire la phosphorylation de l' ADP ), par la respiration et de réguler le métabolisme cellulaire . L'ensemble central de réactions impliquées dans la production d'ATP est connu sous le nom de cycle de l'acide citrique ou cycle de Krebs . Cependant, la mitochondrie a de nombreuses autres fonctions en plus de la production d'ATP.
Conversion de l'énergie
Un rôle dominant pour les mitochondries est la production d' ATP , comme en témoigne le grand nombre de protéines dans la membrane interne pour cette tâche. Cela se fait en oxydant les principaux produits du glucose : le pyruvate et le NADH , qui sont produits dans le cytosol. Ce type de respiration cellulaire , connue sous le nom de respiration aérobie , dépend de la présence d' oxygène , qui fournit la majeure partie de l'énergie libérée. Lorsque l'oxygène est limité, les produits glycolytiques seront métabolisés par fermentation anaérobie , processus indépendant des mitochondries. La production d'ATP à partir de glucose et d'oxygène (les produits de la photosynthèse) a un rendement environ 13 fois plus élevé pendant la respiration aérobie par rapport à la fermentation. Les mitochondries végétales peuvent également produire une quantité limitée d'ATP soit en brisant le sucre produit lors de la photosynthèse, soit sans oxygène en utilisant le substrat alternatif nitrite . L'ATP traverse la membrane interne à l'aide d'une protéine spécifique et traverse la membrane externe via les porines . ADP revient par le même chemin.
Le pyruvate et le cycle de l'acide citrique
Les molécules de pyruvate produites par la glycolyse sont activement transportées à travers la membrane mitochondriale interne et dans la matrice où elles peuvent être soit oxydées et combinées avec la coenzyme A pour former du CO 2 , de l' acétyl-CoA et du NADH , soit elles peuvent être carboxylées (par la pyruvate carboxylase ) pour former de l'oxaloacétate. Cette dernière réaction "remplit" la quantité d'oxaloacétate dans le cycle de l'acide citrique et est donc une réaction anapléotique , augmentant la capacité du cycle à métaboliser l'acétyl-CoA lorsque les besoins énergétiques du tissu (par exemple, dans le muscle ) sont soudainement augmentés par l'activité.
Dans le cycle de l'acide citrique, tous les intermédiaires (par exemple citrate , iso-citrate , alpha-cétoglutarate , succinate, fumarate , malate et oxaloacétate) sont régénérés à chaque tour du cycle. L'ajout de plus de l'un de ces intermédiaires à la mitochondrie signifie donc que la quantité supplémentaire est conservée dans le cycle, augmentant tous les autres intermédiaires à mesure que l'un est converti en l'autre. Par conséquent, l'ajout de l'un d'entre eux au cycle a un effet anaplérotique et son retrait a un effet catapléotique. Ces réactions anaplérotiques et cataplérotiques vont, au cours du cycle, augmenter ou diminuer la quantité d'oxaloacétate disponible pour se combiner avec l'acétyl-CoA pour former de l'acide citrique. Cela augmente ou diminue à son tour le taux de production d' ATP par la mitochondrie, et donc la disponibilité d'ATP pour la cellule.
Acetyl-CoA, d'autre part, provenant de l' oxydation du pyruvate ou de la bêta-oxydation des acides gras , est le seul combustible pour entrer dans le cycle de l' acide citrique. A chaque tour du cycle, une molécule d'acétyl-CoA est consommée pour chaque molécule d'oxaloacétate présente dans la matrice mitochondriale, et n'est jamais régénérée. C'est l'oxydation de la partie acétate de l'acétyl-CoA qui produit du CO 2 et de l'eau, l'énergie ainsi libérée étant captée sous forme d'ATP.
Dans le foie, la carboxylation du pyruvate cytosolique en oxaloacétate intra-mitochondrial est une étape précoce de la voie gluconéogène , qui convertit le lactate et l' alanine désaminée en glucose, sous l'influence de taux élevés de glucagon et/ou d' épinéphrine dans le sang. Ici, l'ajout d'oxaloacétate à la mitochondrie n'a pas d'effet anaplérotique net, car un autre intermédiaire du cycle de l'acide citrique (malate) est immédiatement retiré de la mitochondrie pour être converti en oxaloacétate cytosolique, qui est finalement converti en glucose, dans un processus qui est presque l'inverse de la glycolyse .
Les enzymes du cycle de l'acide citrique sont situées dans la matrice mitochondriale, à l'exception de la succinate déshydrogénase , qui est liée à la membrane mitochondriale interne dans le cadre du complexe II. Le cycle de l'acide citrique oxyde l'acétyl-CoA en dioxyde de carbone et, dans le processus, produit des cofacteurs réduits (trois molécules de NADH et une molécule de FADH 2 ) qui sont une source d'électrons pour la chaîne de transport d'électrons , et une molécule de GTP (qui est facilement converti en ATP).
NADH et FADH 2 : la chaîne de transport d'électrons
Les électrons de NADH et FADH 2 sont transférés à l'oxygène (O 2 ), une molécule riche en énergie, et à l'hydrogène (protons) en plusieurs étapes via la chaîne de transport d'électrons. Les molécules NADH et FADH 2 sont produites au sein de la matrice via le cycle de l'acide citrique mais sont également produites dans le cytoplasme par glycolyse . Les équivalents réducteurs du cytoplasme peuvent être importés via le système de navette malate-aspartate de protéines antiporter ou alimenter la chaîne de transport d'électrons à l'aide d'une navette glycérol phosphate . Des complexes protéiques dans la membrane interne ( NADH déshydrogénase (ubiquinone) , cytochrome c réductase et cytochrome c oxydase ) effectuent le transfert, et la libération progressive d'énergie est utilisée pour pomper des protons (H + ) dans l'espace intermembranaire. Ce processus est efficace, mais un petit pourcentage d'électrons peut réduire prématurément l'oxygène, formant des espèces réactives de l'oxygène telles que le superoxyde . Cela peut provoquer un stress oxydatif dans les mitochondries et peut contribuer au déclin de la fonction mitochondriale associé au processus de vieillissement.
Au fur et à mesure que la concentration de protons augmente dans l'espace intermembranaire, un fort gradient électrochimique s'établit à travers la membrane interne. Les protons peuvent retourner à la matrice via le complexe ATP synthase , et leur énergie potentielle est utilisée pour synthétiser l' ATP à partir d'ADP et de phosphate inorganique (P i ). Ce processus est appelé chimiosmose et a été décrit pour la première fois par Peter Mitchell , qui a reçu le prix Nobel de chimie en 1978 pour ses travaux. Plus tard, une partie du prix Nobel de chimie 1997 a été décerné à Paul D. Boyer et John E. Walker pour leur clarification du mécanisme de fonctionnement de l'ATP synthase.
Production de chaleur
Dans certaines conditions, les protons peuvent réintégrer la matrice mitochondriale sans contribuer à la synthèse d'ATP. Ce processus est connu sous le nom de fuite de protons ou de découplage mitochondrial et est dû à la diffusion facilitée des protons dans la matrice. Le processus a pour résultat que l'énergie potentielle non exploitée du gradient électrochimique de protons est libérée sous forme de chaleur. Le processus est médié par un canal de protons appelé thermogénine ou UCP1 . La thermogénine se trouve principalement dans le tissu adipeux brun , ou graisse brune, et est responsable de la thermogenèse sans frisson. Le tissu adipeux brun se trouve chez les mammifères et est à son plus haut niveau au début de la vie et chez les animaux en hibernation. Chez l'homme, le tissu adipeux brun est présent à la naissance et diminue avec l'âge.
Stockage des ions calcium

Les concentrations de calcium libre dans la cellule peuvent réguler un éventail de réactions et sont importantes pour la transduction du signal dans la cellule. Les mitochondries peuvent stocker temporairement du calcium , un processus contribuant à l'homéostasie cellulaire du calcium. Leur capacité à absorber rapidement le calcium pour une libération ultérieure en fait de bons "tampons cytosoliques" pour le calcium. Le réticulum endoplasmique (RE) est le site de stockage le plus important du calcium, et il existe une interaction significative entre la mitochondrie et le RE en ce qui concerne le calcium. Le calcium est absorbé dans la matrice par l' uniporteur de calcium mitochondrial sur la membrane mitochondriale interne . Il est principalement piloté par le potentiel de membrane mitochondriale . La libération de ce calcium à l'intérieur de la cellule peut se produire via une protéine d'échange sodium-calcium ou via des voies de « libération de calcium induite par le calcium ». Cela peut initier des pics de calcium ou des vagues de calcium avec de grands changements dans le potentiel membranaire . Ceux-ci peuvent activer une série de protéines du système de second messager qui peuvent coordonner des processus tels que la libération de neurotransmetteurs dans les cellules nerveuses et la libération d' hormones dans les cellules endocrines.
L' afflux de Ca 2+ dans la matrice mitochondriale a récemment été impliqué comme mécanisme de régulation de la bioénergétique respiratoire en permettant au potentiel électrochimique à travers la membrane de passer temporairement de -dominé à pH-dominé, facilitant une réduction du stress oxydatif . Dans les neurones, des augmentations concomitantes du calcium cytosolique et mitochondrial agissent pour synchroniser l'activité neuronale avec le métabolisme énergétique mitochondrial. Les niveaux de calcium de la matrice mitochondriale peuvent atteindre des dizaines de niveaux micromolaires, ce qui est nécessaire à l'activation de l' isocitrate déshydrogénase , l'une des enzymes régulatrices clés du cycle de Krebs .
Régulation de la prolifération cellulaire
La relation entre la prolifération cellulaire et les mitochondries a été étudiée. Les cellules tumorales ont besoin de suffisamment d'ATP pour synthétiser des composés bioactifs tels que des lipides , des protéines et des nucléotides pour une prolifération rapide. La majorité de l'ATP dans les cellules tumorales est générée via la voie de phosphorylation oxydative (OxPhos). Les interférences avec OxPhos provoquent un arrêt du cycle cellulaire suggérant que les mitochondries jouent un rôle dans la prolifération cellulaire. La production d'ATP mitochondrial est également vitale pour la division cellulaire et la différenciation dans l'infection en plus des fonctions de base dans la cellule, notamment la régulation du volume cellulaire, la concentration de soluté et l'architecture cellulaire. Les niveaux d'ATP diffèrent à divers stades du cycle cellulaire, ce qui suggère qu'il existe une relation entre l'abondance d'ATP et la capacité de la cellule à entrer dans un nouveau cycle cellulaire. Le rôle de l'ATP dans les fonctions de base de la cellule rend le cycle cellulaire sensible aux changements dans la disponibilité de l'ATP dérivé des mitochondries. La variation des niveaux d'ATP à différents stades du cycle cellulaire soutient l'hypothèse que les mitochondries jouent un rôle important dans la régulation du cycle cellulaire. Bien que les mécanismes spécifiques entre les mitochondries et la régulation du cycle cellulaire ne soient pas bien compris, des études ont montré que les points de contrôle du cycle cellulaire à faible énergie surveillent la capacité énergétique avant de s'engager dans un autre cycle de division cellulaire.
Fonctions supplémentaires
Les mitochondries jouent un rôle central dans de nombreuses autres tâches métaboliques , telles que :
- Signalisation par les espèces réactives de l'oxygène mitochondriales
- Régulation du potentiel membranaire
- Apoptose - mort cellulaire programmée
- Signalisation du calcium (y compris l'apoptose évoquée par le calcium)
- Régulation du métabolisme cellulaire
- Certaines réactions de synthèse de l' hème (voir aussi : porphyrine )
- Synthèse de stéroïdes .
- Signalisation hormonale Les mitochondries sont sensibles et réactives aux hormones, en partie par l'action des récepteurs mitochondriaux des œstrogènes (mtER). Ces récepteurs ont été trouvés dans divers tissus et types de cellules, y compris le cerveau et le cœur.
- Signalisation immunitaire
- Les mitochondries neuronales contribuent également au contrôle de la qualité cellulaire en signalant l'état neuronal de la microglie par le biais de jonctions somatiques spécialisées.
Certaines fonctions mitochondriales ne sont exécutées que dans des types spécifiques de cellules. Par exemple, les mitochondries des cellules hépatiques contiennent des enzymes qui leur permettent de détoxifier l' ammoniac , un déchet du métabolisme des protéines. Une mutation dans les gènes régulant l'une de ces fonctions peut entraîner des maladies mitochondriales .
Organisation et diffusion

Les mitochondries (et les structures apparentées) se trouvent chez tous les eucaryotes (sauf deux, les Oxymonad Monocercomonoides et Henneguya salminicola ). Bien que communément décrites comme des structures ressemblant à des haricots, elles forment un réseau hautement dynamique dans la majorité des cellules où elles subissent constamment une fission et une fusion . La population de toutes les mitochondries d'une cellule donnée constitue le chondriome. Les mitochondries varient en nombre et en emplacement selon le type de cellule. Une seule mitochondrie se trouve souvent dans les organismes unicellulaires, tandis que les cellules hépatiques humaines ont environ 1 000 à 2 000 mitochondries par cellule, ce qui représente 1/5 du volume cellulaire. Le contenu mitochondrial de cellules par ailleurs similaires peut varier considérablement en taille et en potentiel membranaire, avec des différences provenant de sources comprenant une partition inégale au niveau des divisions cellulaires, entraînant des différences extrinsèques dans les niveaux d' ATP et les processus cellulaires en aval. Les mitochondries peuvent être trouvées nichées entre les myofibrilles du muscle ou enroulées autour du flagelle du sperme . Souvent, ils forment un réseau de ramifications 3D complexe à l'intérieur de la cellule avec le cytosquelette . L'association avec le cytosquelette détermine la forme mitochondriale, qui peut également affecter la fonction : différentes structures du réseau mitochondrial peuvent offrir à la population une variété d'avantages ou d'inconvénients physiques, chimiques et de signalisation. Les mitochondries dans les cellules sont toujours distribuées le long des microtubules et la distribution de ces organites est également corrélée avec le réticulum endoplasmique . Des preuves récentes suggèrent que la vimentine , l'un des composants du cytosquelette, est également essentielle à l'association avec le cytosquelette.
Membrane RE associée aux mitochondries (MAM)
La membrane ER associée aux mitochondries (MAM) est un autre élément structurel de plus en plus reconnu pour son rôle essentiel dans la physiologie cellulaire et l' homéostasie . Autrefois considérés comme un problème technique dans les techniques de fractionnement cellulaire, les contaminants présumés des vésicules du RE qui apparaissaient invariablement dans la fraction mitochondriale ont été réidentifiés comme des structures membraneuses dérivées du MAM, l'interface entre les mitochondries et le RE. Le couplage physique entre ces deux organites avait déjà été observé en micrographie électronique et a été plus récemment sondé par microscopie à fluorescence . De telles études estiment qu'au MAM, qui peut comprendre jusqu'à 20 % de la membrane externe mitochondriale, le RE et les mitochondries sont séparés par à peine 10-25 nm et maintenus ensemble par des complexes d'attache protéique.
La MAM purifiée issue du fractionnement subcellulaire est enrichie en enzymes impliquées dans l'échange de phospholipides, en plus des canaux associés à la signalisation Ca 2+ . Ces indices d'un rôle important du MAM dans la régulation des réserves lipidiques cellulaires et la transduction du signal ont été confirmés, avec des implications significatives pour les phénomènes cellulaires associés aux mitochondries, comme discuté ci-dessous. Non seulement le MAM a fourni un aperçu de la base mécanistique sous-jacente à des processus physiologiques tels que l'apoptose intrinsèque et la propagation de la signalisation calcique, mais il favorise également une vision plus raffinée des mitochondries. Bien que souvent considérée comme des « centrales » statiques et isolées détournées pour le métabolisme cellulaire par le biais d'un ancien événement endosymbiotique, l'évolution du MAM souligne à quel point les mitochondries ont été intégrées dans la physiologie cellulaire globale, avec un couplage physique et fonctionnel intime avec le système endomembranaire.
Transfert de phospholipides
La MAM est enrichie en enzymes impliquées dans la biosynthèse des lipides, telles que la phosphatidylsérine synthase sur la face du RE et la phosphatidylsérine décarboxylase sur la face mitochondriale. Étant donné que les mitochondries sont des organites dynamiques subissant constamment des événements de fission et de fusion , elles nécessitent un apport constant et bien régulé de phospholipides pour l'intégrité de la membrane. Mais les mitochondries ne sont pas seulement une destination pour les phospholipides dont elles achèvent la synthèse ; plutôt, cet organite joue également un rôle dans le trafic inter-organite des intermédiaires et des produits des voies de biosynthèse des phospholipides, du métabolisme des céramides et du cholestérol, et de l'anabolisme des glycosphingolipides.
Une telle capacité de trafic dépend du MAM, qui a été montré pour faciliter le transfert d'intermédiaires lipidiques entre les organites. Contrairement au mécanisme vésiculaire standard de transfert de lipides, les preuves indiquent que la proximité physique du RE et des membranes mitochondriales au niveau du MAM permet un basculement des lipides entre les bicouches opposées. Malgré ce mécanisme inhabituel et apparemment défavorable sur le plan énergétique, un tel transport ne nécessite pas d'ATP. Au lieu de cela, chez la levure, il a été démontré qu'elle dépend d'une structure d'attache multiprotéique appelée structure de rencontre ER-mitochondries, ou ERMES, bien qu'il ne soit pas clair si cette structure médie directement le transfert de lipides ou est nécessaire pour maintenir les membranes suffisamment proches. pour abaisser la barrière énergétique pour le retournement des lipides .
Le MAM peut également faire partie de la voie de sécrétion, en plus de son rôle dans le trafic lipidique intracellulaire. En particulier, le MAM semble être une destination intermédiaire entre le RE rugueux et le Golgi dans la voie qui conduit à l' assemblage et à la sécrétion des lipoprotéines de très basse densité , ou VLDL. Le MAM sert ainsi de plaque tournante métabolique et de trafic critique dans le métabolisme des lipides.
Signalisation du calcium
Un rôle critique du RE dans la signalisation calcique a été reconnu avant qu'un tel rôle pour les mitochondries ne soit largement accepté, en partie parce que la faible affinité des canaux Ca 2+ localisés sur la membrane mitochondriale externe semblait contredire la prétendue réactivité de cet organite aux changements dans les Flux de Ca 2+ . Mais la présence du MAM résout cette apparente contradiction : l'association physique étroite entre les deux organites se traduit par des microdomaines Ca 2+ aux points de contact qui facilitent une transmission efficace du Ca 2+ du RE vers les mitochondries. La transmission se produit en réponse à ce que l'on appelle les « bouffées de Ca 2+ » générées par le regroupement spontané et l'activation de IP3R , un canal Ca 2+ canonique de la membrane du RE .
Le devenir de ces bouffées, en particulier, qu'elles restent confinées à des lieux isolés ou intégrées dans des ondes de Ca 2+ pour se propager dans toute la cellule, est déterminée en grande partie par la dynamique MAM. Bien que la recapture du Ca 2+ par le RE (concomitamment à sa libération) module l'intensité des bouffées, isolant ainsi les mitochondries dans une certaine mesure d'une exposition élevée au Ca 2+ , le MAM sert souvent de pare-feu qui tamponne essentiellement les bouffées de Ca 2+ en agissant comme un puits dans lequel les ions libres libérés dans le cytosol peuvent être canalisés. Cette tunnelisation du Ca 2+ se produit à travers le récepteur de faible affinité Ca 2+ VDAC1 , qui s'est récemment avéré physiquement attaché aux clusters IP3R sur la membrane du RE et enrichi au MAM. La capacité des mitochondries à servir de puits de Ca 2+ est le résultat du gradient électrochimique généré pendant la phosphorylation oxydative, ce qui fait de l'effet tunnel du cation un processus exergonique. Un afflux de calcium normal et modéré du cytosol dans la matrice mitochondriale provoque une dépolarisation transitoire qui est corrigée en pompant des protons.
Mais la transmission du Ca 2+ n'est pas unidirectionnelle ; c'est plutôt une rue à double sens. Les propriétés de la pompe Ca 2+ SERCA et du canal IP3R présent sur la membrane du RE facilitent la régulation par rétroaction coordonnée par la fonction MAM. En particulier, la clairance de Ca 2+ par le MAM permet de patterning spatio-temporelle de Ca 2+ de signalisation parce que Ca 2+ modifie l' activité IP3R de manière biphasée. SERCA est également affecté par la rétroaction mitochondriale : l'absorption de Ca 2+ par le MAM stimule la production d'ATP, fournissant ainsi de l'énergie qui permet à SERCA de recharger le RE avec du Ca 2+ pour un efflux continu de Ca 2+ au MAM. Ainsi, le MAM n'est pas un tampon passif pour les bouffées de Ca 2+ ; il aide plutôt à moduler davantage la signalisation Ca 2+ via des boucles de rétroaction qui affectent la dynamique du RE.
La régulation de la libération ER de Ca 2+ au niveau du MAM est particulièrement critique car seule une certaine fenêtre d' absorption de Ca 2+ maintient les mitochondries, et par conséquent la cellule, à l'homéostasie. Une signalisation intraorganite suffisante de Ca 2+ est nécessaire pour stimuler le métabolisme en activant les enzymes déshydrogénases essentielles au flux à travers le cycle de l'acide citrique. Cependant, une fois que la signalisation du Ca 2+ dans les mitochondries dépasse un certain seuil, elle stimule la voie intrinsèque de l'apoptose en partie en réduisant le potentiel membranaire mitochondrial requis pour le métabolisme. Les études examinant le rôle des facteurs pro- et anti-apoptotiques soutiennent ce modèle ; par exemple, il a été démontré que le facteur anti-apoptotique Bcl-2 interagit avec les IP3R pour réduire le remplissage en Ca 2+ du RE, entraînant une réduction de l'efflux au niveau du MAM et empêchant l'effondrement des stimuli post-apoptotiques potentiels de la membrane mitochondriale. Compte tenu de la nécessité d'une régulation aussi fine de la signalisation du Ca 2+ , il n'est peut-être pas surprenant que le Ca 2+ mitochondrial dérégulé ait été impliqué dans plusieurs maladies neurodégénératives, alors que le catalogue des suppresseurs de tumeurs en comprend quelques-uns qui sont enrichis au MAM.
Base moléculaire de l'attache
Les progrès récents dans l'identification des attaches entre les membranes mitochondriales et ER suggèrent que la fonction d'échafaudage des éléments moléculaires impliqués est secondaire à d'autres fonctions non structurelles. Chez la levure, ERMES, un complexe multiprotéique d'interactions entre les protéines membranaires ER et mitochondriales, est nécessaire pour le transfert des lipides au niveau du MAM et illustre ce principe. L'un de ses composants, par exemple, est également un constituant du complexe protéique nécessaire à l'insertion des protéines transmembranaires bêta-baril dans la bicouche lipidique. Cependant, un homologue du complexe ERMES n'a pas encore été identifié dans les cellules de mammifères. D'autres protéines impliquées dans l'échafaudage ont également des fonctions indépendantes de l'attache structurelle au MAM ; par exemple, les mitofusines résidentes du RE et des mitochondries forment des hétérocomplexes qui régulent le nombre de sites de contact inter-organites, bien que les mitofusines aient d'abord été identifiées pour leur rôle dans les événements de fission et de fusion entre les mitochondries individuelles. La protéine liée au glucose 75 (grp75) est une autre protéine à double fonction. En plus du pool matriciel de grp75, une partie sert de chaperon qui relie physiquement les canaux mitochondriaux et ER Ca 2+ VDAC et IP3R pour une transmission efficace du Ca 2+ au MAM. Une autre attache potentiel est Sigma-1R , un récepteur non-opioïde dont la stabilisation de IP3R ER-résident peut conserver la communication au MAM lors de la réponse au stress métabolique.
Perspective
Le MAM est une plaque tournante critique de la signalisation, du métabolisme et du trafic dans la cellule qui permet l'intégration de l'ER et de la physiologie mitochondriale. Le couplage entre ces organites n'est pas simplement structurel mais aussi fonctionnel et critique pour la physiologie cellulaire globale et l' homéostasie . Le MAM offre ainsi une perspective sur les mitochondries qui s'écarte de la vision traditionnelle de cet organite comme une unité statique et isolée appropriée pour sa capacité métabolique par la cellule. Au lieu de cela, cette interface mitochondriale-ER met l'accent sur l'intégration des mitochondries, le produit d'un événement endosymbiotique, dans divers processus cellulaires. Récemment, il a également été montré que les mitochondries et les MAM-s dans les neurones sont ancrées à des sites de communication intercellulaire spécialisés (appelés jonctions somatiques). Les processus microgliaux surveillent et protègent les fonctions neuronales de ces sites, et les MAM-s sont censés jouer un rôle important dans ce type de contrôle de qualité cellulaire.
Origine et évolution
Il existe deux hypothèses sur l'origine des mitochondries : endosymbiotique et autogène . L'hypothèse endosymbiotique suggère que les mitochondries étaient à l'origine des cellules procaryotes , capables de mettre en œuvre des mécanismes oxydatifs qui n'étaient pas possibles pour les cellules eucaryotes ; ils sont devenus des endosymbiotes vivant à l'intérieur de l'eucaryote. Dans l'hypothèse autogène, les mitochondries sont nées en séparant une partie de l'ADN du noyau de la cellule eucaryote au moment de la divergence avec les procaryotes ; cette portion d'ADN aurait été entourée de membranes, qui ne pourraient pas être traversées par des protéines. Étant donné que les mitochondries ont de nombreuses caractéristiques en commun avec les bactéries , l'hypothèse endosymbiotique est plus largement acceptée.
Un mitochondrie contient de l' ADN , qui est organisé en plusieurs copies d'un seul, généralement circulaire chromosome . Ce chromosome mitochondrial contient des gènes pour les protéines redox , comme celles de la chaîne respiratoire. L' hypothèse du CoRR propose que cette co-localisation est nécessaire pour la régulation redox. Le génome mitochondrial code pour certains ARN de ribosomes , et les 22 ARNt nécessaires à la traduction des ARNm en protéine. La structure circulaire se retrouve également chez les procaryotes. La proto-mitochondrie était probablement étroitement liée à Rickettsia . Cependant, la relation exacte entre l'ancêtre des mitochondries et les alphaprotéobactéries et si la mitochondrie s'est formée en même temps ou après le noyau, reste controversée. Par exemple, il a été suggéré que le clade de bactéries SAR11 partage un ancêtre commun relativement récent avec les mitochondries, tandis que les analyses phylogénomiques indiquent que les mitochondries ont évolué à partir d'une lignée de protéobactéries étroitement liée ou membre des alphaprotéobactéries .
| Phylogénie schématique de l'ARN ribosomique des Alphaprotéobactéries | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le cladogramme des Rickettsidae a été déduit par Ferla et al. à partir de la comparaison de séquences d'ARN ribosomique 16S + 23S . |
Les ribosomes codés par l'ADN mitochondrial sont similaires à ceux des bactéries en taille et en structure. Ils ressemblent beaucoup au ribosome bactérien 70S et non aux ribosomes cytoplasmiques 80S , qui sont codés par l' ADN nucléaire .
La relation endosymbiotique des mitochondries avec leurs cellules hôtes a été popularisée par Lynn Margulis . L' hypothèse endosymbiotique suggère que les mitochondries descendent de bactéries qui ont en quelque sorte survécu à l' endocytose par une autre cellule et se sont incorporées dans le cytoplasme . La capacité de ces bactéries à conduire la respiration dans les cellules hôtes qui s'étaient appuyées sur la glycolyse et la fermentation aurait fourni un avantage évolutif considérable. Cette relation symbiotique s'est probablement développée il y a 1,7 à 2 milliards d'années. Quelques groupes d'eucaryotes unicellulaires n'ont que des mitochondries vestigiales ou des structures dérivées : les microsporidies , les métamonades et les archamoebae . Ces groupes apparaissent comme les eucaryotes les plus primitifs sur les arbres phylogénétiques construits à l'aide d' informations d' ARNr , ce qui suggérait autrefois qu'ils étaient apparus avant l'origine des mitochondries. Cependant, il s'agit maintenant d'un artefact d' attraction à longue branche - ce sont des groupes dérivés et conservent des gènes ou des organites dérivés des mitochondries (par exemple, les mitosomes et les hydrogénosomes ). Les hydrogénosomes, les mitosomes et les organites apparentés que l'on trouve dans certains loricifères (par exemple Spinoloricus ) et myxozoaires (par exemple Henneguya zschokkei ) sont ensemble classés comme MRO, organites apparentés aux mitochondries.
Les monocercomonoïdes semblent avoir complètement perdu leurs mitochondries et au moins certaines des fonctions mitochondriales semblent maintenant être assurées par des protéines cytoplasmiques .
Génome

Les mitochondries contiennent leur propre génome. Le génome mitochondrial humain est une molécule d' ADN double brin circulaire d'environ 16 kilobases . Il code 37 gènes : 13 pour les sous - unités des complexes respiratoires I, III, IV et V, 22 pour l' ARNt mitochondrial (pour les 20 acides aminés standards, plus un gène supplémentaire pour la leucine et la sérine), et 2 pour l' ARNr ( ARNr 12S et 16S ). Une mitochondrie peut contenir de deux à dix copies de son ADN. L'un des deux brins d'ADN mitochondrial (ADNmt) a un rapport disproportionnellement plus élevé de nucléotides plus lourds adénine et guanine, et ce brin est appelé brin lourd (ou brin H), tandis que l'autre brin est appelé brin léger (ou brin L ). La différence de poids permet de séparer les deux brins par centrifugation . L'ADNmt a un long tronçon non codant connu sous le nom de région non codante (NCR), et le NCR contient le promoteur du brin lourd (HSP) et le promoteur du brin léger (LSP) pour la transcription de l'ARN, l'origine de la réplication du brin H ( OriH) localisé sur le brin L, trois boîtes de séquence conservées (CSB 1–3) et une séquence associée à la terminaison (TAS). L'origine de réplication du brin L (OriL) est localisée sur le brin H 11 000 pb en aval d'OriH, situé au sein d'un cluster de gènes codant pour l'ARNt.
Comme chez les procaryotes, il y a une très forte proportion d'ADN codant et une absence de répétitions. Les gènes mitochondriaux sont transcrits sous forme de transcrits multigéniques, qui sont clivés et polyadénylés pour produire des ARNm matures . La plupart des protéines nécessaires à la fonction mitochondriale sont codées par des gènes dans le noyau cellulaire et les protéines correspondantes sont importées dans la mitochondrie. Le nombre exact de gènes codés par le noyau et le génome mitochondrial diffère selon les espèces. La plupart des génomes mitochondriaux sont circulaires. En général, l'ADN mitochondrial manque d' introns , comme c'est le cas dans le génome mitochondrial humain ; cependant, des introns ont été observés dans certains ADN mitochondriaux eucaryotes, tels que celui de la levure et des protistes , y compris Dictyostelium discoideum . Entre les régions codant pour les protéines, des ARNt sont présents. Les gènes d'ARNt mitochondrial ont des séquences différentes de celles des ARNt nucléaires, mais des ressemblances d'ARNt mitochondriaux ont été trouvées dans les chromosomes nucléaires avec une similitude de séquence élevée.
Chez les animaux, le génome mitochondrial est généralement un seul chromosome circulaire d'environ 16 kb de long et comportant 37 gènes. Les gènes, bien que hautement conservés, peuvent varier en emplacement. Curieusement, ce motif ne se retrouve pas chez le pou de corps humain ( Pediculus humanus ). Au lieu de cela, ce génome mitochondrial est organisé en 18 chromosomes minicirculaires, chacun d'une longueur de 3 à 4 kb et possédant un à trois gènes. Ce modèle se retrouve également chez d'autres poux suceurs , mais pas chez les poux broyeurs . Il a été démontré que la recombinaison se produit entre les minichromosomes.
Code génétique alternatif
| Organisme | Codon | Standard | Mitochondries |
|---|---|---|---|
| Mammifères | AGA, AGG | Arginine | Codon d'arrêt |
| Invertébrés | AGA, AGG | Arginine | Sérine |
| Champignons | AUC | Leucine | thréonine |
| Tout ce qui précède | AUA | Isoleucine | Méthionine |
| UGA | Codon d'arrêt | Tryptophane |
Alors que de légères variations sur le code génétique standard avaient été prédites auparavant, aucune n'a été découverte jusqu'en 1979, lorsque des chercheurs étudiant les gènes mitochondriaux humains ont déterminé qu'ils utilisaient un code alternatif. Cependant, les mitochondries de nombreux autres eucaryotes, y compris la plupart des plantes, utilisent le code standard. De nombreuses variantes légères ont été découvertes depuis, y compris divers codes mitochondriaux alternatifs. En outre, les codons AUA, AUC et AUU sont tous des codons d'initiation autorisés.
Certaines de ces différences doivent être considérées comme des pseudo-changements du code génétique dus au phénomène d' édition de l' ARN , qui est courant dans les mitochondries. Chez les plantes supérieures, on pensait que CGG codait pour le tryptophane et non pour l' arginine ; cependant, le codon dans l'ARN traité s'est avéré être le codon UGG, cohérent avec le code génétique standard du tryptophane. Il est à noter que le code génétique mitochondrial des arthropodes a subi une évolution parallèle au sein d'un phylum, certains organismes traduisant de manière unique AGG en lysine.
Réplication et héritage
Les mitochondries se divisent par fission mitochondriale , une forme de fission binaire également effectuée par des bactéries, bien que le processus soit étroitement régulé par la cellule eucaryote hôte et implique une communication et un contact avec plusieurs autres organites. La régulation de cette division diffère entre les eucaryotes. Dans de nombreux eucaryotes unicellulaires, leur croissance et leur division sont liés au cycle cellulaire . Par exemple, une seule mitochondrie peut se diviser de manière synchrone avec le noyau. Ce processus de division et de ségrégation doit être étroitement contrôlé afin que chaque cellule fille reçoive au moins une mitochondrie. Chez d'autres eucaryotes (chez les mammifères par exemple), les mitochondries peuvent répliquer leur ADN et se diviser principalement en réponse aux besoins énergétiques de la cellule, plutôt qu'en phase avec le cycle cellulaire. Lorsque les besoins énergétiques d'une cellule sont élevés, les mitochondries se développent et se divisent. Lorsque la consommation d'énergie est faible, les mitochondries sont détruites ou deviennent inactives. Dans de tels exemples, les mitochondries sont apparemment distribuées de manière aléatoire aux cellules filles pendant la division du cytoplasme . La dynamique mitochondriale, l'équilibre entre la fusion mitochondriale et la fission , est un facteur important dans les pathologies associées à plusieurs maladies.
L'hypothèse de la fission binaire mitochondriale s'est appuyée sur la visualisation par microscopie à fluorescence et microscopie électronique à transmission conventionnelle (MET). La résolution de la microscopie à fluorescence (~200 nm) est insuffisante pour distinguer les détails structurels, tels que la double membrane mitochondriale dans la division mitochondriale ou même pour distinguer les mitochondries individuelles lorsque plusieurs sont proches les unes des autres. La MET conventionnelle présente également certaines limitations techniques dans la vérification de la division mitochondriale. La tomographie cryoélectronique a récemment été utilisée pour visualiser la division mitochondriale dans des cellules intactes hydratées congelées. Il a révélé que les mitochondries se divisent par bourgeonnement.
Les gènes mitochondriaux d'un individu ne sont hérités que de la mère, à de rares exceptions près. Chez l'homme, lorsqu'un ovule est fécondé par un spermatozoïde, les mitochondries, et donc l'ADN mitochondrial, proviennent généralement de l'ovule uniquement. Les mitochondries du spermatozoïde pénètrent dans l'ovule, mais ne contribuent pas à l'information génétique de l'embryon. Au lieu de cela, les mitochondries paternelles sont marquées avec de l' ubiquitine pour les sélectionner pour une destruction ultérieure à l'intérieur de l' embryon . L'ovule contient relativement peu de mitochondries, mais ces mitochondries se divisent pour peupler les cellules de l'organisme adulte. Ce mode est observé dans la plupart des organismes, y compris la majorité des animaux. Cependant, les mitochondries de certaines espèces peuvent parfois être héritées paternellement. C'est la norme chez certains conifères , mais pas chez les pins et les ifs . Pour les Mytilides , l'hérédité paternelle ne se produit qu'au sein des mâles de l'espèce. Il a été suggéré qu'il se produit à un niveau très faible chez l'homme.
L'hérédité uniparentale conduit à peu de possibilités de recombinaison génétique entre différentes lignées de mitochondries, bien qu'une seule mitochondrie puisse contenir 2 à 10 copies de son ADN. Quelle recombinaison a lieu maintient l'intégrité génétique plutôt que de maintenir la diversité. Cependant, il existe des études montrant des preuves de recombinaison dans l'ADN mitochondrial. Il est clair que les enzymes nécessaires à la recombinaison sont présentes dans les cellules de mammifères. De plus, des preuves suggèrent que les mitochondries animales peuvent subir une recombinaison. Les données sont plus controversées chez l'homme, bien qu'il existe des preuves indirectes de recombinaison.
On peut s'attendre à ce que les entités subissant un héritage uniparental et avec peu ou pas de recombinaison soient soumises au cliquet de Muller , l'accumulation de mutations délétères jusqu'à ce que la fonctionnalité soit perdue. Les populations animales de mitochondries évitent cette accumulation grâce à un processus de développement connu sous le nom de goulot d'étranglement de l' ADNmt . Le goulot d'étranglement exploite les processus stochastiques dans la cellule pour augmenter la variabilité de cellule à cellule de la charge mutante à mesure qu'un organisme se développe : un seul ovule avec une certaine proportion d'ADNmt mutant produit ainsi un embryon où différentes cellules ont différentes charges mutantes. La sélection au niveau cellulaire peut alors agir pour éliminer les cellules avec plus d'ADNmt mutant, conduisant à une stabilisation ou à une réduction de la charge mutante entre les générations. Le mécanisme sous-jacent au goulot d'étranglement est débattu, une méta-étude mathématique et expérimentale récente fournissant des preuves d'une combinaison de partitionnement aléatoire des ADNmt au niveau des divisions cellulaires et du renouvellement aléatoire des molécules d'ADNmt dans la cellule.
réparation de l'ADN
Les mitochondries peuvent réparer les dommages oxydatifs de l' ADN par des mécanismes analogues à ceux qui se produisent dans le noyau cellulaire . Les protéines utilisées dans la réparation de l' ADNmt sont codées par des gènes nucléaires et sont transloquées vers les mitochondries. Les voies de réparation de l'ADN dans les mitochondries des mammifères comprennent la réparation par excision de base, la réparation de cassure double brin, l'inversion directe et la réparation des mésappariements . De même, les dommages à l'ADN peuvent être contournés, plutôt que réparés, par synthèse translésionnelle.
Parmi les nombreux processus de réparation de l'ADN dans les mitochondries, la voie de réparation par excision de base a été la plus étudiée. La réparation par excision de base est effectuée par une séquence d'étapes catalysées enzymatiques qui incluent la reconnaissance et l'excision d'une base d'ADN endommagée, l'élimination du site abasique résultant, le traitement final, le remplissage des lacunes et la ligature. Un dommage courant dans l'ADNmt qui est réparé par réparation par excision de base est la 8-oxoguanine produite par l'oxydation de la guanine .
Les cassures double brin peuvent être réparées par réparation par recombinaison homologue dans l'ADNmt de mammifère et l'ADNmt de plante. Les cassures double brin dans l'ADNmt peuvent également être réparées par une jonction d'extrémité par microhomologie . Bien qu'il existe des preuves des processus de réparation d'inversion directe et de réparation des mésappariements dans l'ADNmt, ces processus ne sont pas bien caractérisés.
Manque d'ADN mitochondrial
Certains organismes ont complètement perdu leur ADN mitochondrial. Dans ces cas, des gènes codés par l'ADN mitochondrial ont été perdus ou transférés au noyau . Cryptosporidium a des mitochondries dépourvues d'ADN, probablement parce que tous leurs gènes ont été perdus ou transférés. Chez Cryptosporidium , les mitochondries ont un système de génération d' ATP altéré qui rend le parasite résistant à de nombreux inhibiteurs mitochondriaux classiques tels que le cyanure , l' azoture et l' atovaquone . Des mitochondries dépourvues de leur propre ADN ont été trouvées chez un dinoflagellé parasite marin du genre Amoebophyra . Ce micro-organisme, A. cerati , possède des mitochondries fonctionnelles dépourvues de génome. Chez les espèces apparentées, le génome mitochondrial possède toujours trois gènes, mais chez A. cerati, un seul gène mitochondrial - le gène de la cytochrome c oxydase I ( cox1 ) - est trouvé, et il a migré vers le génome du noyau.
Études génétiques des populations
La quasi-absence de recombinaison génétique dans l'ADN mitochondrial en fait une source d'information utile pour l'étude de la génétique des populations et de la biologie évolutive . Parce que tout l'ADN mitochondrial est hérité comme une seule unité, ou haplotype , les relations entre l'ADN mitochondrial de différents individus peuvent être représentées comme un arbre génétique . Les modèles de ces arbres génétiques peuvent être utilisés pour déduire l'histoire évolutive des populations. L'exemple classique en est la génétique évolutive humaine , où l' horloge moléculaire peut être utilisée pour fournir une date récente pour l'Ève mitochondriale . Ceci est souvent interprété comme un fort soutien à une récente expansion humaine moderne hors d'Afrique . Un autre exemple humain est le séquençage de l'ADN mitochondrial à partir d' os de Néandertal . La distance évolutive relativement grande entre les séquences d'ADN mitochondrial des Néandertaliens et des humains vivants a été interprétée comme une preuve de l'absence de croisement entre les Néandertaliens et les humains modernes.
Cependant, l'ADN mitochondrial ne reflète que l'histoire des femelles d'une population. Ceci peut être surmonté en partie par l'utilisation de séquences génétiques paternels, tels que le non-recombiner région du chromosome Y .
Des mesures récentes de l' horloge moléculaire pour l'ADN mitochondrial ont rapporté une valeur de 1 mutation tous les 7884 ans remontant à l'ancêtre commun le plus récent des humains et des singes, ce qui est cohérent avec les estimations des taux de mutation de l'ADN autosomique (10 -8 par base par génération ).
Dysfonctionnement et maladie
Maladies mitochondriales
Les dommages et le dysfonctionnement ultérieur des mitochondries sont un facteur important dans une gamme de maladies humaines en raison de leur influence sur le métabolisme cellulaire. Les troubles mitochondriaux se présentent souvent comme des troubles neurologiques, dont l' autisme . Ils peuvent également se manifester par une myopathie , un diabète , une endocrinopathie multiple et divers autres troubles systémiques. Les maladies provoquées par la mutation dans le ADNmt comprennent le syndrome de Kearns-Sayre , le syndrome MELAS et la neuropathie optique héréditaire de Leber . Dans la grande majorité des cas, ces maladies sont transmises par une femelle à ses enfants, car le zygote tire ses mitochondries et donc son ADNmt de l'ovule. On pense que des maladies telles que le syndrome de Kearns-Sayre, le syndrome de Pearson et l'ophtalmoplégie externe progressive sont dues à des réarrangements à grande échelle de l'ADNmt, tandis que d'autres maladies telles que le syndrome MELAS, la neuropathie optique héréditaire de Leber, le syndrome MERRF et d'autres sont dues à des mutations ponctuelles. dans l'ADNmt.
Dans d'autres maladies, des défauts dans les gènes nucléaires conduisent à un dysfonctionnement des protéines mitochondriales. C'est le cas dans l'ataxie de Friedreich , la paraplégie spastique héréditaire et la maladie de Wilson . Ces maladies sont héritées dans une relation de dominance , comme c'est le cas pour la plupart des autres maladies génétiques. Divers troubles peuvent être causés par des mutations nucléaires des enzymes de phosphorylation oxydative, telles que le déficit en coenzyme Q10 et le syndrome de Barth . Les influences environnementales peuvent interagir avec les prédispositions héréditaires et provoquer une maladie mitochondriale. Par exemple, il peut exister un lien entre l' exposition aux pesticides et l'apparition plus tardive de la maladie de Parkinson . D'autres pathologies d'étiologie impliquant un dysfonctionnement mitochondrial comprennent la schizophrénie , le trouble bipolaire , la démence , la maladie d'Alzheimer , la maladie de Parkinson, l' épilepsie , les accidents vasculaires cérébraux , les maladies cardiovasculaires , le syndrome de fatigue chronique , la rétinite pigmentaire et le diabète sucré .
Le stress oxydatif médié par les mitochondries joue un rôle dans la cardiomyopathie chez les diabétiques de type 2 . L'augmentation de l'apport d'acides gras au cœur augmente l'absorption d'acides gras par les cardiomyocytes, entraînant une augmentation de l'oxydation des acides gras dans ces cellules. Ce processus augmente les équivalents réducteurs disponibles pour la chaîne de transport d'électrons des mitochondries, augmentant finalement la production d'espèces réactives de l'oxygène (ROS). Les ROS augmentent les protéines de découplage (UCP) et potentialisent la fuite de protons à travers le translocateur de nucléotides adénine (ANT), dont la combinaison découple les mitochondries. Le découplage augmente alors la consommation d'oxygène par les mitochondries, aggravant l'augmentation de l'oxydation des acides gras. Cela crée un cercle vicieux de découplage ; de plus, même si la consommation d'oxygène augmente, la synthèse d'ATP n'augmente pas proportionnellement car les mitochondries sont découplées. Une disponibilité moindre de l'ATP entraîne finalement un déficit énergétique se traduisant par une efficacité cardiaque réduite et un dysfonctionnement contractile. Pour aggraver le problème, une altération de la libération de calcium du réticulum sarcoplasmique et une recapture mitochondriale réduite limitent les niveaux cytosoliques de pointe de l'ion de signalisation important pendant la contraction musculaire. La diminution de la concentration de calcium intra-mitochondrial augmente l'activation de la déshydrogénase et la synthèse d'ATP. Ainsi, en plus de la réduction de la synthèse d'ATP due à l'oxydation des acides gras, la synthèse d'ATP est également altérée par une mauvaise signalisation du calcium, ce qui provoque des problèmes cardiaques chez les diabétiques.
Relations avec le vieillissement
Il peut y avoir une fuite des électrons de haute énergie dans la chaîne respiratoire pour former des espèces réactives de l'oxygène . On pensait que cela entraînait un stress oxydatif important dans les mitochondries avec des taux de mutation élevés de l'ADN mitochondrial. Les liens hypothétiques entre le vieillissement et le stress oxydatif ne sont pas nouveaux et ont été proposés en 1956, qui ont ensuite été affinés dans la théorie des radicaux libres mitochondriaux du vieillissement . On pensait qu'un cercle vicieux se produisait, car le stress oxydatif conduit à des mutations de l'ADN mitochondrial, ce qui peut entraîner des anomalies enzymatiques et un stress oxydatif supplémentaire.
Un certain nombre de changements peuvent se produire dans les mitochondries au cours du processus de vieillissement. Les tissus d'hommes âgés montrent une diminution de l'activité enzymatique des protéines de la chaîne respiratoire. Cependant, l'ADNmt muté ne peut être trouvé que dans environ 0,2% des cellules très anciennes. On a émis l'hypothèse que d'importantes délétions dans le génome mitochondrial conduisent à des niveaux élevés de stress oxydatif et de mort neuronale dans la maladie de Parkinson . Il a également été démontré que le dysfonctionnement mitochondrial se produit dans la sclérose latérale amyotrophique .
Étant donné que les mitochondries jouent un rôle central dans la fonction ovarienne, en fournissant l'ATP nécessaire au développement de la vésicule germinale à l' ovocyte mature , une fonction mitochondriale diminuée peut entraîner une inflammation, entraînant une insuffisance ovarienne prématurée et un vieillissement ovarien accéléré. Le dysfonctionnement causé se reflète alors à la fois dans les dommages quantitatifs (tels que le nombre de copies d'ADNmt et les suppressions d'ADNmt), qualitatifs (tels que les mutations et les ruptures de brins) et oxydatifs (tels que les mitochondries dysfonctionnelles dues aux ROS), qui ne sont pas seulement pertinents dans le vieillissement ovarien. , mais perturbent la diaphonie ovocyte-cumulus dans l'ovaire, sont liés à des troubles génétiques (comme l'X fragile) et peuvent interférer avec la sélection des embryons.
Histoire
Les premières observations de structures intracellulaires qui représentaient probablement des mitochondries ont été publiées dans les années 1840. Richard Altmann , en 1890, les a établis en tant qu'organites cellulaires et les a appelés "bioblastes". En 1898, Carl Benda a inventé le terme "mitochondries" du grec μίτος , mitos , "fil", et χονδρίον , chondrion , "granule". Leonor Michaelis a découvert que le vert Janus peut être utilisé comme colorant supravital pour les mitochondries en 1900. En 1904, Friedrich Meves , a fait la première observation enregistrée de mitochondries chez les plantes dans les cellules du nénuphar blanc, Nymphaea alba et en 1908, avec Claudius Regaud , suggèrent qu'ils contiennent des protéines et des lipides. Benjamin F. Kingsbury, en 1912, les a d'abord liés à la respiration cellulaire, mais presque exclusivement sur la base d'observations morphologiques. En 1913, des particules d'extraits de foie de cobaye furent liées à la respiration par Otto Heinrich Warburg , qu'il appela « grana ». Warburg et Heinrich Otto Wieland , qui avaient également postulé un mécanisme de particules similaire, étaient en désaccord sur la nature chimique de la respiration. Ce n'est qu'en 1925, lorsque David Keilin découvre les cytochromes , que la chaîne respiratoire est décrite.
En 1939, des expériences utilisant des cellules musculaires hachées ont démontré que la respiration cellulaire utilisant un atome d'oxygène peut former deux molécules d'adénosine triphosphate (ATP), et en 1941, le concept des liaisons phosphate de l'ATP étant une forme d'énergie dans le métabolisme cellulaire a été développé par Fritz Albert Lipmann . Au cours des années suivantes, le mécanisme de la respiration cellulaire a été approfondi, bien que son lien avec les mitochondries ne soit pas connu. L'introduction du fractionnement tissulaire par Albert Claude a permis d'isoler les mitochondries des autres fractions cellulaires et d'effectuer des analyses biochimiques sur elles seules. En 1946, il conclut que la cytochrome oxydase et d'autres enzymes responsables de la chaîne respiratoire étaient isolées des mitochondries. Eugene Kennedy et Albert Lehninger ont découvert en 1948 que les mitochondries sont le site de la phosphorylation oxydative chez les eucaryotes. Au fil du temps, la méthode de fractionnement a été perfectionnée, améliorant la qualité des mitochondries isolées, et d'autres éléments de la respiration cellulaire ont été déterminés comme se produisant dans les mitochondries.
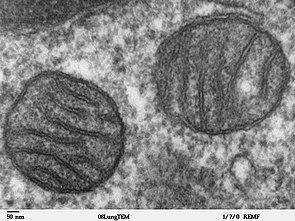
Les premières micrographies électroniques à haute résolution sont apparues en 1952, remplaçant les colorations au vert de Janus comme moyen privilégié pour visualiser les mitochondries. Cela a conduit à une analyse plus détaillée de la structure des mitochondries, y compris la confirmation qu'elles étaient entourées d'une membrane. Il a également montré une deuxième membrane à l'intérieur des mitochondries qui se repliait en crêtes divisant la chambre interne et que la taille et la forme des mitochondries variaient d'une cellule à l'autre.
Le terme populaire « centrale de la cellule » a été inventé par Philip Siekevitz en 1957.
En 1967, on a découvert que les mitochondries contenaient des ribosomes . En 1968, des méthodes ont été développées pour cartographier les gènes mitochondriaux, avec la carte génétique et physique de l'ADN mitochondrial de levure achevée en 1976.
Voir également
Les références
Général
-
 Cet article incorpore du matériel du domaine public du document NCBI : "Science Primer" .
Cet article incorpore du matériel du domaine public du document NCBI : "Science Primer" .
Liens externes
- Lane, Nick (2016). La question vitale : énergie, évolution et origines de la vie complexe . WW Norton & Compagnie. ISBN 978-0393352979.
- Mitodb.com – La base de données des maladies mitochondriales.
- Atlas des mitochondries à l' Université de Mayence
- Portail de recherche sur les mitochondries sur mitochondrial.net
- Mitochondries : l'architecture dicte la fonction à cytochemistry.net
- Liens mitochondries à l' Université de l'Alabama
- Société de physiologie mitochondriale MIP
- Structures 3D de protéines de la membrane mitochondriale interne à l' Université du Michigan
- Structures 3D de protéines associées à la membrane mitochondriale externe à l' Université du Michigan
- Partenariat pour les protéines mitochondriales à l' Université du Wisconsin
- MitoMiner – Une base de données de protéomique mitochondriale à l'unité de biologie mitochondriale du MRC
- Mitochondrie – Base de données centrée sur les cellules
- Mitochondrie reconstruite par tomographie électronique à l'Université d'État de San Diego
- Clip vidéo de la mitochondrie du foie de rat de la tomographie cryoélectronique