Neurofilament - Neurofilament
| Protéine de neurofilament de bas poids moléculaire NF-L | |||||||
|---|---|---|---|---|---|---|---|
| Identifiants | |||||||
| symbole | NEFL | ||||||
| gène NCBI | 4747 | ||||||
| HGNC | 7739 | ||||||
| OMIM | 162280 | ||||||
| RéfSeq | NM_006158 | ||||||
| UniProt | P07196 | ||||||
| Autre informations | |||||||
| Lieu | Chr. 8 p21 | ||||||
| |||||||
| Protéine de neurofilament de poids moléculaire moyen NF-M | |||||||
|---|---|---|---|---|---|---|---|
| Identifiants | |||||||
| symbole | NEFM | ||||||
| Alt. symboles | NEF3 | ||||||
| gène NCBI | 4741 | ||||||
| HGNC | 7734 | ||||||
| OMIM | 162250 | ||||||
| RéfSeq | NM_005382 | ||||||
| UniProt | P07197 | ||||||
| Autre informations | |||||||
| Lieu | Chr. 8 p21 | ||||||
| |||||||
| Protéine de neurofilament de haut poids moléculaire NF-H | |||||||
|---|---|---|---|---|---|---|---|
| Identifiants | |||||||
| symbole | NEFH | ||||||
| gène NCBI | 4744 | ||||||
| HGNC | 7737 | ||||||
| OMIM | 162230 | ||||||
| RéfSeq | NM_021076 | ||||||
| UniProt | P12036 | ||||||
| Autre informations | |||||||
| Lieu | Chr. 22 q12.1-13.1 | ||||||
| |||||||
| Protéine de filament intermédiaire neuronal alpha-internexine | |||||||
|---|---|---|---|---|---|---|---|
| Identifiants | |||||||
| symbole | DANS UN | ||||||
| Alt. symboles | NEF5 | ||||||
| gène NCBI | 9118 | ||||||
| HGNC | 6057 | ||||||
| OMIM | 605338 | ||||||
| RéfSeq | NM_032727 | ||||||
| UniProt | Q5SYD2 | ||||||
| Autre informations | |||||||
| Lieu | Chr. 10 q24 | ||||||
| |||||||
| Protéine de filament intermédiaire neuronal périphérine | |||||||
|---|---|---|---|---|---|---|---|
| Identifiants | |||||||
| symbole | PRPH | ||||||
| Alt. symboles | NEF4 | ||||||
| gène NCBI | 5630 | ||||||
| HGNC | 9461 | ||||||
| OMIM | 170710 | ||||||
| RéfSeq | NM_006262.3 | ||||||
| UniProt | P41219 | ||||||
| Autre informations | |||||||
| Lieu | Chr. 12 q13.12 | ||||||
| |||||||
| Protéine de filament intermédiaire de cellules souches neuronales Nestine | |||||||
|---|---|---|---|---|---|---|---|
| Identifiants | |||||||
| symbole | NDA | ||||||
| gène NCBI | 10763 | ||||||
| HGNC | 7756 | ||||||
| OMIM | 600915 | ||||||
| RéfSeq | NP_006608 | ||||||
| UniProt | P48681 | ||||||
| Autre informations | |||||||
| Lieu | Chr. 1 q23.1 | ||||||
| |||||||
Les neurofilaments ( NF ) sont classés comme des filaments intermédiaires de type IV trouvés dans le cytoplasme des neurones . Ce sont des polymères protéiques mesurant 10 nm de diamètre et plusieurs micromètres de longueur. Avec les microtubules (~25 nm) et les microfilaments (7 nm), ils forment le cytosquelette neuronal . On pense qu'ils fonctionnent principalement pour fournir un support structurel aux axones et pour réguler le diamètre des axones, ce qui influence la vitesse de conduction nerveuse . Les protéines qui forment les neurofilaments appartiennent à la famille des protéines des filaments intermédiaires, qui est divisée en six types en fonction de leur organisation génétique et de leur structure protéique. Les types I et II sont les kératines qui s'expriment dans les épithéliums. Le type III contient les protéines vimentine , desmine , périphérine et protéine acide fibrillaire gliale (GFAP). Le type IV comprend les protéines neurofilamentaires L, M, H et l' internexine . Le type V se compose des lamines nucléaires et le type VI se compose de la protéine nestine . Les gènes des filaments intermédiaires de type IV partagent tous deux introns uniques non trouvés dans d'autres séquences de gènes de filaments intermédiaires, suggérant une origine évolutive commune à partir d'un gène primitif de type IV.
Tout filament protéique qui s'étend dans le cytoplasme d'une cellule nerveuse est également appelé neurofibrille . Ce nom est utilisé dans les enchevêtrements neurofibrillaires de certaines maladies neurodégénératives .
Protéines neurofilamentaires
La composition protéique des neurofilaments varie considérablement d'un phylum animal à l'autre. On en sait plus sur les neurofilaments de mammifères. Historiquement, on pensait à l'origine que les neurofilaments des mammifères étaient composés de seulement trois protéines appelées protéines de neurofilament L (faible poids moléculaire ; NFL ), M (poids moléculaire moyen ; NFM ) et H (poids moléculaire élevé ; NFH ). Ces protéines ont été découvertes à partir d'études sur le transport axonal et sont souvent appelées « triplet de neurofilaments ». Cependant, il est maintenant clair que les neurofilaments contiennent également la protéine internexine et que les neurofilaments du système nerveux périphérique peuvent également contenir la protéine périphérine. (c'est différent de la périphérine 2 qui est exprimée dans la rétine ). Ainsi, les neurofilaments de mammifères sont des hétéropolymères de jusqu'à cinq protéines différentes : NfL, NfM, NfH, internexine-alpha et périphérine. Les cinq protéines des neurofilaments peuvent co-assembler dans différentes combinaisons dans différents types de cellules nerveuses et à différents stades de développement. La composition précise des neurofilaments dans une cellule nerveuse donnée dépend des niveaux d'expression relatifs des protéines des neurofilaments dans la cellule à ce moment-là. Par exemple, l'expression de NfH est faible dans les neurones en développement et augmente après la naissance dans les neurones à axones myélinisés. Dans le système nerveux adulte, les neurofilaments des petits axones non myélinisés contiennent plus de périphérine et moins de NfH, tandis que les neurofilaments des grands axones myélinisés contiennent plus de NfH et moins de périphérine. La sous-unité du filament intermédiaire de type III, la vimentine , est exprimée dans les neurones en développement et quelques neurones très inhabituels chez l'adulte en association avec des protéines de type IV, comme les neurones horizontaux de la rétine .
| Protéine | Acides aminés | NCBI Réf Seq | Masse moléculaire prévue | Masse moléculaire apparente (SDS-PAGE) |
|---|---|---|---|---|
| Périphérine | 470 | NP_006253.2 | 53,7 kDa | ~56 kDa |
| Internexine | 499 | NP_116116.1 | 55,4 kDa | ~66 kDa |
| Protéine neurofilamentaire L | 543 | NP_006149.2 | 61,5 kDa | ~70 kDa |
| Protéine neurofilamentaire M | 916 | NP_005373.2 | 102,5 kDa | ~160 kDa |
| Protéine neurofilamentaire H | 1020 | NP_066554.2 | 111,9 kDA | ~200 kDa |
Les protéines triplets sont nommées en fonction de leur taille relative (faible, moyenne, élevée). La masse moléculaire apparente de chaque protéine déterminée par SDS-PAGE est supérieure à la masse prédite à partir de la séquence amino. Ceci est dû à la migration électrophorétique anormale de ces protéines et est particulièrement extrême pour les protéines des neurofilaments M et H en raison de leur teneur élevée en acides aminés chargés et de leur phosphorylation étendue. Les trois protéines triplet de neurofilaments contiennent de longues étendues de séquence polypeptidique riches en acides glutamique et en résidus de lysine , et NfM et en particulier NfH contiennent également de multiples sites de phosphorylation de sérine répétés en tandem . Ces sites contiennent presque tous le peptide lysine-sérine-proline (KSP), et la phosphorylation se trouve normalement sur les neurofilaments axonaux et non dendritiques. Le NfM humain possède 13 de ces sites KSP, tandis que le NF-H humain est exprimé à partir de deux allèles dont l' un produit 44 et l'autre 45 répétitions KSP.
Assemblage et structure des neurofilaments
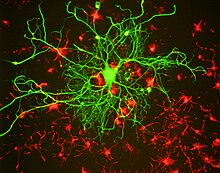
Comme d'autres protéines de filament intermédiaire, les protéines de neurofilament partagent toutes une région hélicoïdale alpha centrale commune , connue sous le nom de domaine de tige en raison de sa structure tertiaire en forme de tige, flanquée de domaines amino-terminal et carboxy-terminal qui sont largement non structurés. Les domaines de tige de deux protéines de neurofilament se dimérisent pour former une spirale enroulée en hélice alpha . Deux dimères s'associent de manière antiparallèle décalée pour former un tétramère. On pense que ce tétramère est la sous-unité de base (c'est-à-dire le bloc de construction) du neurofilament. Les sous-unités tétramères s'associent côte à côte pour former des filaments de longueur unitaire, qui s'hybrident ensuite bout à bout pour former le polymère neurofilament mature, mais l'organisation précise de ces sous-unités au sein du polymère n'est pas connue, en grande partie à cause de la protéine hétérogène. composition et l'incapacité à cristalliser les neurofilaments ou les protéines des neurofilaments. Les modèles structurels supposent généralement huit tétramères (32 polypeptides de neurofilaments) dans une section transversale de filament, mais les mesures de la densité de masse linéaire suggèrent que cela peut varier.
Les domaines amino-terminaux des protéines des neurofilaments contiennent de nombreux sites de phosphorylation et semblent être importants pour les interactions des sous-unités lors de l'assemblage des filaments. Les domaines carboxy terminaux semblent être des domaines intrinsèquement désordonnés qui manquent d'hélice alpha ou de feuille bêta. Les différentes tailles des protéines des neurofilaments sont en grande partie dues aux différences de longueur des domaines carboxy terminaux. Ces domaines sont riches en résidus d'acides aminés acides et basiques. Les domaines carboxy terminaux de NFM et NFH sont les plus longs et sont largement modifiés par des modifications post-traductionnelles telles que la phosphorylation et la glycosylation in vivo. Ils se projettent radialement à partir de l'épine dorsale du filament pour former une bordure de brosse dense de domaines hautement chargés et non structurés analogues aux poils d'un goupillon. Ces domaines de battement entropique ont été proposés pour définir une zone d'exclusion autour de chaque filament, espaçant efficacement les filaments de leurs voisins. De cette façon, les projections terminales carboxy maximisent les propriétés de remplissage d'espace des polymères de neurofilaments. En microscopie électronique, ces domaines apparaissent comme des projections appelées bras latéraux qui semblent entrer en contact avec les filaments voisins.

Fonction neurofilamentaire

Les neurofilaments se trouvent dans les neurones des vertébrés à des concentrations particulièrement élevées dans les axones, où ils sont tous alignés en parallèle le long du grand axe de l'axone formant un réseau qui se chevauche continuellement. Ils ont été proposés pour fonctionner comme des structures de remplissage d'espace qui augmentent le diamètre axonal. Leur contribution au diamètre de l'axone est déterminée par le nombre de neurofilaments dans l'axone et leur densité de tassement. On pense que le nombre de neurofilaments dans l'axone est déterminé par l'expression des gènes des neurofilaments et le transport axonal. La densité de tassement des filaments est déterminée par leurs bras latéraux qui définissent l'espacement entre les filaments voisins. On pense que la phosphorylation des bras latéraux augmente leur extensibilité, augmentant l'espacement entre les filaments voisins par la liaison de cations divalents entre les bras des filaments adjacents
Au début du développement, les axones sont des processus étroits qui contiennent relativement peu de neurofilaments. Les axones qui deviennent myélinisés accumulent plus de neurofilaments, ce qui entraîne l'expansion de leur calibre. Une fois qu'un axone s'est développé et s'est connecté à sa cellule cible , le diamètre de l'axone peut être multiplié par cinq. Ceci est causé par une augmentation du nombre de neurofilaments exportés du corps des cellules nerveuses ainsi qu'un ralentissement de leur vitesse de transport. Dans les axones myélinisés matures, les neurofilaments peuvent être la structure cytoplasmique la plus abondante et peuvent occuper la majeure partie de la section transversale axonale. Par exemple, un gros axone myélinisé peut contenir des milliers de neurofilaments dans une section transversale
Transport de neurofilaments
En plus de leur rôle structurel dans les axones, les neurofilaments sont également des cargaisons de transport axonal . La plupart des protéines des neurofilaments dans les axones sont synthétisées dans le corps des cellules nerveuses, où elles s'assemblent rapidement en polymères de neurofilaments en 30 minutes environ. Ces polymères de neurofilaments assemblés sont transportés le long de l'axone sur des pistes microtubulaires alimentées par des protéines motrices des microtubules . Les filaments se déplacent dans les deux sens, c'est-à-dire à la fois vers la pointe de l'axone (antérograde) et vers le corps cellulaire (rétrograde), mais la direction nette est antérograde. Les filaments se déplacent à des vitesses allant jusqu'à 8 µm/s sur de courtes échelles de temps (secondes ou minutes), avec des vitesses moyennes d'environ 1 µm/s. Cependant, la vélocité moyenne sur des échelles de temps plus longues (heures ou jours) est lente car les mouvements sont très peu fréquents, consistant en de brefs sprints interrompus par de longues pauses. Ainsi, sur de longues échelles de temps, les neurofilaments se déplacent dans la composante lente du transport axonal.
Applications cliniques et de recherche
De nombreux anticorps spécifiques aux protéines des neurofilaments ont été développés et sont disponibles dans le commerce. Ces anticorps peuvent être utilisés pour détecter les protéines des neurofilaments dans les cellules et les tissus en utilisant la microscopie à immunofluorescence ou l' immunohistochimie . De tels anticorps sont largement utilisés pour identifier les neurones et leurs processus dans des coupes histologiques et en culture tissulaire . La protéine de filament intermédiaire de type VI Nestin est exprimée dans les neurones et la glie en développement. La nestine est considérée comme un marqueur des cellules souches neuronales, et la présence de cette protéine est largement utilisée pour définir la neurogenèse . Cette protéine est perdue au fur et à mesure du développement.
Les anticorps neurofilaments sont également couramment utilisés en neuropathologie diagnostique . La coloration avec ces anticorps permet de distinguer les neurones (positifs pour les protéines des neurofilaments) de la glie (négatifs pour les protéines des neurofilaments).
Il existe également un intérêt clinique considérable pour l'utilisation des protéines des neurofilaments comme biomarqueurs des lésions axonales dans les maladies affectant le système nerveux central. Lorsque les neurones ou les axones dégénèrent, les protéines des neurofilaments sont libérées dans le sang ou le liquide céphalo-rachidien. Les dosages immunologiques des protéines des neurofilaments dans le liquide céphalo-rachidien et le plasma peuvent ainsi servir d'indicateurs de lésions axonales dans les troubles neurologiques. NfL est un marqueur utile pour la surveillance de la maladie dans la sclérose latérale amyotrophique , la sclérose en plaques et plus récemment la maladie de Huntington . Il a également été évalué en tant que marqueur pronostique des résultats fonctionnels après un AVC ischémique aigu.
Les souris mutantes présentant des anomalies des neurofilaments ont des phénotypes ressemblant à la sclérose latérale amyotrophique .
