Neurulation - Neurulation
| Neurulation | |
|---|---|
 Coupes transversales qui montrent la progression de la plaque neurale vers le sillon neural de bas en haut
| |
| Identifiants | |
| Engrener | D054261 |
| Terminologie anatomique | |
Neurulation se réfère au processus de pliage dans vertébrés embryons , qui comprend la transformation de la plaque neurale dans le tube neural . L'embryon à ce stade est appelé la neurule .
Le processus commence lorsque la notocorde induit la formation du système nerveux central (SNC) en signalant à la couche germinale de l'ectoderme au-dessus d'elle de former la plaque neurale épaisse et plate . La plaque neurale se replie sur elle-même pour former le tube neural , qui se différenciera plus tard en moelle épinière et en cerveau , formant finalement le système nerveux central. Des simulations informatiques ont révélé que le calage cellulaire et la prolifération différentielle sont suffisants pour la neurulation des mammifères.
Différentes parties du tube neural se forment par deux processus différents, appelés neurulation primaire et secondaire, chez différentes espèces.
- Dans la neurulation primaire , la plaque neurale se plie vers l'intérieur jusqu'à ce que les bords entrent en contact et fusionnent.
- Dans la neurulation secondaire , le tube se forme en creusant à l'intérieur d'un précurseur solide.
La neurulation primaire
Induction neurale primaire
Le concept d'induction est né des travaux de Pandor en 1817. Les premières expériences prouvant l'induction ont été attribuées par Viktor Hamburger aux découvertes indépendantes de Hans Spemann d'Allemagne en 1901 et de Warren Lewis des États-Unis en 1904. C'est Hans Spemann qui a le premier popularisé le terme « induction neurale primaire » en référence à la première différenciation de l'ectoderme en tissu neural au cours de la neurulation. On l'appelait "primaire" car on pensait qu'il s'agissait du premier événement d'induction dans l'embryogenèse. L'expérience lauréate du prix Nobel a été réalisée par son étudiante Hilda Mangold . L'ectoderme de la région de la lèvre dorsale du blastopore d'un embryon de salamandre en développement a été transplanté dans un autre embryon et ce tissu « organisateur » a « induit » la formation d'un axe secondaire complet changeant le tissu environnant dans l'embryon d'origine du tissu ectodermique au tissu neural. Le tissu de l'embryon donneur a donc été appelé inducteur car il a induit le changement. Il est important de noter que bien que l'organisateur soit la lèvre dorsale du blastopore, il ne s'agit pas d'un ensemble de cellules, mais plutôt d'un groupe de cellules en constante évolution qui migrent sur la lèvre dorsale du blastopore en formant des cellules en bouteille resserrées au niveau de l'apex. À un moment donné pendant la gastrulation, il y aura différentes cellules qui composent l'organisateur.
Des travaux ultérieurs sur les inducteurs effectués par des scientifiques au cours du 20e siècle ont démontré que non seulement la lèvre dorsale du blastopore pouvait agir comme un inducteur, mais aussi un grand nombre d'autres éléments apparemment sans rapport. Cela a commencé lorsque l'ectoderme bouilli s'est avéré encore capable d'induire par Johannes Holtfreter . Des éléments aussi divers qu'un pH bas, l'AMP cyclique et même la poussière de sol pourraient agir comme des inducteurs entraînant une consternation considérable. Même les tissus qui ne pouvaient pas induire lorsqu'ils étaient vivants pouvaient induire lorsqu'ils étaient bouillis. D'autres éléments tels que le saindoux, la cire, les peaux de banane et le sang de grenouille coagulé n'ont pas induit. La recherche d'une molécule inductrice à base chimique a été reprise par les biologistes moléculaires du développement et une vaste littérature d'articles ayant des capacités d'inducteur a continué de croître. Plus récemment, la molécule inductrice a été attribuée aux gènes et en 1995, un appel a été lancé pour que tous les gènes impliqués dans l'induction neurale primaire et toutes leurs interactions soient catalogués afin de déterminer « la nature moléculaire de l'organisateur de Spemann ». Plusieurs autres protéines et facteurs de croissance ont également été invoqués comme inducteurs, notamment des facteurs de croissance solubles tels que la protéine morphogénétique osseuse et une exigence de « signaux inhibiteurs » tels que la noggine et la follistatine .
Même avant que le terme induction ne soit popularisé, plusieurs auteurs, à commencer par Hans Driesch en 1894, ont suggéré que l'induction neurale primaire pourrait être de nature mécanique. Un modèle mécanochimique d'induction neurale primaire a été proposé en 1985 par Brodland & Gordon . Il a été démontré qu'une onde physique réelle de contraction provient de l'emplacement précis de l'organisateur de Spemann qui traverse ensuite l'épithélium neural présumé et d'un modèle de travail complet de la façon dont les inductions neurales primaires ont été proposées en 2006. Il y a longtemps eu une réticence générale dans le domaine pour envisager la possibilité que l'induction neurale primaire pourrait être initiée par des effets mécaniques. Une explication complète de l'induction neurale primaire reste à trouver.
Changement de forme
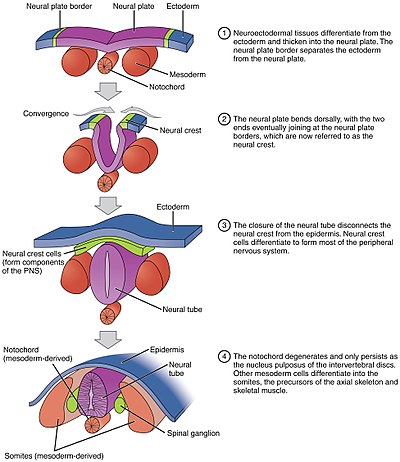
Au fur et à mesure que la neurulation progresse après l'induction, les cellules de la plaque neurale deviennent des colonnes hautes et peuvent être identifiées par microscopie comme étant différentes de l'ectoderme épithélial présumé environnant ( endoderme épiblastique dans les amniotes). Les cellules se déplacent latéralement et s'éloignent de l'axe central et se transforment en une forme de pyramide tronquée. Cette forme pyramidale est obtenue grâce à la tubuline et à l' actine dans la partie apicale de la cellule qui se contracte lorsqu'elles se déplacent. La variation des formes cellulaires est partiellement déterminée par l'emplacement du noyau dans la cellule, provoquant un gonflement dans les zones des cellules forçant la hauteur et la forme de la cellule à changer. Ce processus est connu sous le nom de constriction apicale . Le résultat est un aplatissement de la plaque neurale différenciatrice qui est particulièrement évident chez les salamandres lorsque la gastrula précédemment ronde devient une boule arrondie avec un sommet plat. Voir plaque neurale
Pliant
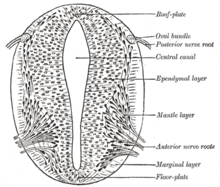
Le processus de repliement de la plaque neurale plate dans le tube neural cylindrique est appelé neurulation primaire . En raison des changements de forme cellulaire, la plaque neurale forme le point de charnière médial (MHP). L'épiderme en expansion exerce une pression sur le MHP et provoque le pliage de la plaque neurale, ce qui entraîne des plis neuraux et la création du sillon neural . Les plis neuraux forment des points de charnière dorsolatérale (DLHP) et la pression sur cette charnière provoque la rencontre et la fusion des plis neuraux sur la ligne médiane. La fusion nécessite la régulation des molécules d'adhésion cellulaire. La plaque neurale passe de l'expression de la E-cadhérine à l'expression de la N-cadhérine et de la N-CAM pour se reconnaître comme le même tissu et fermer le tube. Ce changement d'expression arrête la liaison du tube neural à l'épiderme. Le pliage de la plaque neurale est une étape compliquée.
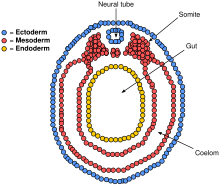
La notocorde joue un rôle essentiel dans le développement du tube neural. Avant la neurulation, lors de la migration des cellules de l'endoderme épiblastique vers l'endoderme hypoblastique, le processus notochordal s'ouvre dans un arc appelé plaque notochordale et attache le neuroépithélium sus-jacent à la plaque neurale. La plaque notochordale sert alors d'ancrage pour la plaque neurale et pousse les deux bords de la plaque vers le haut tout en maintenant la partie médiane ancrée. Certaines des cellules notochodrales s'incorporent dans la plaque neurale de la section centrale pour former plus tard la plaque de plancher du tube neural. La plaque de notocorde se sépare et forme la notocorde solide.
Le pliage du tube neural pour former un véritable tube ne se produit pas d'un seul coup. Au lieu de cela, il commence approximativement au niveau du quatrième somite au stade Carnegie 9 (autour du jour embryonnaire 20 chez l' homme ). Les bords latéraux de la plaque neurale se touchent sur la ligne médiane et se rejoignent. Cela continue à la fois crânien (vers la tête) et caudale (vers la queue). Les ouvertures qui se forment dans les régions crânienne et caudale sont appelées neuropores crâniens et caudaux . Dans les embryons humains , le neuropore crânien se ferme approximativement au jour 24 et le neuropore caudal au jour 28. L'échec de la fermeture des neuropores crâniens (supérieur) et caudal (inférieur) entraîne des affections appelées anencéphalie et spina bifida , respectivement. De plus, l'incapacité du tube neural à se fermer sur toute la longueur du corps entraîne une affection appelée rachischisis .
Motifs
Selon le modèle French Flag où les stades de développement sont dirigés par des gradients de produits géniques, plusieurs gènes sont considérés comme importants pour induire des motifs dans la plaque neurale ouverte, en particulier pour le développement de placodes neurogènes . Ces placodes deviennent d'abord évidents histologiquement dans la plaque neurale ouverte. Après que la signalisation sonic hedgehog (SHH) de la notochorde ait induit sa formation, la plaque de plancher du tube neural naissant sécrète également SHH. Après fermeture, le tube neural forme une plaque basale ou de plancher et un toit ou une plaque alaire en réponse aux effets combinés de SHH et de facteurs incluant BMP4 sécrétés par la plaque de toit. La plaque basale forme la majeure partie de la partie ventrale du système nerveux, y compris la partie motrice de la moelle épinière et du tronc cérébral; la plaque alaire forme les parties dorsales, consacrées principalement au traitement sensoriel.
L'épiderme dorsal exprime BMP4 et BMP7 . La plaque de toit du tube neural répond à ces signaux en exprimant davantage de signaux BMP4 et d'autres signaux de facteur de croissance transformant bêta (TGF-β) pour former un gradient dorsal/ventral parmi le tube neural. La notocorde exprime SHH. La plaque de sol répond à SHH en produisant son propre SHH et en formant un gradient. Ces gradients permettent l'expression différentielle des facteurs de transcription.
Complexités du modèle
La fermeture du tube neural n'est pas entièrement comprise. La fermeture du tube neural varie selon les espèces. Chez les mammifères, la fermeture se produit en se rencontrant en plusieurs points qui se ferment ensuite de haut en bas. Chez les oiseaux, la fermeture du tube neural commence en un point du mésencéphale et se déplace vers l'avant et l'arrière.
neurulation secondaire
La neurulation primaire se développe en neurulation secondaire lorsque le neuropore caudal subit une fermeture définitive. La cavité de la moelle épinière s'étend dans la moelle neurale. Dans la neurulation secondaire, l'ectoderme neural et certaines cellules de l'endoderme forment le cordon médullaire . Le cordon médullaire se condense, se sépare puis forme des cavités. Ces cavités fusionnent alors pour former un seul tube. La neurulation secondaire se produit dans la section postérieure de la plupart des animaux, mais elle est mieux exprimée chez les oiseaux. Les tubes de la neurulation primaire et secondaire se connectent finalement vers la sixième semaine de développement.
Chez l'homme, les mécanismes de la neurulation secondaire jouent un rôle important étant donné son impact sur la bonne formation de la moelle épinière postérieure humaine. Des erreurs à tout moment du processus peuvent entraîner des problèmes. Par exemple, le cordon médullaire retenu se produit en raison d'un arrêt partiel ou complet de la neurulation secondaire qui crée une partie non fonctionnelle à l'extrémité vestigiale.
Développement précoce du cerveau
La partie antérieure du tube neural forme les trois parties principales du cerveau : le cerveau antérieur ( prosencéphale ), le mésencéphale ( mésencéphale ) et le cerveau postérieur ( rhombencéphale ). Ces structures apparaissent initialement juste après la fermeture du tube neural sous forme de renflements appelés vésicules cérébrales selon un modèle spécifié par les gènes de structuration antéro-postérieure, y compris les gènes Hox , d'autres facteurs de transcription tels que les gènes Emx, Otx et Pax, et les facteurs de signalisation sécrétés tels que la croissance des fibroblastes. facteurs (FGF) et Wnts . Ces vésicules cérébrales se divisent en sous-régions. Le prosencéphale donne naissance au télencéphale et au diencéphale , et le rhombencéphale engendre le métencéphale et le myélencéphale . Le cerveau postérieur, qui est la partie évolutive la plus ancienne du cerveau des cordés , se divise également en différents segments appelés rhombomères . Les rhombomères génèrent bon nombre des circuits neuronaux les plus essentiels nécessaires à la vie, y compris ceux qui contrôlent la respiration et la fréquence cardiaque, et produisent la plupart des nerfs crâniens . Les cellules de la crête neurale forment des ganglions au-dessus de chaque rhombomère. Le tube neural précoce est principalement composé du neuroépithélium germinatif , appelé plus tard zone ventriculaire , qui contient des cellules souches neurales primaires appelées cellules gliales radiales et sert de source principale de neurones produits pendant le développement du cerveau par le processus de neurogenèse .
Tissu d'ectoderme non neuronal
Le mésoderme paraxial entourant la notocorde sur les côtés va se développer en somites (futurs muscles, os, et contribue à la formation des membres du vertébré ).
Cellules de la crête neurale
Des masses de tissu appelées crête neurale qui sont situées sur les bords mêmes des plaques latérales du tube neural pliant se séparent du tube neural et migrent pour devenir une variété de cellules différentes mais importantes.
Les cellules de la crête neurale migreront à travers l'embryon et donneront naissance à plusieurs populations cellulaires, dont les cellules pigmentaires et les cellules du système nerveux périphérique.
Anomalies du tube neural
L'échec de la neurulation, en particulier l'échec de la fermeture du tube neural, sont parmi les malformations congénitales les plus courantes et les plus invalidantes chez l'homme, se produisant dans environ 1 naissance vivante sur 500. L'échec de la fermeture de l'extrémité rostrale du tube neural entraîne une anencéphalie , ou un manque de développement cérébral, et est le plus souvent fatal. L'échec de la fermeture de l'extrémité caudale du tube neural provoque une maladie connue sous le nom de spina bifida , dans laquelle la moelle épinière ne se ferme pas.
Voir également
Les références
Lectures complémentaires
- Almeida, Karla L.; et al. (2010). "Induction neuronale" . Dans Henning, Ulrich (éd.). Perspectives des cellules souches : des outils d'étude des mécanismes de différenciation neuronale à la thérapie . Springer. ISBN 978-90-481-3374-1.
- Basch, Martín L.; Bonner-Fraser, Marianne (2006). « Signaux induisant la crête neurale » . Dans Saint-Jennet, Jean-Pierre (éd.). Induction et différenciation de la crête neurale . Springer. ISBN 978-0-387-35136-0.
- Harland, Richard M. (1997). "L'induction neuronale chez Xenopus " . Dans Cowan, W. Maxwell (éd.). Approches moléculaires et cellulaires du développement neural . Presses de l'Université d'Oxford. ISBN 978-0-19-511166-8.
- Ladher, Raj ; Schoenwolf, Gary C. (2004). "Fabriquer un tube neural" . Dans Jacobson, Marcus ; Rao, Mahendra S. (éd.). Neurobiologie du développement . Springer. ISBN 978-0-306-48330-1.
- Tian, Jing ; Sampath, Karuna (2004). "Formation et fonctions de la plaque de sol". En Gong, Zhiyuan ; Korzh, Vladimir (éd.). Développement et génétique des poissons : les modèles poisson zèbre et médaka . Scientifique du monde. p. 123 , 139-140 . ISBN 978-981-238-821-6.
- Zhang, Su-Chun (2005). "Spécification neuronale à partir de cellules souches embryonnaires humaines" . Dans Odorico, John S.; et al. (éd.). Cellules souches embryonnaires humaines . Science de la guirlande. ISBN 978-1-85996-278-7.