Nicotinamide adénine dinucléotide -Nicotinamide adenine dinucleotide
|
|

|
|
| Des noms | |
|---|---|
| Autres noms
Nucléotide diphosphopyridine (DPN + ), Coenzyme I
|
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Carte d'information de l'ECHA | 100.000.169 |
| KEGG | |
|
CID PubChem
|
|
| Numéro RTECS | |
| UNII | |
|
|
|
|
| Propriétés | |
| C 21 H 28 N 7 O 14 P 2 | |
| Masse molaire | 663,43 g/mol |
| Apparence | poudre blanche |
| Point de fusion | 160 ° C (320 ° F; 433 K) |
| Dangers | |
| Sécurité et santé au travail (SST/SST) : | |
|
Principaux dangers
|
Non dangereux |
| NFPA 704 (diamant de feu) | |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa).
|
|
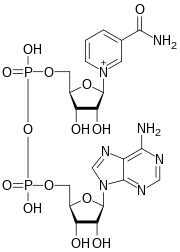
Le nicotinamide adénine dinucléotide ( NAD ) est une coenzyme centrale au métabolisme . Trouvé dans toutes les cellules vivantes , le NAD est appelé un dinucléotide car il se compose de deux nucléotides reliés par leurs groupes phosphate . Un nucléotide contient une nucléobase d' adénine et l'autre du nicotinamide . Le NAD existe sous deux formes : une forme oxydée et une forme réduite , abrégées respectivement NAD + et NADH (H pour hydrogène ).
Dans le métabolisme , le nicotinamide adénine dinucléotide est impliqué dans les réactions redox , transportant les électrons d'une réaction à l'autre. Le cofacteur se trouve donc sous deux formes dans les cellules : NAD + est un agent oxydant – il accepte les électrons d'autres molécules et se réduit . Cette réaction, également avec H + , forme du NADH, qui peut ensuite être utilisé comme agent réducteur pour donner des électrons. Ces réactions de transfert d'électrons sont la fonction principale du NAD. Cependant, il est également utilisé dans d'autres processus cellulaires, notamment en tant que substrat d' enzymes dans l'ajout ou la suppression de groupes chimiques vers ou depuis, respectivement, des protéines , dans des modifications post-traductionnelles . En raison de l'importance de ces fonctions, les enzymes impliquées dans le métabolisme du NAD sont des cibles pour la découverte de médicaments .
Dans les organismes, le NAD peut être synthétisé à partir de simples blocs de construction ( de novo ) à partir du tryptophane ou de l'acide aspartique , chacun étant un cas d' acide aminé ; en variante, des composants plus complexes des coenzymes sont prélevés à partir de composés nutritifs tels que la niacine ; des composés similaires sont produits par des réactions qui décomposent la structure du NAD, fournissant une voie de récupération qui les "recycle" dans leur forme active respective.
Une partie du NAD est convertie en coenzyme nicotinamide adénine dinucléotide phosphate (NADP); sa chimie est largement parallèle à celle du NAD, bien que son rôle soit principalement de cofacteur dans le métabolisme anabolique .
Le signe d'addition en exposant de l'espèce chimique NAD + reflète la charge formelle sur l'un de ses atomes d'azote ; cette espèce est en fait un anion à charge unique - portant une charge ionique (négative) de 1 - dans des conditions de pH physiologique .
Proprietes physiques et chimiques
Le nicotinamide adénine dinucléotide est constitué de deux nucléosides reliés par du pyrophosphate . Les nucléosides contiennent chacun un cycle ribose , l'un avec l' adénine attachée au premier atome de carbone (la position 1 ' ) ( adénosine diphosphate ribose ) et l'autre avec le nicotinamide à cette position.

Le composé accepte ou donne l'équivalent de H − . De telles réactions (résumées dans la formule ci-dessous) impliquent l'élimination de deux atomes d'hydrogène du réactif (R), sous la forme d'un ion hydrure (H - ), et d'un proton (H + ). Le proton est libéré en solution, tandis que le réducteur RH 2 est oxydé et le NAD + réduit en NADH par transfert de l'hydrure sur le cycle nicotinamide.
- RH 2 + NAD + → NADH + H + + R;
De la paire d'électrons hydrure, un électron est transféré à l'azote chargé positivement du cycle nicotinamide de NAD + , et le second atome d'hydrogène est transféré à l'atome de carbone C4 opposé à cet azote. Le potentiel médian de la paire redox NAD + / NADH est de -0,32 volts , ce qui fait du NADH un agent réducteur puissant. La réaction est facilement réversible, lorsque le NADH réduit une autre molécule et est réoxydé en NAD + . Cela signifie que la coenzyme peut effectuer un cycle continu entre les formes NAD + et NADH sans être consommée.
En apparence, toutes les formes de cette coenzyme sont des poudres blanches amorphes , hygroscopiques et hautement solubles dans l'eau. Les solides sont stables s'ils sont stockés au sec et dans l'obscurité. Les solutions de NAD + sont incolores et stables pendant environ une semaine à 4 °C et pH neutre , mais se décomposent rapidement dans des solutions acides ou alcalines. Lors de leur décomposition, ils forment des produits qui sont des inhibiteurs enzymatiques .

Le NAD + et le NADH absorbent fortement la lumière ultraviolette à cause de l'adénine. Par exemple, le pic d'absorption du NAD + est à une longueur d' onde de 259 nanomètres (nm), avec un coefficient d'extinction de 16 900 M -1 cm -1 . Le NADH absorbe également à des longueurs d'onde plus élevées, avec un deuxième pic d'absorption UV à 339 nm avec un coefficient d'extinction de 6 220 M -1 cm -1 . Cette différence dans les spectres d'absorption ultraviolette entre les formes oxydées et réduites des coenzymes à des longueurs d'onde plus élevées facilite la mesure de la conversion de l'une à l'autre dans les dosages enzymatiques - en mesurant la quantité d'absorption UV à 340 nm à l'aide d'un spectrophotomètre .
Le NAD + et le NADH diffèrent également par leur fluorescence . Le NADH diffusant librement en solution aqueuse, lorsqu'il est excité à l'absorbance du nicotinamide d'environ 335 nm (proche UV), émet une fluorescence à 445–460 nm (violet à bleu) avec une durée de vie de fluorescence de 0,4 nanosecondes , tandis que le NAD + n'est pas fluorescent. Les propriétés du signal de fluorescence changent lorsque le NADH se lie aux protéines, de sorte que ces changements peuvent être utilisés pour mesurer les constantes de dissociation , qui sont utiles dans l'étude de la cinétique enzymatique . Ces changements de fluorescence sont également utilisés pour mesurer les changements de l'état redox des cellules vivantes, grâce à la microscopie à fluorescence .
Concentration et état dans les cellules
Dans le foie de rat, la quantité totale de NAD + et de NADH est d'environ 1 μmole par gramme de poids humide, soit environ 10 fois la concentration de NADP + et de NADPH dans les mêmes cellules. La concentration réelle de NAD + dans le cytosol cellulaire est plus difficile à mesurer, avec des estimations récentes dans les cellules animales allant d'environ 0,3 mM et d'environ 1,0 à 2,0 mM dans la levure . Cependant, plus de 80% de la fluorescence du NADH dans les mitochondries provient de la forme liée, de sorte que la concentration en solution est beaucoup plus faible.
Les concentrations de NAD + sont les plus élevées dans les mitochondries, constituant 40% à 70% du NAD + cellulaire total . Le NAD + dans le cytosol est transporté dans la mitochondrie par une protéine de transport membranaire spécifique , car la coenzyme ne peut pas diffuser à travers les membranes. La demi-vie intracellulaire du NAD + a été revendiquée entre 1 et 2 heures par une revue, tandis qu'une autre revue a donné des estimations variables en fonction du compartiment : intracellulaire 1 à 4 heures, cytoplasmique 2 heures et mitochondriale 4 à 6 heures.
L'équilibre entre les formes oxydées et réduites du nicotinamide adénine dinucléotide est appelé le rapport NAD + /NADH. Ce rapport est un élément important de ce qu'on appelle l' état redox d'une cellule, une mesure qui reflète à la fois les activités métaboliques et la santé des cellules. Les effets du rapport NAD + /NADH sont complexes, contrôlant l'activité de plusieurs enzymes clés, dont la glycéraldéhyde 3-phosphate déshydrogénase et la pyruvate déshydrogénase . Dans les tissus sains de mammifères, les estimations du rapport entre le NAD + libre et le NADH dans le cytoplasme se situent généralement autour de 700 : 1 ; le rapport est donc favorable aux réactions oxydatives. Le rapport NAD + /NADH total est beaucoup plus faible, avec des estimations allant de 3 à 10 chez les mammifères. En revanche, le rapport NADP + /NADPH est normalement d'environ 0,005, le NADPH est donc la forme dominante de cette coenzyme. Ces différents ratios sont essentiels aux différents rôles métaboliques du NADH et du NADPH.
Biosynthèse
Le NAD + est synthétisé par deux voies métaboliques. Il est produit soit dans une voie de novo à partir d'acides aminés, soit dans des voies de récupération en recyclant des composants préformés tels que le nicotinamide en NAD + . Bien que la plupart des tissus synthétisent le NAD + par la voie de récupération chez les mammifères, une synthèse beaucoup plus importante de novo se produit dans le foie à partir du tryptophane, et dans les reins et les macrophages à partir de l'acide nicotinique .
Production de novo

La plupart des organismes synthétisent le NAD + à partir de composants simples. L'ensemble spécifique de réactions diffère selon les organismes, mais une caractéristique commune est la génération d' acide quinolinique (QA) à partir d'un acide aminé - soit le tryptophane (Trp) chez les animaux et certaines bactéries, soit l'acide aspartique (Asp) chez certaines bactéries et plantes. L'acide quinolinique est converti en mononucléotide d'acide nicotinique (NaMN) par transfert d'un fragment phosphoribose. Une fraction adénylate est ensuite transférée pour former l'acide nicotinique adénine dinucléotide (NaAD). Enfin, le fragment acide nicotinique dans NaAD est amidé en un fragment nicotinamide (Nam), formant le nicotinamide adénine dinucléotide.
Dans une étape ultérieure, une partie du NAD + est convertie en NADP + par la NAD + kinase , qui phosphoryle le NAD + . Dans la plupart des organismes, cette enzyme utilise l'ATP comme source du groupe phosphate, bien que plusieurs bactéries telles que Mycobacterium tuberculosis et un archéon hyperthermophile Pyrococcus horikoshii utilisent le polyphosphate inorganique comme donneur de phosphoryle alternatif.
Voies de récupération
Malgré la présence de la voie de novo , les réactions de sauvetage sont essentielles chez l'homme ; un manque de niacine dans l'alimentation provoque la pellagre , maladie de carence en vitamines . Ce besoin élevé en NAD + résulte de la consommation constante de la coenzyme dans des réactions telles que des modifications post-traductionnelles, puisque le cycle de NAD + entre les formes oxydées et réduites dans les réactions redox ne modifie pas les niveaux globaux de la coenzyme. La principale source de NAD + chez les mammifères est la voie de récupération qui recycle le nicotinamide produit par les enzymes utilisant le NAD + . La première étape, et l'enzyme limitant le débit dans la voie de récupération, est la nicotinamide phosphoribosyltransférase (NAMPT), qui produit le nicotinamide mononucléotide (NMN). Le NMN est le précurseur immédiat du NAD+ dans la voie de récupération.
Outre l'assemblage de NAD + de novo à partir de simples précurseurs d'acides aminés, les cellules récupèrent également des composés préformés contenant une base de pyridine. Les trois précurseurs de vitamines utilisés dans ces voies métaboliques de récupération sont l'acide nicotinique (NA), le nicotinamide (Nam) et le nicotinamide riboside (NR). Ces composés peuvent être absorbés par l'alimentation et sont appelés vitamine B3 ou niacine . Cependant, ces composés sont également produits au sein des cellules et par digestion du NAD + cellulaire . Certaines des enzymes impliquées dans ces voies de sauvetage semblent être concentrées dans le noyau cellulaire , ce qui peut compenser le niveau élevé de réactions qui consomment du NAD + dans cet organite . Certains rapports indiquent que les cellules de mammifères peuvent absorber le NAD + extracellulaire de leur environnement, et que le nicotinamide et le nicotinamide riboside peuvent être absorbés par l'intestin.
Les voies de récupération utilisées chez les micro -organismes diffèrent de celles des mammifères . Certains pathogènes, comme la levure Candida glabrata et la bactérie Haemophilus influenzae sont des auxotrophes du NAD + – ils ne peuvent pas synthétiser le NAD + – mais possèdent des voies de sauvetage et dépendent donc de sources externes de NAD + ou de ses précurseurs. Encore plus surprenant est le pathogène intracellulaire Chlamydia trachomatis , qui manque de candidats reconnaissables pour tout gène impliqué dans la biosynthèse ou la récupération du NAD + et du NADP + , et doit acquérir ces coenzymes de son hôte .
Les fonctions

Le nicotinamide adénine dinucléotide a plusieurs rôles essentiels dans le métabolisme . Il agit comme coenzyme dans les réactions redox , comme donneur de fragments ADP-ribose dans les réactions ADP-ribosylation , comme précurseur de la deuxième molécule messagère cyclique ADP-ribose , ainsi que comme substrat pour les ADN ligases bactériennes et un groupe d'enzymes appelées sirtuines qui utilisent le NAD + pour éliminer les groupes acétyle des protéines. En plus de ces fonctions métaboliques, le NAD + apparaît comme un nucléotide adénine qui peut être libéré des cellules spontanément et par des mécanismes régulés, et peut donc avoir des rôles extracellulaires importants.
Liaison oxydoréductase du NAD
Le rôle principal du NAD + dans le métabolisme est le transfert d'électrons d'une molécule à une autre. Les réactions de ce type sont catalysées par un grand groupe d'enzymes appelées oxydoréductases . Les noms corrects de ces enzymes contiennent les noms de leurs deux substrats : par exemple , la NADH-ubiquinone oxydoréductase catalyse l'oxydation du NADH par la coenzyme Q . Cependant, ces enzymes sont également appelées déshydrogénases ou réductases , la NADH-ubiquinone oxydoréductase étant communément appelée NADH déshydrogénase ou parfois coenzyme Q réductase .
Il existe de nombreuses superfamilles différentes d'enzymes qui se lient au NAD + /NADH. L'une des superfamilles les plus courantes comprend un motif structurel connu sous le nom de pli de Rossmann . Le motif porte le nom de Michael Rossmann , qui a été le premier scientifique à remarquer à quel point cette structure est courante dans les protéines de liaison aux nucléotides.
Un exemple d'enzyme bactérienne de liaison au NAD impliquée dans le métabolisme des acides aminés qui n'a pas le pli de Rossmann se trouve dans Pseudomonas syringae pv. tomate ( PDB : 2CWH ; InterPro : IPR003767 ).

Lorsqu'il est lié au site actif d'une oxydoréductase, le cycle nicotinamide de la coenzyme est positionné de manière à pouvoir accepter un hydrure de l'autre substrat. Selon l'enzyme, le donneur d'hydrure est positionné "au-dessus" ou "en dessous" du plan du carbone planaire C4, tel que défini sur la figure. Les oxydoréductases de classe A transfèrent l'atome par le haut; les enzymes de classe B le transfèrent par le bas. Puisque le carbone C4 qui accepte l'hydrogène est prochiral , cela peut être exploité dans la cinétique enzymatique pour donner des informations sur le mécanisme de l'enzyme. Cela se fait en mélangeant une enzyme avec un substrat qui a des atomes de deutérium substitués aux hydrogènes, de sorte que l'enzyme réduira le NAD + en transférant du deutérium plutôt que de l'hydrogène. Dans ce cas, une enzyme peut produire l'un des deux stéréoisomères du NADH.
Malgré la similitude dans la façon dont les protéines se lient aux deux coenzymes, les enzymes présentent presque toujours un haut niveau de spécificité pour le NAD + ou le NADP + . Cette spécificité reflète les rôles métaboliques distincts des coenzymes respectives et est le résultat d'ensembles distincts de résidus d' acides aminés dans les deux types de poche de liaison aux coenzymes. Par exemple, dans le site actif des enzymes NADP-dépendantes, une liaison ionique est formée entre une chaîne latérale d'acide aminé basique et le groupe phosphate acide de NADP + . À l'inverse, dans les enzymes dépendantes du NAD, la charge dans cette poche est inversée, empêchant le NADP + de se lier. Cependant, il existe quelques exceptions à cette règle générale, et des enzymes telles que l' aldose réductase , la glucose-6-phosphate déshydrogénase et la méthylènetétrahydrofolate réductase peuvent utiliser les deux coenzymes chez certaines espèces.
Rôle dans le métabolisme redox

Les réactions redox catalysées par les oxydoréductases sont vitales dans toutes les parties du métabolisme, mais un domaine particulièrement important où ces réactions se produisent est la libération d'énergie à partir des nutriments. Ici, les composés réduits tels que le glucose et les acides gras sont oxydés, libérant ainsi de l'énergie. Cette énergie est transférée au NAD + par réduction en NADH, dans le cadre de la bêta-oxydation , de la glycolyse et du cycle de l'acide citrique . Chez les eucaryotes , les électrons portés par le NADH qui est produit dans le cytoplasme sont transférés dans la mitochondrie (pour réduire le NAD + mitochondrial ) par des navettes mitochondriales , comme la navette malate-aspartate . Le NADH mitochondrial est ensuite oxydé à son tour par la chaîne de transport d'électrons , qui pompe des protons à travers une membrane et génère de l'ATP par phosphorylation oxydative . Ces systèmes navettes ont également la même fonction de transport dans les chloroplastes .
Étant donné que les formes oxydées et réduites du nicotinamide adénine dinucléotide sont utilisées dans ces ensembles de réactions liées, la cellule maintient des concentrations significatives de NAD + et de NADH, le rapport NAD + /NADH élevé permettant à cette coenzyme d'agir à la fois comme oxydant et un agent réducteur. En revanche, la fonction principale du NADPH est celle d'agent réducteur de l'anabolisme , cette coenzyme étant impliquée dans des voies telles que la synthèse des acides gras et la photosynthèse . Étant donné que le NADPH est nécessaire pour entraîner des réactions redox en tant qu'agent réducteur puissant, le rapport NADP + /NADPH est maintenu très bas.
Bien qu'il soit important dans le catabolisme, le NADH est également utilisé dans les réactions anabolisantes, telles que la gluconéogenèse . Ce besoin de NADH dans l'anabolisme pose problème aux procaryotes qui poussent sur des nutriments qui ne libèrent qu'une faible quantité d'énergie. Par exemple, les bactéries nitrifiantes telles que Nitrobacter oxydent le nitrite en nitrate, ce qui libère suffisamment d'énergie pour pomper des protons et générer de l'ATP, mais pas assez pour produire directement du NADH. Comme le NADH est toujours nécessaire pour les réactions anaboliques, ces bactéries utilisent une nitrite oxydoréductase pour produire suffisamment de force protonmotrice pour faire fonctionner une partie de la chaîne de transport d'électrons en sens inverse, générant du NADH.
Rôles non redox
La coenzyme NAD + est également consommée dans les réactions de transfert ADP-ribose. Par exemple, des enzymes appelées ADP-ribosyltransférases ajoutent le fragment ADP-ribose de cette molécule aux protéines, dans une modification post -traductionnelle appelée ADP-ribosylation . L'ADP-ribosylation implique soit l'ajout d'un seul fragment ADP-ribose, dans la mono-ADP-ribosylation , soit le transfert de l'ADP-ribose à des protéines en longues chaînes ramifiées, appelée poly(ADP-ribosyl)ation . La mono-ADP-ribosylation a d'abord été identifiée comme le mécanisme d'un groupe de toxines bactériennes , notamment la toxine cholérique , mais elle est également impliquée dans la signalisation cellulaire normale . La poly(ADP-ribosyl)ation est réalisée par les poly(ADP-ribose) polymérases . La structure poly(ADP-ribose) est impliquée dans la régulation de plusieurs événements cellulaires et est la plus importante dans le noyau cellulaire , dans des processus tels que la réparation de l'ADN et la maintenance des télomères . En plus de ces fonctions au sein de la cellule, un groupe d' ADP-ribosyltransférases extracellulaires a été récemment découvert, mais leurs fonctions restent obscures. Le NAD + peut également être ajouté à l' ARN cellulaire en tant que modification 5'-terminale.

Une autre fonction de cette coenzyme dans la signalisation cellulaire est celle de précurseur de l'ADP-ribose cyclique , qui est produit à partir de NAD + par les ADP-ribosyl cyclases, dans le cadre d'un second système messager . Cette molécule agit dans la signalisation calcique en libérant du calcium des réserves intracellulaires. Pour ce faire, il se lie et ouvre une classe de canaux calciques appelés récepteurs de la ryanodine , situés dans les membranes des organites , comme le réticulum endoplasmique .
Le NAD + est également consommé par les sirtuines , qui sont des désacétylases NAD-dépendantes , telles que Sir2 . Ces enzymes agissent en transférant un groupement acétyle de leur protéine substrat vers le fragment ADP-ribose du NAD + ; cela clive la coenzyme et libère du nicotinamide et de l'O-acétyl-ADP-ribose. Les sirtuines semblent principalement être impliquées dans la régulation de la transcription par la désacétylation des histones et la modification de la structure du nucléosome . Cependant, les protéines non histones peuvent également être désacétylées par les sirtuines. Ces activités des sirtuines sont particulièrement intéressantes en raison de leur importance dans la régulation du vieillissement .
D'autres enzymes dépendantes du NAD comprennent les ADN ligases bactériennes , qui joignent deux extrémités d'ADN en utilisant NAD + comme substrat pour donner un fragment d' adénosine monophosphate (AMP) au phosphate 5' d'une extrémité d'ADN. Cet intermédiaire est ensuite attaqué par le groupe hydroxyle 3' de l'autre extrémité de l'ADN, formant une nouvelle liaison phosphodiester . Cela contraste avec les ADN ligases eucaryotes , qui utilisent l'ATP pour former l'intermédiaire ADN-AMP.
Li et al. ont découvert que le NAD + régule directement les interactions protéine-protéine. Ils montrent également que l'une des causes du déclin de la réparation de l'ADN lié à l'âge peut être une liaison accrue de la protéine DBC1 (Deleted in Breast Cancer 1) à PARP1 (poly[ADP–ribose] polymérase 1) alors que les niveaux de NAD + diminuent au cours du vieillissement. . Ainsi, la modulation du NAD + peut protéger contre le cancer, les radiations et le vieillissement.
Actions extracellulaires du NAD +
Ces dernières années, le NAD + a également été reconnu comme une molécule de signalisation extracellulaire impliquée dans la communication de cellule à cellule. Le NAD + est libéré des neurones des vaisseaux sanguins , de la vessie , du gros intestin , des cellules neurosécrétoires et des synaptosomes cérébraux , et est proposé comme un nouveau neurotransmetteur qui transmet les informations des nerfs aux cellules effectrices des organes musculaires lisses . Chez les plantes, le nicotinamide adénine dinucléotide extracellulaire induit une résistance à l'infection pathogène et le premier récepteur NAD extracellulaire a été identifié. D'autres études sont nécessaires pour déterminer les mécanismes sous-jacents de ses actions extracellulaires et leur importance pour la santé humaine et les processus vitaux d'autres organismes.
Signification clinique
Les enzymes qui fabriquent et utilisent le NAD + et le NADH sont importantes à la fois en pharmacologie et dans la recherche de futurs traitements contre les maladies. La conception et le développement de médicaments exploitent le NAD + de trois manières : en tant que cible directe des médicaments, en concevant des inhibiteurs ou des activateurs enzymatiques basés sur sa structure qui modifient l'activité des enzymes dépendantes du NAD, et en essayant d'inhiber la biosynthèse du NAD + .
Étant donné que les cellules cancéreuses utilisent une glycolyse accrue et que le NAD améliore la glycolyse, la nicotinamide phosphoribosyltransférase (voie de récupération du NAD) est souvent amplifiée dans les cellules cancéreuses.
Il a été étudié pour son utilisation potentielle dans le traitement de maladies neurodégénératives telles que la maladie d'Alzheimer et la maladie de Parkinson . Un essai clinique contrôlé par placebo sur le NADH (qui excluait les précurseurs du NADH) chez des personnes atteintes de la maladie de Parkinson n'a montré aucun effet.
Le NAD + est également une cible directe du médicament isoniazide , qui est utilisé dans le traitement de la tuberculose , une infection causée par Mycobacterium tuberculosis . L'isoniazide est un promédicament et une fois qu'il est entré dans la bactérie, il est activé par une enzyme peroxydase , qui oxyde le composé en une forme radicalaire . Ce radical réagit ensuite avec le NADH pour produire des adduits qui sont de très puissants inhibiteurs des enzymes énoyl-acyl carrier protein reductase et dihydrofolate reductase .
Étant donné que de nombreuses oxydoréductases utilisent le NAD + et le NADH comme substrats et les lient à l'aide d'un motif structurel hautement conservé, l'idée que les inhibiteurs à base de NAD + pourraient être spécifiques à une enzyme est surprenante. Cependant, cela peut être possible : par exemple, des inhibiteurs basés sur les composés acide mycophénolique et tiazofurine inhibent l' IMP déshydrogénase au niveau du site de liaison NAD + . En raison de l'importance de cette enzyme dans le métabolisme des purines , ces composés peuvent être utiles comme médicaments anticancéreux, antiviraux ou immunosuppresseurs . D'autres médicaments ne sont pas des inhibiteurs d'enzymes, mais activent plutôt des enzymes impliquées dans le métabolisme du NAD + . Les sirtuines sont une cible particulièrement intéressante pour de tels médicaments, car l'activation de ces désacétylases dépendantes du NAD prolonge la durée de vie de certains modèles animaux. Des composés tels que le resvératrol augmentent l'activité de ces enzymes, ce qui peut être important dans leur capacité à retarder le vieillissement des organismes modèles vertébrés et invertébrés . Dans une expérience, des souris ayant reçu du NAD pendant une semaine ont amélioré la communication nucléaire-mitochrondrie.
En raison des différences dans les voies métaboliques de la biosynthèse du NAD + entre les organismes, comme entre les bactéries et les humains, ce domaine du métabolisme est un domaine prometteur pour le développement de nouveaux antibiotiques . Par exemple, l'enzyme nicotinamidase , qui convertit le nicotinamide en acide nicotinique, est une cible pour la conception de médicaments, car cette enzyme est absente chez l'homme mais présente dans la levure et les bactéries.
En bactériologie, le NAD, parfois appelé facteur V, est utilisé en complément des milieux de culture pour certaines bactéries exigeantes .
Histoire

La coenzyme NAD + a été découverte pour la première fois par les biochimistes britanniques Arthur Harden et William John Young en 1906. Ils ont remarqué que l'ajout d'extrait de levure bouilli et filtré accélérait considérablement la fermentation alcoolique dans les extraits de levure non bouillis. Ils ont appelé le facteur non identifié responsable de cet effet un coferment . Grâce à une purification longue et difficile à partir d'extraits de levure, ce facteur thermostable a été identifié comme un phosphate de sucre nucléotidique par Hans von Euler-Chelpin . En 1936, le scientifique allemand Otto Heinrich Warburg a montré la fonction de la coenzyme nucléotidique dans le transfert d'hydrure et a identifié la partie nicotinamide comme site de réactions redox.
Les précurseurs vitaminiques du NAD + ont été identifiés pour la première fois en 1938, lorsque Conrad Elvehjem a montré que le foie a une activité "anti-langue noire" sous la forme de nicotinamide. Puis, en 1939, il a fourni la première preuve solide que la niacine est utilisée pour synthétiser le NAD + . Au début des années 1940, Arthur Kornberg a été le premier à détecter une enzyme dans la voie de biosynthèse. En 1949, les biochimistes américains Morris Friedkin et Albert L. Lehninger ont prouvé que le NADH reliait des voies métaboliques telles que le cycle de l'acide citrique à la synthèse d'ATP dans la phosphorylation oxydative. En 1958, Jack Preiss et Philip Handler découvrent les intermédiaires et enzymes impliqués dans la biosynthèse du NAD + ; la synthèse de récupération à partir de l'acide nicotinique est appelée voie de Preiss-Handler. En 2004, Charles Brenner et ses collègues ont découvert la voie de la nicotinamide riboside kinase vers le NAD + .
Les rôles non redox du NAD(P) ont été découverts plus tard. La première identifiée est l'utilisation du NAD + comme donneur d'ADP-ribose dans les réactions d'ADP-ribosylation, observée au début des années 1960. Des études dans les années 1980 et 1990 ont révélé les activités des métabolites NAD + et NADP + dans la signalisation cellulaire - comme l'action de l' ADP-ribose cyclique , qui a été découvert en 1987.
Le métabolisme du NAD + est resté un domaine de recherche intense au 21e siècle, avec un intérêt accru après la découverte des protéines désacétylases dépendantes du NAD + appelées sirtuines en 2000, par Shin-ichiro Imai et ses collègues du laboratoire de Leonard P. Guarente . En 2009, Imai a proposé l'hypothèse «NAD World» selon laquelle les principaux régulateurs du vieillissement et de la longévité chez les mammifères sont la sirtuine 1 et la principale enzyme de synthèse du NAD + , la nicotinamide phosphoribosyltransférase (NAMPT). En 2016, Imai a élargi son hypothèse à "NAD World 2.0", qui postule que le NAMPT extracellulaire du tissu adipeux maintient le NAD + dans l' hypothalamus (le centre de contrôle) en conjonction avec les myokines des cellules musculaires squelettiques .
Voir également
Références
Lectures complémentaires
Fonction
- Nelson DL; Cox MM (2004). Principes de biochimie de Lehninger (4e éd.). WH Freeman. ISBN 978-0-7167-4339-2.
- Bug T (2004). Introduction à la chimie des enzymes et des coenzymes (2e éd.). Blackwell Publishing Limited. ISBN 978-1-4051-1452-3.
- Lee HC (2002). ADP-Ribose cyclique et NAADP : structure, métabolisme et fonctions . Éditeurs académiques Kluwer. ISBN 978-1-4020-7281-9.
- Levine OS, Schuchat A, Schwartz B, Wenger JD, Elliott J (1997). "Protocole générique pour la surveillance basée sur la population de Haemophilus influenzae de type B" (PDF) . Organisation mondiale de la santé. Centres de Contrôle des Maladies. p. 13. WHO/VRD/GEN/95.05. Archivé de l'original (PDF) le 1er juillet 2004.
- Kim, Jinhyun; Lee, Sahng Ha; Tieves, Florian; Paul, Caroline E.; Hollmann, Frank; Parc, Chan Beum (5 juillet 2019). "Nicotinamide adénine dinucléotide comme photocatalyseur" . Les avancées scientifiques . 5 (7) : eaax0501. Bibcode : 2019SciA....5..501K . doi : 10.1126/sciadv.aax0501 . PMC 6641943 . PMID 31334353 .
Histoire
- Cornish-Bowden, Athel (1997). Nouvelle bière dans une vieille bouteille. Eduard Buchner et la croissance des connaissances biochimiques . Valence : Université de Valence. ISBN 978-84-370-3328-0., Une histoire de l'enzymologie précoce.
- Williams, Henry Smith (1904). Développement moderne des sciences chimiques et biologiques . Une histoire des sciences : en cinq volumes. Vol. IV. New York : Harper et frères., un manuel du XIXe siècle.
Liens externes
- NAD lié aux protéines dans la Protein Data Bank
- Animation NAD (Flash requis)
- β-Nicotinamide adénine dinucléotide (NAD + , oxydé) et NADH (réduit) Fiche de données chimiques de Sigma-Aldrich
- Voie de synthèse NAD + , NADH et NAD à la base de données MetaCyc
- Liste des oxydoréductases de la base de données SWISS-PROT


