Chimie organique - Organic chemistry

| Fait partie d'une série sur |
| Chimie |
|---|

|
|
La chimie organique est une branche de la chimie qui étudie la structure, les propriétés et les réactions des composés organiques , qui contiennent du carbone dans une liaison covalente . L'étude de la structure détermine leur formule structurelle . L'étude des propriétés comprend les propriétés physiques et chimiques et l'évaluation de la réactivité chimique pour comprendre leur comportement. L'étude des réactions organiques comprend la synthèse chimique de produits naturels , de médicaments et de polymères , et l'étude de molécules organiques individuelles en laboratoire et via une étude théorique ( in silico ).
La gamme des produits chimiques étudiés en chimie organique comprend les hydrocarbures (composés ne contenant que du carbone et de l' hydrogène ) ainsi que des composés à base de carbone, mais contenant également d'autres éléments, notamment l' oxygène , l' azote , le soufre , le phosphore (compris dans de nombreux produits biochimiques ) et les halogènes . La chimie organométallique est l'étude des composés contenant des liaisons carbone- métal .
De plus, les recherches contemporaines portent sur la chimie organique impliquant d'autres organométalliques dont les lanthanides , mais surtout les métaux de transition zinc, cuivre, palladium, nickel, cobalt, titane et chrome.
Les composés organiques forment la base de toute vie terrestre et constituent la majorité des produits chimiques connus. Les modèles de liaison du carbone, avec sa valence de quatre - liaisons formelles simples, doubles et triples, ainsi que des structures avec des électrons délocalisés - rendent la gamme de composés organiques structurellement diversifiée et leur gamme d'applications énorme. Ils forment la base de, ou sont des constituants de, de nombreux produits commerciaux, y compris les produits pharmaceutiques ; produits pétrochimiques et agrochimiques , et produits fabriqués à partir de ces produits , notamment lubrifiants , solvants ; plastiques ; carburants et explosifs . L'étude de la chimie organique chevauche la chimie organométallique et la biochimie , mais aussi la chimie médicinale , la chimie des polymères et la science des matériaux .
Histoire
Avant le XVIIIe siècle, les chimistes croyaient généralement que les composés obtenus à partir d'organismes vivants étaient dotés d'une force vitale qui les distinguait des composés inorganiques . Selon le concept de vitalisme (théorie de la force vitale), la matière organique était dotée d'une "force vitale". Au cours de la première moitié du XIXe siècle, certaines des premières études systématiques des composés organiques ont été signalées. Vers 1816, Michel Chevreul entreprend une étude sur les savons fabriqués à partir de diverses graisses et alcalis . Il a séparé les acides qui, en combinaison avec l'alcali, ont produit le savon. Comme il s'agissait tous de composés individuels, il a démontré qu'il était possible de modifier chimiquement diverses graisses (qui proviennent traditionnellement de sources organiques), produisant de nouveaux composés, sans "force vitale". En 1828, Friedrich Wöhler a produit l' urée chimique organique (carbamide), un constituant de l' urine , à partir de matières premières inorganiques (les sels de cyanate de potassium et de sulfate d'ammonium ), dans ce qu'on appelle maintenant la synthèse de Wöhler . Bien que Wöhler lui-même ait été prudent en affirmant qu'il avait réfuté le vitalisme, c'était la première fois qu'une substance considérée comme organique était synthétisée en laboratoire sans matières premières biologiques (organiques). L'événement est maintenant généralement accepté comme réfutant en effet la doctrine du vitalisme.
En 1856, William Henry Perkin , en essayant de fabriquer de la quinine, a accidentellement produit le colorant organique maintenant connu sous le nom de mauve de Perkin . Sa découverte, largement connue grâce à son succès financier, a considérablement accru l'intérêt pour la chimie organique.
Une percée cruciale pour la chimie organique a été le concept de structure chimique, développé indépendamment en 1858 par Friedrich August Kekulé et Archibald Scott Couper . Les deux chercheurs ont suggéré que les atomes de carbone tétravalents pourraient se lier les uns aux autres pour former un réseau de carbone, et que les modèles détaillés de liaison atomique pourraient être discernés par des interprétations habiles des réactions chimiques appropriées.
L'ère de l' industrie pharmaceutique a commencé au cours de la dernière décennie du XIXe siècle lorsque la fabrication d'acide acétylsalicylique, plus communément appelée aspirine , a été lancée en Allemagne par Bayer . En 1910, Paul Ehrlich et son groupe de laboratoire ont commencé à développer l' arsphénamine à base d'arsenic (Salvarsan), en tant que premier traitement médicamenteux efficace de la syphilis , et ont ainsi lancé la pratique médicale de la chimiothérapie . Ehrlich a popularisé les concepts de médicaments « balles magiques » et d'amélioration systématique des thérapies médicamenteuses. Son laboratoire a apporté des contributions décisives au développement d'antisérums contre la diphtérie et à la standardisation des sérums thérapeutiques.

Les premiers exemples de réactions organiques et d'applications ont souvent été trouvés grâce à une combinaison de chance et de préparation à des observations inattendues. La seconde moitié du 19ème siècle a cependant été témoin d'études systématiques des composés organiques. Le développement de l'indigo synthétique est illustratif. La production d'indigo d'origine végétale est passée de 19 000 tonnes en 1897 à 1 000 tonnes en 1914 grâce aux méthodes de synthèse développées par Adolf von Baeyer . En 2002, 17 000 tonnes d'indigo synthétique ont été produites à partir de la pétrochimie .
Au début du 20e siècle, les polymères et les enzymes se sont avérés être de grosses molécules organiques, et le pétrole s'est avéré être d'origine biologique.
La synthèse en plusieurs étapes de composés organiques complexes est appelée synthèse totale. Synthèse totale de composés naturels complexes augmentés en complexité en glucose et terpinéol . Par exemple, les composés liés au cholestérol ont ouvert des voies pour synthétiser des hormones humaines complexes et leurs dérivés modifiés. Depuis le début du 20e siècle, la complexité de la synthèse totale a été augmentée pour inclure des molécules très complexes tels que l' acide lysergique et la vitamine B 12 .

La découverte du pétrole et le développement de l' industrie pétrochimique ont stimulé le développement de la chimie organique. La conversion de composés pétroliers individuels en types de composés par divers processus chimiques a conduit à des réactions organiques permettant une large gamme de produits industriels et commerciaux, y compris, parmi (beaucoup) d'autres : plastiques , caoutchouc synthétique , adhésifs organiques et divers additifs et catalyseurs pétroliers modifiant les propriétés .
La majorité des composés chimiques présents dans les organismes biologiques sont des composés carbonés, de sorte que l'association entre la chimie organique et la biochimie est si étroite que la biochimie pourrait être considérée comme essentiellement une branche de la chimie organique. Bien que l' histoire de la biochimie puisse s'étendre sur environ quatre siècles, la compréhension fondamentale du domaine n'a commencé à se développer qu'à la fin du XIXe siècle et le terme biochimie a été inventé vers le début du XXe siècle. La recherche dans le domaine a augmenté tout au long du vingtième siècle, sans aucune indication de ralentissement du taux d'augmentation, comme cela peut être vérifié par l'inspection des services d'abstraction et d'indexation tels que BIOSIS Previews et Biological Abstracts , qui ont commencé dans les années 1920 sous la forme d'un seul volume annuel. , mais s'est tellement développée qu'à la fin du 20e siècle , elle n'était accessible à l' utilisateur quotidien que sous la forme d' une base de données électronique en ligne .
Caractérisation
Étant donné que les composés organiques existent souvent sous forme de mélanges , diverses techniques ont également été développées pour évaluer la pureté ; les techniques de chromatographie sont particulièrement importantes pour cette application et comprennent la HPLC et la chromatographie en phase gazeuse . Les méthodes traditionnelles de séparation comprennent la distillation , la cristallisation , l' évaporation , la séparation magnétique et l' extraction par solvant .
Les composés organiques étaient traditionnellement caractérisés par une variété de tests chimiques, appelés « méthodes humides », mais ces tests ont été largement remplacés par des méthodes d'analyse spectroscopiques ou d'autres méthodes d'analyse intensives en informatique. Énumérées par ordre approximatif d'utilité, les principales méthodes d'analyse sont :
- La spectroscopie par résonance magnétique nucléaire (RMN) est la technique la plus couramment utilisée, permettant souvent l'attribution complète de la connectivité des atomes et même de la stéréochimie à l'aide de la spectroscopie de corrélation . Les principaux atomes constitutifs de la chimie organique – l'hydrogène et le carbone – existent naturellement avec les isotopes sensibles à la RMN, respectivement 1 H et 13 C.
- Analyse élémentaire : Méthode destructive utilisée pour déterminer la composition élémentaire d'une molécule. Voir aussi spectrométrie de masse, ci-dessous.
- La spectrométrie de masse indique le poids moléculaire d'un composé et, à partir des motifs de fragmentation , sa structure. La spectrométrie de masse à haute résolution peut généralement identifier la formule exacte d'un composé et est utilisée à la place de l'analyse élémentaire. Autrefois, la spectrométrie de masse était limitée aux molécules neutres présentant une certaine volatilité, mais des techniques d'ionisation avancées permettent d'obtenir la "spéc. de masse" de pratiquement n'importe quel composé organique.
- La cristallographie peut être utile pour déterminer la géométrie moléculaire lorsqu'un seul cristal du matériau est disponible. Du matériel et des logiciels très efficaces permettent de déterminer une structure dans les heures suivant l'obtention d'un cristal approprié.
Les méthodes spectroscopiques traditionnelles telles que la spectroscopie infrarouge , la rotation optique et la spectroscopie UV/VIS fournissent des informations structurelles relativement non spécifiques mais restent utilisées pour des applications spécifiques. L'indice de réfraction et la densité peuvent également être importants pour l'identification des substances.
Propriétés
Les propriétés physiques des composés organiques d'intérêt comprennent à la fois des caractéristiques quantitatives et qualitatives. Les informations quantitatives comprennent un point de fusion, un point d'ébullition et un indice de réfraction. Les propriétés qualitatives comprennent l'odeur, la consistance, la solubilité et la couleur.
Propriétés de fusion et d'ébullition
Les composés organiques fondent généralement et beaucoup bouillent. En revanche, alors que les matériaux inorganiques peuvent généralement être fondus, nombre d'entre eux ne bouillent pas et ont plutôt tendance à se dégrader. Autrefois, le point de fusion (PF) et le point d'ébullition (pb) fournissaient des informations cruciales sur la pureté et l'identité des composés organiques. Les points de fusion et d'ébullition sont en corrélation avec la polarité des molécules et leur poids moléculaire. Certains composés organiques, surtout symétriques, subliment . Un exemple bien connu de composé organique sublimable est le para-dichlorobenzène , le constituant odorant des boules à mites modernes. Les composés organiques ne sont généralement pas très stables à des températures supérieures à 300 °C, bien qu'il existe quelques exceptions.
Solubilité
Les composés organiques neutres ont tendance à être hydrophobes ; c'est-à-dire qu'ils sont moins solubles dans l'eau que dans les solvants organiques. Les exceptions incluent les composés organiques qui contiennent des groupes ionisables ainsi que les alcools de faible poids moléculaire , les amines et les acides carboxyliques où se produit une liaison hydrogène . Sinon, les composés organiques ont tendance à se dissoudre dans les solvants organiques . La solubilité varie considérablement avec le soluté organique et avec le solvant organique.
Propriétés à l'état solide
Diverses propriétés spécialisées des cristaux moléculaires et des polymères organiques avec des systèmes conjugués sont intéressantes en fonction des applications, par exemple thermomécaniques et électromécaniques telles que la piézoélectricité , la conductivité électrique (voir polymères conducteurs et semi-conducteurs organiques ) et électro-optiques (par exemple non- propriétés de l'optique linéaire ). Pour des raisons historiques, ces propriétés sont principalement les sujets des domaines de la science des polymères et de la science des matériaux .
Nomenclature
Les noms des composés organiques sont soit systématiques, suivant logiquement un ensemble de règles, soit non systématiques, suivant diverses traditions. La nomenclature systématique est stipulée par un cahier des charges de l' IUPAC . La nomenclature systématique commence par le nom d'une structure parente au sein de la molécule d'intérêt. Ce nom parent est ensuite modifié par des préfixes, des suffixes et des nombres pour transmettre sans ambiguïté la structure. Étant donné que des millions de composés organiques sont connus, l'utilisation rigoureuse de noms systématiques peut être fastidieuse. Ainsi, les recommandations de l'IUPAC sont plus étroitement suivies pour les composés simples, mais pas pour les molécules complexes. Pour utiliser la dénomination systématique, il faut connaître les structures et les noms des structures mères. Les structures parentes comprennent les hydrocarbures non substitués, les hétérocycles et leurs dérivés mono fonctionnalisés.
La nomenclature non systématique est plus simple et sans ambiguïté, du moins pour les chimistes organiques. Les noms non systématiques n'indiquent pas la structure du composé. Ils sont communs aux molécules complexes, qui incluent la plupart des produits naturels. Ainsi, le diéthylamide de l'acide lysergique de manière informelle est systématiquement nommé (6a R ,9 R ) -N , N -diethyl-7-methyl-4,6,6a,7,8,9-hexahydroindolo-[4,3- fg ] quinoléine-9-carboxamide.
Avec l'utilisation accrue de l'informatique, d'autres méthodes de nommage ont évolué, destinées à être interprétées par des machines. Deux formats populaires sont SMILES et InChI .
Dessins structurels
Les molécules organiques sont décrites plus communément par des dessins ou des formules structurelles , des combinaisons de dessins et de symboles chimiques. La formule ligne-angle est simple et sans ambiguïté. Dans ce système, les extrémités et les intersections de chaque ligne représentent un carbone, et les atomes d'hydrogène peuvent être soit notés explicitement, soit supposés être présents comme le laisse supposer le carbone tétravalent .

Histoire
En 1880, une explosion du nombre de composés chimiques découverts s'est produite, assistée par de nouvelles techniques de synthèse et d'analyse. Grignard a décrit la situation comme "chaos le plus complet" (chaos complet) en raison du manque de convention, il était possible d'avoir plusieurs noms pour le même composé. Cela a conduit à la création des règles de Genève en 1892.
Classification des composés organiques
Groupes fonctionnels
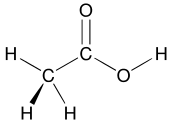
Le concept de groupes fonctionnels est central en chimie organique, à la fois pour classer les structures et pour prédire les propriétés. Un groupe fonctionnel est un module moléculaire, et la réactivité de ce groupe fonctionnel est supposée, dans certaines limites, être la même dans une variété de molécules. Les groupes fonctionnels peuvent avoir une influence décisive sur les propriétés chimiques et physiques des composés organiques. Les molécules sont classées en fonction de leurs groupes fonctionnels. Les alcools, par exemple, ont tous la sous-unité COH. Tous les alcools ont tendance à être quelque peu hydrophiles , forment généralement des esters et peuvent généralement être convertis en halogénures correspondants . La plupart des groupes fonctionnels comportent des hétéroatomes (atomes autres que C et H). Les composés organiques sont classés en fonction des groupes fonctionnels, alcools, acides carboxyliques, amines, etc. Les groupes fonctionnels rendent la molécule plus acide ou basique en raison de leur influence électronégative sur les parties environnantes de la molécule.
Au fur et à mesure que le pka (alias basicité ) de l'addition moléculaire/groupe fonctionnel augmente, il y a un dipôle correspondant , lorsqu'il est mesuré, augmente en force. Un dipôle dirigé vers le groupe fonctionnel (pka plus élevé donc nature basique du groupe) pointe vers lui et diminue en force avec l'augmentation de la distance. La distance dipolaire (mesurée en Angstroms ) et l' encombrement stérique vers le groupe fonctionnel ont un effet intermoléculaire et intramoléculaire sur l'environnement et le niveau de pH .
Différents groupes fonctionnels ont des valeurs de pka et des forces de liaison différentes (simple, double, triple) conduisant à une électrophilie accrue avec un pka plus faible et une force nucléophile accrue avec un pka plus élevé. Des groupes fonctionnels plus basiques/nucléophiles souhaitent attaquer un groupe fonctionnel électrophile avec un pka inférieur sur une autre molécule (intermoléculaire) ou au sein de la même molécule (intramoléculaire). Tout groupe avec un pka acide net qui se trouve à portée, comme un groupe acyle ou carbonyle est un jeu équitable. Étant donné que la probabilité d'être attaqué diminue avec une augmentation du pka, les composants du chlorure d'acyle avec les valeurs de pka mesurées les plus faibles sont les plus susceptibles d'être attaqués, suivis des acides carboxyliques (pka = 4), des thiols (13), des malonates (13), des alcools (17), aldéhydes (20), nitriles (25), esters (25), puis amines (35). Les amines sont très basiques et sont de grands nucléophiles/attaquants.
Composés aliphatiques
Les hydrocarbures aliphatiques se subdivisent en trois groupes de séries homologues selon leur état de saturation :
- alcanes (paraffines) : hydrocarbures aliphatiques sans aucune double ou triple liaison , c'est-à-dire uniquement des liaisons simples CC, CH
- alcènes (oléfines) : hydrocarbures aliphatiques qui contiennent une ou plusieurs doubles liaisons, c'est-à-dire des di-oléfines (diènes) ou des poly-oléfines.
- alcynes (acétylènes) : hydrocarbures aliphatiques qui possèdent une ou plusieurs triples liaisons.
Le reste du groupe est classé selon les groupes fonctionnels présents. De tels composés peuvent être "à chaîne droite", à chaîne ramifiée ou cyclique. Le degré de ramification affecte les caractéristiques, telles que l' indice d'octane ou l' indice de cétane en chimie du pétrole.
Les composés saturés ( alicycliques ) et les composés insaturés existent sous forme de dérivés cycliques. Les cycles les plus stables contiennent cinq ou six atomes de carbone, mais les grands cycles (macrocycles) et les cycles plus petits sont courants. La plus petite famille de cycloalcanes est le cyclopropane à trois chaînons ((CH 2 ) 3 ). Les composés cycliques saturés ne contiennent que des liaisons simples, tandis que les cycles aromatiques ont une double liaison alternée (ou conjuguée). Les cycloalcanes ne contiennent pas de liaisons multiples, contrairement aux cycloalcènes et aux cycloalcynes.
Composés aromatiques
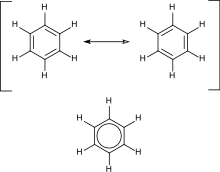
Les hydrocarbures aromatiques contiennent des doubles liaisons conjuguées . Cela signifie que chaque atome de carbone du cycle est hybride sp2, ce qui permet une stabilité accrue. L'exemple le plus important est le benzène , dont la structure a été formulée par Kekulé qui a proposé le premier le principe de délocalisation ou de résonance pour expliquer sa structure. Pour les composés cycliques "classiques", l'aromaticité est conférée par la présence de 4n + 2 électrons pi délocalisés, où n est un nombre entier. Une instabilité particulière ( antiaromaticité ) est conférée par la présence de 4n électrons pi conjugués.
Composés hétérocycliques
Les caractéristiques des hydrocarbures cycliques sont à nouveau modifiées si des hétéroatomes sont présents, qui peuvent exister sous forme de substituants attachés à l'extérieur du cycle (exocyclique) ou en tant que membre du cycle lui-même (endocyclique). Dans le cas de ce dernier, le cycle est qualifié d' hétérocycle . La pyridine et le furane sont des exemples d'hétérocycles aromatiques tandis que la pipéridine et le tétrahydrofurane sont les hétérocycles alicycliques correspondants . L'hétéroatome des molécules hétérocycliques est généralement l'oxygène, le soufre ou l'azote, ce dernier étant particulièrement courant dans les systèmes biochimiques.
Les hétérocycles sont couramment présents dans une large gamme de produits, y compris les colorants à l'aniline et les médicaments. De plus, ils sont répandus dans un large éventail de composés biochimiques tels que les alcaloïdes , les vitamines, les stéroïdes et les acides nucléiques (par exemple, l'ADN, l'ARN).
Les anneaux peuvent fusionner avec d'autres anneaux sur un bord pour donner des composés polycycliques . Les bases nucléosidiques puriques sont des hétérocycles aromatiques polycycliques notables. Les anneaux peuvent également fusionner sur un "coin" de telle sorte qu'un atome (presque toujours du carbone) a deux liaisons allant à un anneau et deux à un autre. Ces composés sont appelés spiro et sont importants dans plusieurs produits naturels .
Polymères

Une propriété importante du carbone est qu'il forme facilement des chaînes, ou des réseaux, qui sont liés par des liaisons carbone-carbone (carbone à carbone). Le processus de liaison est appelé polymérisation , tandis que les chaînes, ou réseaux, sont appelés polymères . Le composé source est appelé monomère .
Deux groupes principaux de polymères existent : les polymères synthétiques et les biopolymères . Les polymères synthétiques sont fabriqués artificiellement et sont communément appelés polymères industriels . Les biopolymères se produisent dans un environnement respectueux de la nature, ou sans intervention humaine.
Biomolécules
La chimie biomoléculaire est une catégorie majeure de la chimie organique qui est fréquemment étudiée par les biochimistes . De nombreuses molécules de groupes multifonctionnels complexes sont importantes dans les organismes vivants. Certains sont des biopolymères à longue chaîne , et ceux-ci incluent les peptides , l' ADN , l' ARN et les polysaccharides tels que les amidons chez les animaux et les celluloses chez les plantes. Les autres classes principales sont les acides aminés (éléments constitutifs des monomères des peptides et des protéines), les glucides (qui incluent les polysaccharides), les acides nucléiques (qui incluent l'ADN et l'ARN en tant que polymères) et les lipides . En outre, la biochimie animale contient de nombreux intermédiaires de petites molécules qui aident à la production d'énergie à travers le cycle de Krebs et produit de l' isoprène , l'hydrocarbure le plus courant chez les animaux. Les isoprènes chez les animaux forment les principaux composés structuraux stéroïdiens ( cholestérol ) et les hormones stéroïdiennes; et dans les plantes forment des terpènes , des terpénoïdes , certains alcaloïdes et une classe d'hydrocarbures appelés polyisoprénoïdes biopolymères présents dans le latex de diverses espèces de plantes, qui est à la base de la fabrication du caoutchouc .
Voir aussi: synthèse peptide , synthèse d'oligonucléotides et la synthèse des glucides .
Petites molécules

En pharmacologie, un groupe important de composés organiques est constitué de petites molécules , également appelées « petits composés organiques ». Dans ce contexte, une petite molécule est un petit composé organique qui est biologiquement actif mais n'est pas un polymère . En pratique, les petites molécules ont une masse molaire inférieure à environ 1000 g/mol.
Fullerènes
Les fullerènes et les nanotubes de carbone , des composés carbonés à structure sphéroïdale et tubulaire, ont stimulé de nombreuses recherches dans le domaine connexe de la science des matériaux . Le premier fullerène a été découvert en 1985 par Sir Harold W. Kroto du Royaume-Uni et par Richard E. Smalley et Robert F. Curl, Jr., des États-Unis. En utilisant un laser pour vaporiser des tiges de graphite dans une atmosphère d'hélium gazeux, ces chimistes et leurs assistants ont obtenu des molécules en forme de cage composées de 60 atomes de carbone (C60) reliés entre eux par des liaisons simples et doubles pour former une sphère creuse avec 12 faces pentagonales et 20 hexagonales— un design qui ressemble à un ballon de football. En 1996, le trio a reçu le prix Nobel pour leurs efforts de pionniers. La molécule C60 a été nommée buckminsterfullerene (ou, plus simplement, le buckyball) d'après l'architecte américain R. Buckminster Fuller, dont le dôme géodésique est construit sur les mêmes principes structurels.
Autres
Les composés organiques contenant des liaisons carbone-azote, oxygène et halogènes ne sont normalement pas regroupés séparément. D' autres sont parfois mis en grands groupes au sein de la chimie organique et discuté sous des titres tels que organosulfuré la chimie , la chimie organométallique , organophosphorés la chimie et la chimie organique du silicium .
Réactions organiques
Les réactions organiques sont des réactions chimiques impliquant des composés organiques . Beaucoup de ces réactions sont associées à des groupes fonctionnels. La théorie générale de ces réactions implique une analyse minutieuse de propriétés telles que l' affinité électronique des atomes clés, les forces de liaison et l' encombrement stérique . Ces facteurs peuvent déterminer la stabilité relative des intermédiaires réactifs de courte durée , qui déterminent généralement directement le chemin de la réaction.
Les types basiques de réaction sont les suivantes : réactions d'addition , les réactions d'élimination , des réactions de substitution , des réactions péricycliques , des réactions de réarrangement et de réactions d' oxydoréduction . Un exemple de réaction courante est une réaction de substitution écrite comme suit :
- Nu − + CX → C-Nu + X −
où X est un groupe fonctionnel et Nu est un nucléophile .
Le nombre de réactions organiques possibles est infini. Cependant, certains modèles généraux sont observés et peuvent être utilisés pour décrire de nombreuses réactions courantes ou utiles. Chaque réaction a un mécanisme de réaction par étapes qui explique comment cela se produit dans l'ordre, bien que la description détaillée des étapes ne soit pas toujours claire à partir d'une liste de réactifs seuls.
Le déroulement par étapes d'un mécanisme de réaction donné peut être représenté à l'aide de techniques de poussée de flèche dans lesquelles des flèches incurvées sont utilisées pour suivre le mouvement des électrons lors de la transition des matériaux de départ à travers les intermédiaires vers les produits finaux.
Synthèse organique

La chimie organique de synthèse est une science appliquée car elle borde l' ingénierie , la « conception, l'analyse et/ou la construction d'ouvrages à des fins pratiques ». La synthèse organique d'un nouveau composé est une tâche de résolution de problèmes, où une synthèse est conçue pour une molécule cible en sélectionnant des réactions optimales à partir de matériaux de départ optimaux. Les composés complexes peuvent avoir des dizaines d'étapes de réaction qui construisent séquentiellement la molécule souhaitée. La synthèse procède en utilisant la réactivité des groupes fonctionnels dans la molécule. Par exemple, un composé carbonyle peut être utilisé comme nucléophile en le convertissant en énolate , ou comme électrophile ; la combinaison des deux s'appelle la réaction d'aldol . Concevoir des synthèses utiles dans la pratique nécessite toujours de réaliser la synthèse proprement dite en laboratoire. La pratique scientifique consistant à créer de nouvelles voies de synthèse pour des molécules complexes est appelée synthèse totale .
Les stratégies pour concevoir une synthèse comprennent la rétrosynthèse , popularisée par EJ Corey , qui commence par la molécule cible et la scinde en morceaux selon des réactions connues. Les morceaux, ou les précurseurs proposés, reçoivent le même traitement, jusqu'à ce que des matières premières disponibles et idéalement peu coûteuses soient atteintes. Ensuite, la rétrosynthèse est écrite dans le sens inverse pour donner la synthèse. Un "arbre synthétique" peut être construit car chaque composé et également chaque précurseur a de multiples synthèses.
Voir également
- Publications importantes en chimie organique
- Liste des réactions organiques
- Modélisation moléculaire
Les références
Liens externes
- MIT.edu , OpenCourseWare : Chimie organique I
- HaverFord.edu , Conférences de chimie organique, vidéos et textes
- Organic-Chemistry.org , Portail de la chimie organique - Résumés récents et (nom) réactions
- Orgsyn.org , Journal de synthèse de chimie organique
- Clutchprep.com , Conférences vidéo sur la chimie organique et problèmes pratiques
- Khanacademy.org , Khan Academy - Chimie organique