Chimie organobore - Organoboron chemistry
Les organoboranes ou composés organoborés sont des composés chimiques du bore et du carbone qui sont des dérivés organiques de BH 3 , par exemple les trialkylboranes. La chimie des organoboranes ou la chimie des organoboranes est la chimie de ces composés.
Les composés organoborés sont des réactifs importants en chimie organique permettant de nombreuses transformations chimiques, la plus importante appelée hydroboration . Les réactions des organoborates et des boranes impliquent le transfert d'un groupe nucléophile attaché au bore à un centre électrophile soit inter- ou intramoléculaire. Les borates ,β-insaturés, ainsi que les borates avec un groupe partant en position , sont très sensibles à la migration intramoléculaire 1,2 d'un groupe du bore à la position électrophile. L'oxydation ou la protonolyse des organoboranes résultants peut générer une variété de produits organiques, y compris des alcools, des composés carbonylés, des alcènes et des halogénures.
Propriétés de la liaison BC
La liaison CB a une faible polarité (différence d' électronégativité de 2,55 pour le carbone et de 2,04 pour le bore), et par conséquent les composés d'alkylbore sont en général stables bien que facilement oxydés.
En partie à cause de sa plus faible électronégativité, le bore forme souvent des composés déficients en électrons , tels que les triorganoboranes. Les groupes vinyle et les groupes aryle donnent des électrons et rendent le bore moins électrophile et la liaison CB acquiert un certain caractère de double liaison . Comme le borane parent, le diborane , les organoboranes sont classés en chimie organique comme des électrophiles puissants car le bore est incapable de gagner un octet complet d'électrons. Contrairement au diborane cependant, la plupart des organoboranes ne forment pas de dimères .
La synthèse
A partir des réactifs de Grignard
Des organoboranes simples tels que le triéthylborane ou le tris(pentafluorophényl)bore peuvent être préparés à partir du trifluoroborane (en tant que complexe éther ) et du réactif de Grignard éthyle ou pentafluorophényle . Les borates (R 4 B − ) sont générés par addition d' équivalents R − - (RMgX, RLi, etc.) à R 3 B.
Des alcènes
Les alcènes s'insèrent dans les liaisons BH des boranes dans un processus appelé hydroboration . Le processus implique une addition anti- Markovnikov . L'hydroboration d'alcènes ou d'alcynes avec du borane (BH 3 ) ou des équivalents de borane conduit à la conversion de seulement 33 % de l'oléfine de départ en produit après oxydation ou protonolyse - l'oléfine restante est incorporée dans les sous-produits contenant du bore. Un réactif organoboré qui est souvent utilisé dans la synthèse est le 9-BBN . Les hydroborations ont lieu stéréospécifiquement en mode syn , c'est-à-dire sur la même face de l'alcène. Dans cette réaction concertée, l' état de transition est représenté par un carré avec les coins occupés par le carbone, le carbone, l'hydrogène et le bore avec un chevauchement maximal entre les deux orbitales p d' oléfine et l'orbitale de bore vide.
Par borylation
Les réactions de borylation CH catalysées par des métaux sont des réactions organiques catalysées par des métaux de transition qui produisent un composé organobore par fonctionnalisation de liaisons CH aliphatiques et aromatiques. Un réactif courant dans ce type de réaction est le bis(pinacolato)diboron .
Classes de composés organoborés
Organoboranes et hydrures
Parmi les classes les plus étudiées de composés organoborés ont la formule BR n H 3−n . Comme discuté ci-dessus, ces composés sont utilisés comme catalyseurs, réactifs et intermédiaires de synthèse. Les dérivés trialkyle et triaryle présentent un centre trigonal planaire de bore qui n'est généralement que faiblement acide de Lewis . Hormis quelques dérivés très volumineux, les hydrures (BR n H 3−n pour n = 1 ou 2) existent sous forme de dimères, rappelant la structure du diborane lui-même. Les dérivés trisubstitués, par exemple le triéthylbore, sont des monomères.
Acides et esters boriniques et boroniques (BR n (OR) 3-n )
Les composés du type BR n (OR) 3-n sont appelés esters boriniques (n = 2), esters boroniques (n = 1) et borates (n = 0). Les acides boroniques sont utilisés dans la réaction de Suzuki . Le borate de triméthyle , qui n'est sans doute pas un composé organoboré, est un intermédiaire dans la production de borohydrure de sodium.
Amas de bore
Le bore est réputé pour former des composés en grappes, par exemple le dodécaborate [B 12 H 12 ] 2- . De nombreux dérivés organiques sont connus pour de tels clusters. Un exemple est [B 12 (CH 3 ) 12 ] 2- et son dérivé radical [B 12 (CH 3 ) 12 ] − . Les composés d'amas apparentés avec des sommets de carbone sont appelés carboranes . Le plus connu est l'orthocarborane, de formule C 2 B 10 H 12 . Bien qu'ils aient peu d'applications commerciales, les carboranes ont attiré beaucoup d'attention parce qu'ils sont structurellement inhabituels. Les dérivés anioniques, les dicarbollides, par exemple [C 2 B 9 H 11 ] 2− sont des ligands qui se comportent comme le cyclopentadiénide .
Composés aromatiques substitués par Bora
Dans le borabenzène , un centre CH dans le benzène est remplacé par du bore. Ces composés sont invariablement isolés sous forme de produits d' addition, par exemple, C 5 H 5 B-pyridine. Le composé cyclique borole , un analogue structurel du pyrrole , n'a pas été isolé, mais des dérivés substitués appelés boroles sont connus. Le composé cyclique borepin est aromatique.
Composés boryliques
Les anions boryle ont la formule R 2 B - . Les composés boryliques anioniques nucléophiles ont longtemps été insaisissables, mais une étude de 2006 a décrit un composé boryllithium , qui réagit comme un nucléophile : les composés organométalliques avec des liaisons métal-bore (c'est-à-dire M-BR 2 ), sont connus sous le nom de complexes boryliques. Les ligands apparentés sont les borylènes (M–B(R)–M).
L'absence de composés de lithium boryl est notable car dans d'autres périodes, les sels de lithium à 2 éléments sont courants, par exemple le fluorure de lithium , l'hydroxyde de lithium , l'amide de lithium et le méthyllithium . Le gap met en évidence la très faible électronégativité du bore. La réaction de la base avec un borohydrure R 2 BH ne conduit pas à une déprotonation en l'anion boryle R 2 B - mais à la formation de l'anion boryle R 2 B - H(base) + . Ce produit de réaction a un octet complet . Au lieu de cela, le composé boryle est préparé par hétérolyse réductrice d'une liaison bore-bromure par le lithium métallique. Le nouveau composé boryl lithium est très similaire et isoélectronique avec les carbènes N-hétérocycliques . Il est conçu pour bénéficier d'une stabilisation aromatique (système à 6 électrons comptant les paires isolées d'azote et une orbitale p vide de bore , voir structure A) et d' une stabilisation cinétique des groupes 2,6-diisopropylphényle volumineux. La diffraction des rayons X confirme l' hybridation sp2 au bore et sa réaction d'addition nucléophile avec le benzaldéhyde donne une preuve supplémentaire de la structure proposée.
Alkylidèneboranes
Les alkylidèneboranes de type RB=CRR avec une double liaison bore-carbone sont rarement rencontrés. Un exemple est le borabenzène . Le composé parent est HB=CH 2 qui peut être détecté à basse température. Un dérivé assez stable est CH 3 B=C(SiMe 3 ) 2 mais est sujet à la cyclodimérisation .
Adduits NHC du bore
Les NHC et les boranes forment des adduits NHC borane stables . Les adduits de triéthylborane peuvent être synthétisés directement à partir du sel d'imidazolium et du triéthylborohydrure de lithium . Les membres de cette classe de composés sont étudiés pour une utilisation comme réactif ou catalyseur.
Diborènes
Les composés chimiques avec des doubles liaisons bore-bore sont rares. En 2007, le premier diborène neutre (RHB=BHR) a été présenté par Gregory Robinson de l' Université de Géorgie . Chaque atome de bore a un proton qui lui est attaché et chaque atome de bore est coordonné à un carbène NHC . La structure mère avec les ligands carbène supplémentaires est le diborane(2) .
Un diboryne rapporté est basé sur une chimie similaire.
Réactions
Les organoboranes (R 3 B) et les borates (R 4 B − , générés par addition de R − à R 3 B) possèdent des liaisons bore-carbone qui sont polarisées vers le carbone. Ainsi, le carbone attaché au bore est nucléophile, et dans les borates, cette propriété peut être exploitée pour transférer l'un des groupes R à un centre électrophile soit inter- ou (plus souvent) intramoléculairement. Dans ce dernier cas, le groupe R nucléophile est capable de subir une migration 1,2 vers un carbone électrophile attaché au bore. Le borane réorganisé résultant peut ensuite être oxydé ou soumis à une protonolyse pour donner des produits organiques. Les exemples couverts dans cet article sont présentés ci-dessous.
L'hydroboration d'alcènes ou d'alcynes est une méthode efficace pour la génération de boranes ; cependant, l'utilisation de borane (BH 3 ) ou d'équivalents de borane conduit à la conversion de seulement 33 % de l'oléfine de départ en produit après oxydation ou protonolyse - l'oléfine restante est incorporée dans des sous-produits contenant du bore. L'utilisation d'une quantité stoechiométrique de 9-borabicyclo[3.3.1]nonane (9-BBN) comme réactif d'hydroboration apporte une solution à ce problème.
Hydroboration-oxydation
En synthèse organique, la réaction d'hydroboration est poussée plus loin pour générer d'autres groupes fonctionnels à la place du groupe bore. La réaction d'hydroboration-oxydation offre une voie aux alcools par oxydation du borane avec le peroxyde d'hydrogène ou au groupe carbonyle avec l' oxyde de chrome comme agent oxydant le plus fort .
Réarrangements
Le monoxyde de carbone réagit avec les trialkylboranes. Ce qui suit est un réarrangement 1,2 par lequel un substituant alkyle migre du bore vers le carbone du groupe carbonyle. Les alcools primaires homologués résultent du traitement d'organoboranes avec du monoxyde de carbone et un hydrure.
Allylboration
L'allylboration asymétrique démontre une autre application utile des organoboranes dans la formation de liaisons carbone-carbone. Dans cet exemple issu de la synthèse des épothilones par Nicolaou , l'allylboration asymétrique (utilisant un allylborane dérivé de l' alpha-pinène chiral ) est utilisée conjointement avec la protection TBS et l' ozonolyse . Dans l'ensemble, cela fournit une séquence d'homologation à deux carbones qui fournit la séquence d' acétogénine requise .
Comme agent réducteur
Les hydrures de borane tels que le 9-BBN et le L-sélectride (lithium tri-sec-butylborohydrure) sont des agents réducteurs . Un exemple de catalyseur asymétrique pour les réductions de carbonyle est le catalyseur CBS . Ce catalyseur est également à base de bore, dont le but est la coordination avec l'atome d'oxygène du carbonyle.
Borates
Les trialkylboranes, BR 3 , peuvent être oxydés en les borates correspondants , B(OR) 3 . Une méthode pour la détermination de la quantité de liaisons CB dans un composé est l'oxydation de R 3 B avec de l' oxyde de triméthylamine (Me 3 NO) en B(OR) 3 . La triméthylamine (Me 3 N) formée peut ensuite être titrée .
Les acides boroniques RB(OH) 2 réagissent avec le bifluorure de potassium K[HF 2 ] pour former des sels de trifluoroborate K[RBF 3 ] qui sont des précurseurs des difluorures nucléophiles d'alkyle et d'aryle bore, ArBF 2 . Les sels sont plus stables que les acides boroniques eux-mêmes et utilisés par exemple dans l'alkylation de certains aldéhydes :
Les composés organoborés se prêtent également à des réactions de transmétallation , en particulier avec les composés organopalladium . Ce type de réaction est illustrée par la réaction de Suzuki , ce qui implique le couplage d' aryle - ou vinyle - acide boronique avec un aryle - ou vinyle - halogénure catalysée par un palladium (0) complexe ,
-
( 1 )
Cette réaction est une méthode importante pour créer des liaisons carbone-carbone.
Mécanisme et stéréochimie
Les boranes seuls ne sont généralement pas assez nucléophiles pour transférer un groupe alkyle à un centre électrophile. Cependant, après attaque nucléophile, le borate résultant est hautement nucléophile. Si le nucléophile contient une fonctionnalité insaturée ou un groupe partant en position , l'un des groupes R attachés au bore est capable de migrer vers le carbone électrophile (voir l'équation (2) ci-dessous). La propension d'un groupe organique à migrer dépend de sa capacité à stabiliser une charge négative : alcynyle > aryle ≈ alcényle > alkyle primaire > alkyle secondaire > alkyle tertiaire. La migration a lieu avec rétention de la configuration au niveau du carbone de la migration et inversion de la configuration à l'extrémité de migration ( à condition qu'il soit sp 3 hybridé). Le bis(norbornyl)borane et le 9-BBN sont souvent utilisés comme réactifs d'hydroboration "factices" pour cette raison - seul le groupe R dérivé de l'oléfine hydroborée est susceptible de migrer lors de l'activation nucléophile.
Les énolates -Halo sont couramment utilisés comme nucléophiles dans ce contexte. Après l'attaque nucléophile du bore, le kétobronate résultant se réarrange en un énoborane neutre. Lors de la protonolyse, il en résulte un composé carbonyle fonctionnalisé. Les énoboranes intermédiaires peuvent également être désactivés avec des électrophiles.
Les alcynylboronates sont des intermédiaires polyvalents qui peuvent être convertis en cétones ou en oléfines après migration et attaque simultanées de l'alcyne sur un électrophile séparé. L'électrophile et le groupe migrant se retrouvent en trans dans l'alcénylborane résultant. La protonolyse de cet intermédiaire génère des oléfines, tandis que l'oxydation conduit à des cétones après tautomérisation.
Portée et limites des réactions
Le champ d'application des organoboranes et des borates comme réactifs pour la synthèse organique est extrêmement large. Les réactions des composés organoborés peuvent produire des alcools, des composés carbonylés, des halogénures, des peroxydes, des amines et d'autres fonctionnalités en fonction des autres matières premières utilisées et des conditions de réaction. Cette section couvre un petit sous-ensemble de ces méthodes, en se concentrant sur la synthèse d'alcools, de composés carbonylés et d'halogénures.
La synthèse d'alcool à partir d'organoboranes et de borates repose soit sur le transfert de groupes nucléophiles à un groupe carbonyle, soit sur l'oxydation d'un organoborane intermédiaire. Les alcools primaires homologués résultent du traitement d'organoboranes avec du monoxyde de carbone et un hydrure.
Les alcools tertiaires avec deux groupes identiques attachés au carbone de l'alcool peuvent être synthétisés par une réaction de double migration d'alcynylborates en présence d'acide. L'utilisation d'un seul équivalent d'acide et l'oxydation ou la protonolyse conduisent respectivement à des cétones ou à des oléfines (voir la section Mécanisme et stéréochimie ci-dessus).
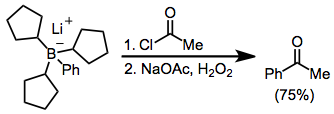
L'acylation des borates est possible en présence d'un halogénure d'acyle. Ici, le borate a été généré à partir de tri(cyclopentyl)borane et de phényllithium ; les trois groupes cyclopentyle servent de groupes "factices" et ne migrent pas en quantité significative.
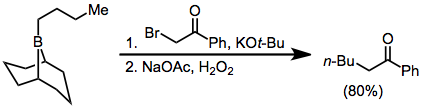
Le traitement des trialkylboranes avec des en-haloénolates conduit à des cétones fonctionnalisées. Parce que la migration est stéréospécifique (rétentive par rapport au groupe migrant et invertive au niveau du carbone ), cette méthode fournit un moyen pour la synthèse d'-alkyle ou -aryl cétones énantiopures.
Les énolates d'ester -halo s'ajoutent également aux boranes pour donner éventuellement des produits -fonctionnalisés ; cependant, les rendements sont légèrement inférieurs. Les diazoesters et les diazocétones peuvent également être utilisés dans ce contexte sans l'exigence d'une base externe. Les α,α'-dialoénolates réagissent avec les boranes pour former des composés -halogénocarbonyles qui peuvent être davantage fonctionnalisés en position .
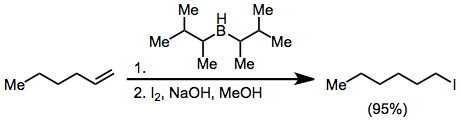
Les halogénures peuvent être synthétisés à partir de organoboranes en activant avec un hydroxyde ou un alcoolate et un traitement avec X 2 . Deux des trois groupes alkyle attachés au borane peuvent être convertis en halogénure en présence d'un excès de base, mais l'utilisation de disiamylborane comme réactif d'hydroboration permet l'halogénation sélective uniquement de l'oléfine hydroborée.
Le traitement d'un alcénylborane avec de l'iode ou du brome conduit à la migration d'un des groupes organiques attachés au bore. Les groupes alcynyle migrent sélectivement, formant des énynes après traitement avec de l'acétate de sodium et du peroxyde d'hydrogène.
Autres utilisations
TEB – Le triéthylborane a été utilisé pour allumer le carburant JP-7 des moteurs à cycle variable Pratt & Whitney J58 alimentant le Lockheed SR-71 Blackbird .









![La réaction de Suzuki {\displaystyle {\begin{matrix}{}\\{\ce {{R1-BY2}+R2-X->[{\underset {\text{catalyseur}}{\text{Pd}}}][{ \text{Base}}]R1-R2}}\\{}\end{matrice}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c35df36f38fec8abbc8e9d1d9f04e9b2687ae245)