Tumeurs des cellules germinales de l'ovaire - Ovarian germ cell tumors
| Tumeurs des cellules germinales de l'ovaire | |
|---|---|
| Spécialité |
Oncologie |
| Symptômes | Ballonnements, distension abdominale, ascite, dyspareunie |
Les tumeurs des cellules germinales de l'ovaire (OGCT) sont des tumeurs hétérogènes dérivées des cellules germinales primitives de la gonade embryonnaire , qui représentent environ 2,6% de toutes les tumeurs malignes de l'ovaire. Il existe quatre principaux types de OGCTs, à savoir dysgerminomes , jaune sac tumeur , tératome et choriocarcinome .
Les dygerminomes sont des tumeurs germinales malignes de l'ovaire et particulièrement importantes chez les patients diagnostiqués avec une dysgénésie gonadique . Les OGCT sont relativement difficiles à détecter et à diagnostiquer à un stade précoce en raison des caractéristiques histologiques non spécifiques. Les symptômes courants de l'OGCT sont les ballonnements , la distension abdominale , l' ascite et la dyspareunie . L'OGCT est principalement due à la formation de cellules cancéreuses malignes dans les cellules germinales primordiales de l'ovaire. La pathogenèse exacte des OGCT est encore inconnue, cependant, diverses mutations génétiques et facteurs environnementaux ont été identifiés. Les OGCT sont couramment trouvés pendant la grossesse lorsqu'une masse annexielle est trouvée lors d'un examen pelvien, les échographies montrent une masse solide dans les ovaires ou le test du sérum sanguin montre des niveaux d' alpha-foetoprotéine élevés. Il est peu probable qu'elles aient métastasé et la prise en charge standard de la tumeur est donc la résection chirurgicale , associée à une chimiothérapie . Le taux d'occurrence est inférieur à 3% dans le monde.
Classification
Les OGCT peuvent être classés en dysgerminomes, tératomes, tumeurs du sac vitellin et choriocarcinomes, classés par ordre de prévalence.
Dysgerminome

Les dysgerminomes sont comparables aux séminomes testiculaires et représentent environ 32 à 37% de tous les OGCT. Ils sont particulièrement importants chez les individus présentant des gonades dysgéniques de 46 patients atteints de dysgénésie gonadique pure XY. Sur la base d'examens macroscopiques, les dysgerminomes se caractérisent par un « aspect grossier solide, lobulé , beige, semblable à de la chair avec une surface lisse ». Au microscope, la structure cellulaire se distingue par une forme ronde-ovoïde contenant un cytoplasme éosinophile ample et des noyaux de forme irrégulière. Les cellules uniformément positionnées sont séparées par les brins fibreux et une infiltration lymphocytaire est couramment observée.
Tératomes

Les tératomes sont les tumeurs des cellules germinales les plus courantes de l'ovaire. Les tératomes peuvent être divisés en deux types : les tératomes matures (bénins) et les tératomes immatures (malins). Les tératomes immatures contiennent des tissus immatures ou embryonnaires qui les différencient significativement des tératomes matures car ils portent des kystes dermoïdes . Elle est fréquemment observée chez les femmes de 15 à 19 ans et rarement chez les femmes après la ménopause. Les tératomes immatures se caractérisent par un diamètre de 14 à 25 cm, une masse encapsulée, des zones kystiques et l'apparition occasionnelle de zones hémorragiques . Le stade des tératomes immatures est déterminé en fonction de la quantité de tissu neuroépithélial immature détecté.
Tumeur du sac vitellin

Les tumeurs du sac vitellin de l' ovaire , également connues sous le nom de tumeurs des sinus endodermiques , sont responsables d'environ 15,5% de tous les OGCT. Ils ont été observés chez les femmes en particulier dans leur jeune âge, et rarement après 40 ans. Les caractéristiques pathologiques critiques sont une surface externe lisse et des déchirures capsulaires en raison de leur taux de croissance rapide. Une étude portant sur 71 cas individuels de tumeur du sac vitellin de l'ovaire fournit des preuves de la prolifération de la tumeur. Dans l'un des cas, l'examen pelvien a révélé une activité normale jusqu'à ce qu'une tumeur de 9 cm et 12 cm soit découverte 4 semaines plus tard. Dans un autre cas, une tumeur de 23 cm a été découverte chez une femme enceinte qui était surveillée régulièrement et avait des résultats normaux jusqu'à ce que l' ovariectomie devienne indispensable. Histologiquement, ces tumeurs sont caractérisées par des composants solides et kystiques mixtes . Les composants solides mélangés sont caractérisés par des composants solides gris doux à jaunes accompagnés d'une hémorragie et d'une nécrose importantes . Les kystes mesurent environ 2 cm de diamètre et sont peuplés dans tout le tissu, ce qui donne au néoplasme un « aspect alvéolé ».
Choriocarcinome

Les choriocarcinomes sont exceptionnellement rares et représentent 2,1% à 3,4 % de tous les OGCT. À l'examen macroscopique , les cellules syncytiotrophoblastes sont alignées dans un arrangement plexiforme avec les cellules cytotrophoblastiques mononucléées entourant les foyers de l'hémorragie. Les choriocarcinomes peuvent être divisés en choriocarcinomes gestationnels et en choriocarcinomes non gestationnels qui présentent des différences immunohistochimiques .
Signes et symptômes
Les OGCT sont relativement difficiles à détecter et à diagnostiquer à un stade précoce, principalement parce que les symptômes sont normalement subtils et non spécifiques. Ils deviennent détectables lorsqu'ils deviennent de grandes masses tangibles. Les symptômes comprennent des ballonnements, une distension abdominale, une ascite et une dyspareunie. Dans de rares cas où la tumeur se rompt, une douleur abdominale aiguë peut être ressentie. L'indicateur critique de malignité est généralement l'apparition de la sœur Mary Joseph Nodule . Les OGCT peuvent en outre provoquer une torsion ovarienne , une hémorragie et même une puberté précoce isosexuelle chez les jeunes enfants.
Causes
La cause exacte de l'OGCT reste à déterminer. Cependant, quelques facteurs ont été identifiés qui peuvent contribuer à un risque accru d'OGCT, notamment l' endométriose , le syndrome des ovaires polykystiques et les facteurs de risque génétiques. Les personnes qui sont plus enclins à développer OGCTs contiennent généralement la autosomique dominante , BRCA-1 / BRCA-2 , les mutations. Les complications avec d'autres cancers tels que le cancer colorectal héréditaire sans polypose , également connu sous le nom de syndrome de Lynch , augmentent le risque de développer un cancer de l'ovaire . La grossesse, l'allaitement et les contraceptifs oraux sont connus pour réduire le risque d'OGCT. L' étiologie de l'OGCT est encore à l'étude, cependant, des altérations génétiques peuvent contribuer au développement des OGCT, tels que les gènes suppresseurs de tumeur classiques et les oncogènes . Parallèlement aux modifications génétiques, certains facteurs environnementaux tels que les perturbateurs endocriniens , la présence d'une routine quotidienne qui affecte la biochimie de l'individu et l'exposition aux hormones maternelles pourraient également contribuer à la prolifération des OGCT. Une étude récente sur des rats a montré l' héritage épigénétique transgénérationnel soutenant l'influence des substances environnementales dangereuses, y compris les plastiques, les pesticides et les dioxines , sur la pathogenèse de l'OGCT.
Pathogénèse
Néanmoins, quelques spéculations sur les causes ont été faites. Pendant l' ovulation , le follicule se rompt, ce qui endommage les cellules épithéliales . Afin de guérir le tissu et de remplacer les dommages, les cellules subissent une division cellulaire . Chaque fois que la cellule se divise, il existe une possibilité que des mutations se produisent et le risque de formation de tumeurs augmente. La tumeur est causée lorsque les cellules germinales des ovaires commencent à se diviser de manière incontrôlable et deviennent malignes, caractérisées par leurs noyaux moins organisés et leur bordure mal définie. Une autre étiologie potentielle est le dysfonctionnement du gène suppresseur de tumeur TRC8/RNF139, voire des anomalies caryotypiques après examen moléculaire approfondi.
L'OGCT a ses racines dans le développement embryonnaire où les cellules germinales primordiales (PGC) sont isolées à des stades précoces et ont la capacité de modifier le génome ainsi que le transcriptome . Les OGCT peuvent être attribués au mécanisme interne des PGC et à leurs caractéristiques de transformation.
Mise en scène
Une fois l'OGCT diagnostiqué, divers tests seront effectués pour déterminer si le cancer s'est propagé à d'autres zones du corps. La propagation de l'OGCT est identifiée à travers différentes étapes: stade I, stade II, stade III et stade IV à savoir.
Stade I : Les cellules tumorales sont localisées dans les ovaires ou les trompes de Fallope sans propagation étendue à d'autres régions du corps.
Stade II : Le cancer se situe dans un ou les deux ovaires ou trompes de Fallope et s'est propagé dans le bassin.
Stade III : Le cancer s'est propagé au-delà du bassin jusqu'à l'abdomen et aux ganglions lymphatiques rétropéritonéaux (situés à l'arrière de l' abdomen ). Les sous-stades sont caractérisés par la taille relative de la tumeur.
Remarque : le cancer de l'ovaire de stade II sera également déclaré si les cellules cancéreuses se sont propagées au foie . Stade IV : Le cancer s'est propagé à l'extérieur de l'abdomen et du bassin vers des organes plus éloignés, tels que les poumons .
Diagnostic
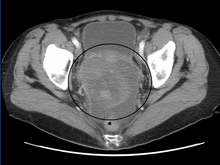
Le diagnostic préliminaire commence par un examen pelvien , un test des marqueurs tumoraux sériques et une imagerie. Les médecins peuvent sentir une grosse masse palpable ou une grosseur dans le bas-ventre lors de l'insertion des doigts gantés dans le vagin. Pour mieux identifier les sous-types histologiques des OGMT, des échantillons de sang de patients sont prélevés pour analyser le niveau sérique de biomarqueurs libérés par les cellules tumorales. Une augmentation des taux plasmatiques de gonadotrophine chorionique humaine et d'alpha-foetoprotéine est indicative des OGMT. La lactate déshydrogénase , la phosphatase alcaline et l' antigène cancéreux 125 pourraient également augmenter. Pour visualiser l'emplacement et la morphologie de la tumeur, une échographie transvaginale est généralement utilisée. L'aspect le plus caractéristique est une masse hétéroéchogène de type parenchymateux avec des bords nets et une vascularisation élevée. La tomodensitométrie produirait une image empilée à l'intérieur de la région péritonéale du corps pour visualiser le motif lobulaire de la tumeur. Habituellement pour le dysgerminome, une masse solide compartimentée en lobules avec des cloisons rehaussées peut être évidente pour une hémorragie ou une nécrose.
Procédures préopératoires
Conformément aux directives de la FIGO sur la stadification, une stadification chirurgicale complète sera effectuée pour examiner l'étendue de la propagation de la tumeur via les régions péritonéales ou les drainages lymphatiques .
28% des patients de stade II se trouve avec le développement de tumeurs malignes secondaires au niveau des nœuds lymphatiques avec une distance d'un site primaire du cancer, appelé ganglions lymphatiques métastases .
Il existe trois voies principales de drainage lymphatique :
- drainage vers les ganglions lymphatiques paraaortiques via les veines ovariennes
- drainage du ligament large aux ganglions lymphatiques iliaques
- drainage du ligament rond aux ganglions lymphatiques inguinaux
La palpation ou les biopsies des ganglions lymphatiques pelviens et para-aortiques unilatéraux seront réalisées en préopératoire pour en déduire le pronostic de la tumeur et de la propagation lymphatique.
Des biopsies péritonéales et une omentectomie seront également utilisées pour évaluer l'étendue du déversement ou de l'implantation du contenu tumoral dans la cavité péritonéale. Les cellules tumorales peuvent se détacher du site d'origine dans la cavité péritonéale et s'implanter sur la surface de la capsule hépatique ou le diaphragme . Ils peuvent se boucher à l'intérieur du vaisseau lymphatique autour du diaphragme et empêcher la résorption du liquide péritonéal. Au final, une lymphadénopathie péricardiophrénique et une ascite peuvent résulter de cette franche invasion.
Traitement
Chirurgie
Les OGCT malins sont majoritairement unilatéraux et chimiosensibles, ce qui signifie qu'ils sont localisés d'un seul côté de l'ovaire. La chirurgie de préservation de la fertilité est principalement standardisée pour maintenir intacts l'ovaire controlatéral et la trompe de Fallope, également connue sous le nom de salpingo-ovariectomie unilatérale. Pour les patients de stade II présentant des métastases observables, une chirurgie cytoréductive peut être réalisée pour réduire le volume de la tumeur, telle qu'une hystérectomie (ablation de tout ou partie de l'utérus) et une salpingo-ovariectomie bilatérale . Une incision chirurgicale au niveau de la cavité abdominale après la fin de la chimiothérapie adjuvante, appelée laparotomie de second regard , est mieux applicable pour les patients rapportés avec des éléments tératomateux après une chirurgie cytoréductive précédente.
Chimiothérapie adjuvante

Avec une récidive allant jusqu'à 15-25% pour les patients à un stade précoce, la chimiothérapie adjuvante doit être associée à une résection chirurgicale de la tumeur pour assurer un sauvetage complet. Pour la chimiothérapie systémique (administrée par voie orale ou intraveineuse), le schéma est standardisé dans chaque stade FIGO pour comprendre la bléomycine , l' étoposide et le cisplatine , également connu sous le nom de traitement BEP . Les patients doivent recevoir 3 à 4 cycles de BEP pour assurer un sauvetage complet. En fonction des conditions personnalisées, certains patients qui ne répondent pas au traitement BEP se verront prescrire un traitement de rattrapage, composé de cisplatine, d' ifosfamide et de paclitaxel . Pourtant, il est probable que les survivants de l'OGCT après la thérapie BEP auront une ménopause prématurée à un âge approximatif de 36. Alternativement, certains hôpitaux ont opté pour une chimiothérapie à base de platine puisque les complexes de platine présents dans le médicament interviennent dans la transcription de l'ADN en formant des liaisons chimiques au sein les brins d'ADN, ce qui empêche la reproduction des cellules cancéreuses. Les principaux éléments sont le cisplatine, le carboplatine et l' oxaliplatine . Il a été rapporté avec un rétablissement complet chez les patients à un stade précoce et seulement un quart des patients à un stade avancé ne sont pas récupérés potentiellement en raison de la résistance aux médicaments.
Pour les patients à un stade avancé, après une chirurgie cytoréductive, des cellules cancéreuses microscopiques invisibles ou des nodules peuvent encore être présents sur le site de l'infection. Par conséquent, les médecins peuvent instiller une solution de chimiothérapie chauffée (~ 42-43 ° C) dans la cavité abdominale à travers des tubes carters pendant 1,5 heure. Partant du principe que les cellules cancéreuses meurent normalement à 40 °C, les cellules somatiques ne sont pas affectées puisqu'elles meurent à 44 °C. Cette nouvelle méthode s'est avérée efficace avec seulement 10 % de taux de récidive et aucune mortalité enregistrée. Elle est connue sous le nom de chimiothérapie intrapéritonéale hyperthermique (HIPEC), contenant du docétaxel et du cisplatine. Étant donné que le médicament est diffusé localement dans les régions intrapéritonéales, il n'a pas d'effets secondaires systémiques sur d'autres cellules se reproduisant activement et est préféré à la chimiothérapie systémique.
Typiquement, la distribution incontrôlable du médicament dans la chimiothérapie systémique entraîne une myélosuppression , en particulier avec une neutropénie fébrile , une neurotoxicité , une ototoxicité et une néphrotoxicité observées . Les traitements curatifs pour traiter les toxicités induites par la chimiothérapie consistent à injecter un facteur de stimulation des colonies de granulocytes ou des facteurs de croissance myéloïdes ou à prendre par voie orale des antibiotiques prophylactiques.
Épidémiologie
L'OGCT est une tumeur rare dans le cadre du cancer de l'ovaire, représentant moins de 5% de toutes les tumeurs malignes de l'ovaire. Elle survient principalement chez les femmes de 15 à 19 ans et présente un taux d'incidence de 75 % chez les femmes de moins de 30 ans. En 2011, le nombre de nouveaux cas survenus dans le monde est de 5,3 par million. Dans la plupart des pays, le taux d'occurrence est en moyenne inférieur à 3% de la population. Cependant, l'Asie a signalé la plus forte proportion de cas jusqu'à 4,3% en raison du profil d'âge plus jeune de la population. Pour les autres régions, les taux d'incidence rapportés sont de 2,5% en Océanie, 2,0% en Amérique du Nord et 1,3% en Europe.
Les taux de survie à cinq ans ont atteint jusqu'à 90-92%, ce qui est beaucoup plus élevé que celui des cancers épithéliaux de l'ovaire . La raison principale est la grande efficacité de la chimiothérapie à base de platine .
Les références
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai Shaaban AM, Rezvani M, Elsayes KM, Baskin H, Mourad A , Foster BR, Jarboe EA, Menias CO (2014). « Tumeurs des cellules germinales malignes de l'ovaire : classification cellulaire et caractéristiques cliniques et d'imagerie ». Radiographie . 34 (3) : 777–801. doi : 10.1148/rg.343130067 . PMID 24819795 .
- ^ A b c d e f "tumeurs des cellules de l' ovaire germinales" (PDF) . Avril 2013 . Récupéré le 01-04-2019 .
- ^ A b c d Matz M, Coleman MP, Sant M, Chirlaque MD, Visser O, Gore M, Allemani C (Février 2017). « L'histologie du cancer de l'ovaire : distribution mondiale et implications pour les comparaisons internationales de survie (CONCORD-2) » . Oncologie gynécologique . 144 (2) : 405-413. doi : 10.1016 / j.ygyno.2016.10.019 . PMC 6195192 . PMID 27931752 .
- ^ "Dysgerminome" , Wikipedia , 2019-02-13 , récupéré 2019-04-09
- ^ Hazard FK (2019). « Pathologie des dysgerminomes ovariens : aperçu des dysgerminomes ovariens, différenciation des dysgerminomes ovariens, marqueurs de laboratoire » . Medscape .
- ^ " Tératome immature" , Wikipedia , 2019-03-14 , récupéré 2019-04-10
- ^ un b Medeiros F, Strickland KC (janvier 2018). "Chapitre 26: Tumeurs des cellules germinales de l'ovaire.". Pathologie gynécologique et obstétricale diagnostique (troisième édition). p. 949-1010. doi : 10.1016/B978-0-323-44732-4.00026-1 . ISBN 978-0-323-44732-4.
- ^ Templeman CL, Hertweck SP, Scheetz JP, Perlman SE, Fallat ME (décembre 2000). "La prise en charge des tératomes kystiques matures chez l'enfant et l'adolescent : une analyse rétrospective" . Reproduction humaine . 15 (12) : 2669-72. doi : 10.1093/humrep/15.12.2669 . PMID 11098043 .
- ^ Outwater EK, Siegelman ES, Chasse JL (2001). "Tératomes ovariens : types de tumeurs et caractéristiques d'imagerie" . Radiographie . 21 (2) : 475-90. doi : 10.1148/radiographics.21.2.g01mr09475 . PMID 11259710 .
- ^ "Tumeur du sinus endodermique" , Wikipédia , 01-02-2019 , récupéré le 10-04-2019
- ^ Talerman A (juillet 1975). "L'incidence des éléments tumoraux du sac vitellin (tumeur du sinus endodermique) dans les tumeurs des cellules germinales du testicule chez l'adulte" . Cancer . 36 (1) : 211-5. doi : 10.1002/1097-0142 (197507)36:1<211::AID-CNCR2820360122>3.0.CO;2-W . PMID 1203848 .
- ^ A b c Kurman RJ, Norris HJ (Décembre 1976). « Tumeur du sinus endodermique de l'ovaire : une analyse clinique et pathologique de 71 cas ». Cancer . 38 (6): 2404–19. doi : 10.1002 / 1097-0142 (197612) 38: 6 <2404 :: aid-cncr2820380629> 3.0.co; 2-3 . PMID 63318 .
- ^ "Choriocarcinome" , Wikipedia , 2019-02-23 , récupéré 2019-04-10
- ^ Smith HO, Berwick M, Verschraegen CF, Wiggins C, Lansing L, Muller CY, Qualls CR (mai 2006). « Taux d'incidence et de survie pour les tumeurs germinales malignes féminines ». Obstétrique et Gynécologie . 107 (5) : 1075–85. doi : 10.1097/01.AOG.0000216004.22588.ce . PMID 16648414 . S2CID 25914370 .
- ^ Ulbright TM (février 2005). « Tumeurs des cellules germinales des gonades : une revue sélective mettant l'accent sur les problèmes de diagnostic différentiel, les questions nouvellement appréciées et controversées » . Pathologie moderne . 18 Suppl 2 (2) : S61-79. doi : 10.1038/modpathol.3800310 . PMID 15761467 .
- ^ "Tumeurs de l'ovaire à cellules germinales | Cancer de l'ovaire | Cancer Research UK" . www.cancerresearchuk.org . Récupéré le 2019-04-10 .
- ^ Moniaga NC, Randall LM (février 2011). "Tumeur maligne de cellules germinales ovariennes mixtes avec composant embryonnaire" . Journal de gynécologie pédiatrique et adolescente . 24 (1) : e1-3. doi : 10.1016/j.jpag.2010.05.001 . PMC 5111966 . PMID 20869284 .
- ^ Calongos G, Ogino M, Kinuta T, Hori M, Mori T (2016). "Sœur Mary Joseph Nodule comme première manifestation d'un cancer de l'ovaire métastatique" . Rapports de cas en obstétrique et gynécologie . 2016 : 1087513. doi : 10.1155/2016/1087513 . PMC 5007344 . PMID 27635270 .
- ^ Williams SD (juin 1998). « Tumeurs des cellules germinales de l'ovaire : une mise à jour ». Séminaires en oncologie . 25 (3) : 407-13. PMID 9633853 .
- ^ A b c d e f g h Kraggerud SM, Hoeï-Hansen CE, Alagaratnam S, Skotheim RI, Abeler VM, Rajpert-De Meyts E, Lothe RA (Juin 2013). « Caractéristiques moléculaires des tumeurs malignes des cellules germinales de l'ovaire et comparaison avec leurs homologues testiculaires : implications pour la pathogenèse » . Examens endocriniens . 34 (3) : 339–76. doi : 10.1210/er.2012-1045 . PMC 3787935 . PMID 23575763 .
-
^ "Dysgerminomes ovariens : Contexte, physiopathologie, épidémiologie" . 18/03/2019. Citer le journal nécessite
|journal=( aide ) - ^ A b c d "ovaire tumeur germinale symptômes, tests, le pronostic, et étapes" . Institut national du cancer . 1980-01-01 . Récupéré 03/04/2019 .
- ^ "Cancer de l'ovaire" , Wikipédia , 2019-03-19 , récupéré 2019-04-10
- ^ A b c d e f g h i Bixel KL, Fowler J (2018). "Les tumeurs des cellules germinales de l'ovaire". Soins gynécologiques . La presse de l'Universite de Cambridge. 350–359. doi : 10.1017/9781108178594.037 . ISBN 9781108178594.
- ^ « Chimiothérapie intrapéritonéale hyperthermique » , Wikipedia , 2019-03-19 , récupéré 2019-04-10
- ^ "Tumeurs des cellules germinales de l'ovaire - Examen des médicaments contre le cancer sur la liste des médicaments essentiels de l'OMS" (PDF) . Union pour la lutte internationale contre le cancer . 2014.
- ^ un b "Chimiothérapie" . Alliance de recherche sur le cancer de l'ovaire . Récupéré le 01/04/2019 .
- ^ "Informations sur la thérapie par le platine (traitement anticancéreux)" . monVMC . 2005 . Récupéré le 01/04/2019 .
- ^ Wang Y, Yang JX, Yu M, Cao DY, Shen K (2018). "Tumeur maligne de cellules germinales ovarienne mixte composée de tératome immature, tumeur du sac vitellin et carcinome embryonnaire hébergeant une mutation EGFR: un rapport de cas" . OncoCibles et thérapie . 11 : 6853-6862. doi : 10.2147/ott.s176854 . PMC 6190639 . PMID 30349318 .
- ^ A b c " le traitement du cancer péritonéal Boston" . Centre Médical Tufts . Récupéré le 01-04-2019 .
- ^ A b c Yu HH, Yonemura Y, Hsieh MC, Lu CY, Wu SY, Shan YS (2019). "Expérience de l'application de la chirurgie cytoréductrice et de la chimiothérapie intrapéritonéale hyperthermique pour le tératome ovarien avec transformation maligne et dissémination péritonéale" . Thérapeutique et gestion des risques cliniques . 15 : 129-136. doi : 10.2147 / tcrm.s190641 . PMC 6338109 . PMID 30679911 .
- ^ Kaatsch P, Häfner C, Calaminus G, Blettner M, Tulla M (janvier 2015). « Tumeurs des cellules germinales pédiatriques de 1987 à 2011 : taux d'incidence, tendances temporelles et survie » . Pédiatrie . 135 (1) : e136-43. doi : 10.1542/peds.2014-1989 . PMID 25489016 . S2CID 1149576 .
- ^ Wang Y, Yang JX, Yu M, Cao DY, Shen K (2018). « Tumeur maligne mixte des cellules germinales de l'ovaire composée d'un tératome immature, d'une tumeur du sac vitellin et d'un carcinome embryonnaire porteur d'une mutation EGFR : à propos d'un cas » . OncoCibles et thérapie . 11 : 6853-6862. doi : 10.2147 / OTT.S176854 . PMC 6190639 . PMID 30349318 .
Liens externes
| Classification |
|---|