Anémie par carence en vitamine B 12 -Vitamin B12 deficiency anemia
| La vitamine B 12 anémie par carence | |
|---|---|
| Autres noms | Anémie pernicieuse, anémie de Biermer, anémie d'Addison, anémie d'Addison-Biermer |
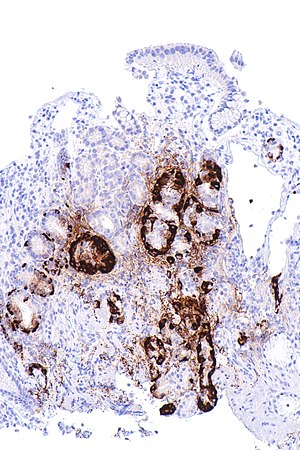 | |
| Micrographie montrant une hyperplasie nodulaire des cellules de type entérochromaffine, démontrée par immunocoloration de la chromogranine A , dans le corps de l' estomac . Les cellules pariétales ne sont pas facilement apparentes. Ces changements sont conformes à la gastrite atrophique métaplasie auto - immune, un corrélat histologique de la vitamine B 12 anémie par carence. | |
| Spécialité | Hématologie |
| Symptômes | Sensation de fatigue, essoufflement , peau pâle, engourdissement des mains et des pieds, mauvais réflexes , confusion |
| Début habituel | > 60 ans |
| Causes | Pas assez de vitamine B 12 |
| Méthode de diagnostic | Des tests sanguins , des tests de moelle osseuse |
| Traitement | Vitamine B 12 comprimés ou injections |
| Pronostic | Avec un traitement une vie normale |
| La fréquence | 1 pour 1000 personnes |
L' anémie par carence en vitamine B 12 , dont l'anémie pernicieuse ( AP ) est un type, est une maladie dans laquelle une quantité insuffisante de globules rouges est produite en raison d'une carence en vitamine B 12 . Le symptôme initial le plus courant est une sensation de fatigue et de faiblesse . D'autres symptômes peuvent inclure un essoufflement , une peau pâle, une sensation de perte de connaissance (étourdissements), des douleurs thoraciques, un rythme cardiaque rapide , un engourdissement des mains et des pieds, un mauvais équilibre, une chute fréquente de la tension artérielle , une perte d'appétit, un langue rouge, mauvais réflexes et, dans les cas graves, même dépression et confusion. Sans traitement, certains de ces problèmes peuvent devenir permanents.
L'anémie pernicieuse fait référence à l' anémie qui résulte d'un manque de vitamine B12. Le manque de facteur intrinsèque est le plus souvent dû à une attaque auto - immune des cellules qui le créent dans l' estomac . Elle peut également survenir à la suite de l'ablation chirurgicale d'une partie de l'estomac ou d'une maladie héréditaire. Les autres causes d'une faible teneur en vitamine B 12 incluent un apport alimentaire insuffisant (ce qui peut être un risque dans un régime végétalien ), la maladie cœliaque ou l' infection par le ténia . En cas de suspicion, le diagnostic est posé par des tests sanguins et, occasionnellement, par des tests de moelle osseuse. Les tests sanguins peuvent montrer des globules rouges moins nombreux mais plus gros , un faible nombre de jeunes globules rouges , de faibles niveaux de vitamine B 12 et des anticorps dirigés contre le facteur intrinsèque.
L' anémie pernicieuse peut être traité avec des injections de vitamine B 12 . Si les symptômes sont graves, les injections sont généralement recommandées au départ. Pour ceux qui ont du mal à avaler des pilules, un spray nasal est disponible. Souvent, le traitement dure toute la vie.
L'anémie pernicieuse due à des problèmes auto-immuns survient chez environ une personne sur 1000. Parmi les personnes de plus de 60 ans, environ 2% en sont atteintes. Elle affecte plus souvent les personnes d'origine nord-européenne. Les femmes sont plus souvent touchées que les hommes. Avec un traitement approprié, la plupart des gens mènent une vie normale. En raison d'un risque plus élevé de cancer de l' estomac , les personnes atteintes d'anémie pernicieuse doivent être contrôlées régulièrement. La première description claire a été faite par Thomas Addison en 1849. Le terme « pernicieux » signifie « mortel », et ce terme a été utilisé car avant la disponibilité du traitement, la maladie était souvent mortelle.
Signes et symptômes
La progression de l'anémie pernicieuse se fait lentement. Il peut être difficile de reconnaître les symptômes car il peut s'habituer à ne pas se sentir bien. non traitée, elle peut entraîner des complications neurologiques et, dans les cas graves, la mort. De nombreux signes et symptômes sont dus à l'anémie elle-même, lorsque l'anémie est présente. Les symptômes peuvent inclure :
- sensation de fatigue, faiblesse constante (fatigue)
- étourdissements ou sensation de faiblesse (étourdissements)
- mains et pieds froids
- maux d'estomac et nausées
- une langue rouge douloureuse ( glossite ), également appelée langue de cerise
- rythme cardiaque rapide (flottement ou rythme cardiaque irrégulier)
- une chute fréquente de la pression artérielle (hypotension)
- une peau jaunâtre et pâle ( jaunisse )
- essoufflement "les soupirs"
- bas grade fièvres , tremblements et se sentir constamment froid
- perte d'appétit et perte de poids
- diarrhée ou constipation
- Chéilite angulaire (lésions inflammatoires aux commissures de la bouche)
- chute et faiblesse des cheveux, vieillissement précoce des cheveux
- douleur thoracique ( angine de poitrine )
Dans les cas plus graves ou prolongés d'anémie pernicieuse ; cela peut entraîner des lésions nerveuses, ce qui provoque des complications neurologiques, cela peut inclure:
- Sensations anormales, y compris fourmillements ou engourdissements dans les doigts et les orteils ( épingles et aiguilles ), perte de sens, difficulté de proprioception et douleur neuropathique (l' anémie par carence en vitamine B 12 est la seule anémie qui affecte le système nerveux et le cerveau)
- diminution des capacités mentales, y compris changements de personnalité, dépression , Irritabilité , confusion, stupeur , troubles cognitifs (y compris difficulté à se concentrer et réponses lentes, familièrement appelé brouillard cérébral )
- changements dans la mobilité; y compris la marche instable ( ataxie ), un mauvais équilibre et une perte de sensation dans les pieds
- vision floue (perturbée)
- problèmes de mémoire
- faiblesse musculaire , douleurs articulaires sévères ( arthralgie )
Le symptôme initial le plus courant est une sensation de fatigue et de faiblesse (en général), bien que ; l'anémie peut se manifester par un certain nombre d'autres symptômes courants, notamment des aphtes, des saignements des gencives, un regard d'épuisement avec des lèvres pâles et déshydratées ou gercées et des cernes autour des yeux, ainsi que des ongles cassants. Étant donné que l'AP affecte le système nerveux, ce qui provoque des complications neurologiques, les symptômes peuvent également inclure une perte et des modifications des réflexes, des sautes d'humeur, des acouphènes, des troubles de la miction, une démarche instable, des problèmes de fertilité, de l'anxiété, une psychose et une maladresse. également, une diminution du goût ou de l'odeur peut se produire. L'anémie peut également entraîner des souffles cardiaques, une altération de la pression artérielle ( basse ou élevée ). La carence peut également présenter des troubles de la thyroïde. Dans les cas graves, l'anémie peut provoquer des signes d'insuffisance cardiaque congestive. Une complication de l'AP chronique sévère est la dégénérescence combinée subaiguë de la moelle épinière , qui entraîne une perte sensorielle distale (colonne postérieure), un réflexe de cheville absent, une réponse réflexe accrue du genou et une réponse plantaire des extenseurs. Outre l'anémie, les symptômes hématologiques peuvent inclure des cytopénies , une hémolyse intramédullaire et une microangiopathie pseudothrombotique. L'anémie pernicieuse peut contribuer à un retard de croissance physique chez les enfants, et peut également être une cause de retard de puberté chez les adolescents.
Causes
La vitamine B 12 ne peut pas être produite par le corps humain et doit être obtenue à partir de l'alimentation. Lorsque des aliments contenant du B 12 sont consommés, la vitamine est généralement liée aux protéines et est libérée par les protéases libérées par le pancréas dans l'intestin grêle. Après sa libération, la majeure partie de la vitamine B 12 est absorbée par l'organisme dans l'intestin grêle ( iléon ) après s'être liée à une protéine connue sous le nom de facteur intrinsèque . Le facteur intrinsèque est produit par les cellules pariétales de la muqueuse gastrique (paroi de l'estomac) et le complexe facteur intrinsèque-B 12 est absorbé par les récepteurs de la cubiline sur les cellules épithéliales de l'iléon . L'AP est caractérisée par une déficience en B 12 causée par l'absence de facteur intrinsèque.
L'AP peut être considérée comme un stade terminal de la gastrite immunitaire , une maladie caractérisée par une atrophie de l'estomac et la présence d' anticorps dirigés contre les cellules pariétales et le facteur intrinsèque. Une forme spécifique de gastrite chronique, la gastrite de type A ou gastrite à corps atrophique, est fortement associée à l'AP. Cette maladie auto-immune est localisée dans le corps de l'estomac, où se trouvent les cellules pariétales. Les anticorps dirigés contre le facteur intrinsèque et les cellules pariétales provoquent la destruction de la muqueuse gastrique oxyntique, dans laquelle se trouvent les cellules pariétales, entraînant la perte subséquente de la synthèse du facteur intrinsèque. Sans facteur intrinsèque, l'iléon ne peut plus absorber le B 12 .
Bien que le rôle exact de l' infection à Helicobacter pylori dans l'AP reste controversé, les preuves indiquent que H. pylori est impliqué dans la pathogenèse de la maladie. Une infection de longue date à H. pylori peut provoquer une auto-immunité gastrique par un mécanisme connu sous le nom de mimétisme moléculaire . Les anticorps produits par le système immunitaire peuvent avoir une réaction croisée et peuvent se lier à la fois aux antigènes de H. pylori et à ceux trouvés dans la muqueuse gastrique . Les anticorps sont produits par des cellules B activées qui reconnaissent à la fois les peptides pathogènes et auto-dérivés. Les auto-antigènes supposés provoquer l'autoréactivité sont les sous-unités alpha et bêta de la H + /K + -ATPase. Dans une étude, le déficit en vitamine B12 causé par Helicobacter pylori était positivement corrélé à la positivité de CagA et à l'activité inflammatoire gastrique, plutôt qu'à l'atrophie gastrique.
Moins fréquemment, H. pylori et le syndrome de Zollinger-Ellison peuvent également provoquer une forme de gastrite non auto-immune pouvant entraîner une anémie pernicieuse.
Une diminution de l' absorption de B 12 peut également survenir après une ablation gastrique ( gastrectomie ) ou un pontage gastrique. Dans ces chirurgies, soit les parties de l'estomac qui produisent les sécrétions gastriques sont enlevées, soit elles sont contournées. Cela signifie que le facteur intrinsèque, ainsi que d'autres facteurs requis pour l' absorption du B 12 , ne sont pas disponibles. Cependant, la carence en vitamine B 12 après une chirurgie gastrique ne devient généralement pas un problème clinique. Ceci est probablement dû au fait que le corps stocke de nombreuses années de vitamine B 12 dans le foie et que les patients ayant subi une chirurgie gastrique reçoivent un complément adéquat en vitamine.
Bien qu'aucun gène spécifique de susceptibilité à l'AP n'ait été identifié, un facteur génétique est probablement impliqué dans la maladie. L'anémie pernicieuse est souvent associée à d'autres troubles auto-immuns, ce qui suggère que des gènes de susceptibilité auto-immune communs peuvent être un facteur causal. Malgré cela, des études familiales antérieures et des rapports de cas axés sur l'AP ont suggéré qu'il existe une tendance à l'héritage génétique de l'AP en particulier, et les proches parents des patients atteints d'AP semblent avoir une incidence plus élevée d'AP et d'affections associées à l'AP. De plus, il a en outre été indiqué que la formation d'anticorps dirigés contre les cellules gastriques était déterminée par un gène autosomique dominant et que la présence d'anticorps dirigés contre les cellules gastriques pourrait ne pas être nécessairement liée à l'apparition d'une gastrite atrophique liée à l'AP.
Physiopathologie
Bien qu'un corps sain stocke trois à cinq ans de vitamine B 12 dans le foie, l'activité auto-immune habituellement non détectée dans l'intestin sur une période prolongée entraîne une déplétion en vitamine B 12 et l'anémie qui en résulte. B 12 est requis par les enzymes pour deux réactions : la conversion du méthylmalonyl CoA en succinyl CoA et la conversion de l' homocystéine en méthionine . Dans cette dernière réaction, le groupe méthyle du 5-méthyltétrahydrofolate est transféré à l'homocystéine pour produire du tétrahydrofolate et de la méthionine. Cette réaction est catalysée par l'enzyme méthionine synthase avec B 12 comme cofacteur essentiel. Lors d'une carence en B 12 , cette réaction ne peut pas se dérouler, ce qui conduit à l'accumulation de 5-méthyltétrahydrofolate. Cette accumulation épuise les autres types de folate nécessaires à la synthèse des purines et des thymidylates , nécessaires à la synthèse de l'ADN. L'inhibition de la réplication de l' ADN dans les globules rouges en cours de maturation entraîne la formation de gros érythrocytes mégaloblastiques fragiles . On pense que les aspects neurologiques de la maladie découlent de l'accumulation de méthylmalonyl CoA en raison de l'exigence de B 12 comme cofacteur de l'enzyme méthylmalonyl CoA mutase.
Diagnostic

On pense que l'anémie pernicieuse est principalement une maladie auto-immune qui endommage les cellules pariétales de l'estomac - car elle entraîne une diminution de la production du facteur intrinsèque et une altération de l'absorption de B- 12 ; Cependant, l'anémie pernicieuse peut également avoir une composante génétique , potentiellement dans les familles. Une anémie pernicieuse peut être suspectée lorsque le frottis sanguin d' un patient montre des érythrocytes volumineux, cassants, immatures, appelés mégaloblastes . un diagnostic d'anémie pernicieuse Il nécessite une numération formule sanguine et un frottis sanguin et ces tests comprennent:
- Formule sanguine complète et frottis sanguin périphérique ; L'AP nécessite d'abord la démonstration de l'anémie mégaloblastique en effectuant une numération formule sanguine complète et un frottis sanguin, qui évalue le volume globulaire moyen (VCM), ainsi que la concentration globulaire moyenne d'hémoglobine (CCMH). L'AP est identifiée avec un MCV élevé ( anémie macrocytaire ) et un MCHC normal (anémie normochrome ). Des ovalocytes sont également généralement observés sur le frottis sanguin, et unecaractéristique pathognomonique des anémies mégaloblastiques (qui incluent l'AP et d'autres) est l'hypersegmentation des neutrophiles.
- Vitamine B 12 sérique ; les taux sériques sont utilisés pour détecter sa carence, mais ils ne distinguent pas ses causes. lesniveaux devitamine B 12 peuvent être faussement élevés ou bas et les données de sensibilité et de spécificité varient considérablement. Des taux sériques normaux peuvent être trouvés en cas de carence où des troubles myéloprolifératifs , une maladie du foie , une carence en transcobalamine II ou une prolifération bactérienne intestinale sont présents.
- Facteur intrinsèque et anticorps des cellules pariétales ; Le sang est vérifié pour les anticorps contre l'IF et les cellules pariétales dans l'estomac. La présence d'anticorps dirigés contre les cellules pariétales gastriques et l'IF est fréquente dans l'AP. On trouve des anticorps contre les cellules pariétales dans d'autres maladies auto-immunes et aussi chez jusqu'à 10 % des individus sains. Cependant, environ 85 % des patients atteints d'AP ont des anticorps contre les cellules pariétales, ce qui signifie qu'ils sont un marqueur sensible de la maladie. Les anticorps du facteur intrinsèque sont beaucoup moins sensibles que les anticorps des cellules pariétales, mais ils sont beaucoup plus spécifiques. On les trouve chez environ la moitié des patients atteints d'AP et très rarement dans d'autres troubles. Ces tests d'anticorps peuvent distinguer entre les PA et les aliments-B 12 malabsorption.
- Acide méthylmalonique et/ou homocystéine ; la vitamine B 12 joue un rôle important dans les processus métaboliques et les fonctions cellulaires. Par conséquent, sa carence entraîne l'accumulation de certains produits métaboliques. L'acide méthylmalonique et/ou l'homocystéine est l'un des produits métaboliques qui peuvent être mesurés dans le sang. car l'augmentation des niveaux des deux aide à différencier la carence en vitamine B 12 et la carence en acide folique , car l'homocystéine seule augmente cette dernière.
Des niveaux élevés de gastrine peuvent être trouvés dans environ 80 à 90 % des cas d'AP, mais ils peuvent également être trouvés dans d'autres formes de gastrite. Une diminution des taux de pepsinogène I ou une diminution du rapport pepsinogène I/pepsinogène II peut également être observée, bien que ces résultats soient moins spécifiques à l'AP et puissent être trouvés dans la malabsorption des aliments B 12 et d'autres formes de gastrite.
Le diagnostic de gastrite atrophique de type A doit être confirmé par gastroscopie et biopsie progressive. Environ 90 % des personnes atteintes d'AP ont des anticorps contre les cellules pariétales ; cependant, seulement 50 % de tous les individus dans la population générale avec ces anticorps ont une anémie pernicieuse.
Formes de vitamine B 12 déficit autre que PA doivent être pris en compte dans le diagnostic différentiel de l' anémie mégaloblastique. Par exemple, un état déficient en vitamine B 12 qui provoque une anémie mégaloblastique et qui peut être confondu avec l'AP classique peut être causé par une infection par le ténia Diphyllobothrium latum , probablement en raison de la compétition du parasite avec l'hôte pour la vitamine B 12 .
Le test classique pour l'AP, le test de Schilling , n'est plus largement utilisé, car des méthodes plus efficaces sont disponibles. Ce test historique a consisté, dans sa première étape, à prendre une dose orale de vitamine B 12 radiomarquée , suivie d'une quantification de la vitamine dans les urines du patient sur une période de 24 heures via une mesure de la radioactivité . Une deuxième étape du test répète le régime et la procédure de la première étape, avec l'ajout de facteur intrinsèque oral. Un patient atteint d'AP présente des quantités de facteur intrinsèque inférieures à la normale ; par conséquent, l' addition de facteur intrinsèque dans les résultats du deuxième étape d'une augmentation de la vitamine B 12 absorption (sur la base de référence établie dans le premier). Le test de Schilling distinguait l'AP des autres formes de carence en vitamine B 12 , en particulier du syndrome d'Imerslund-Grasbeck (IGS), une carence en vitamine B12 causée par des mutations de la cubiline, le récepteur de la cobalamine.
Traitement
Le traitement de l'AP varie selon les pays et les régions. Les avis divergent sur l'efficacité de l'administration (parentérale/orale), la quantité et l'intervalle de temps des doses, ou les formes de vitamine B 12 (par exemple cyanocobalamine/hydroxocobalamine). Des études plus approfondies sont encore nécessaires afin de valider la faisabilité d'une méthode thérapeutique particulière pour l'AP dans les pratiques cliniques. Il n'existe pas de remède permanent pour l'AP, bien que la réplétion de B 12 devrait entraîner l'arrêt des symptômes liés à l'anémie, un arrêt de la détérioration neurologique et, dans les cas où les problèmes neurologiques ne sont pas avancés, une récupération neurologique et une rémission complète et permanente de tous les symptômes, tant que B 12 est complété. Réplétion de B 12 peut être accompli dans une variété de façons.
Injections intramusculaires
Le traitement standard de l'AP a consisté en des injections intramusculaires de cobalamine sous forme de cyanocobalamine (CN-Cbl), d' hydroxocobalamine (OH-Cbl) ou de méthylcobalamine .
Doses orales
Le traitement par doses élevées de vitamine B 12 sous forme orale de 1000 mcg (1 mg) apparaît également aussi efficaces que et moins cher que la forme parentérale.
Pronostic
Une personne atteinte d'AP bien traitée peut mener une vie saine. Cependant, ne pas diagnostiquer et traiter à temps peut entraîner des dommages neurologiques permanents, une fatigue excessive, une dépression, une perte de mémoire et d'autres complications. Dans les cas graves, les complications neurologiques de l'anémie pernicieuse peuvent entraîner la mort - d'où le nom « pernicieux », signifiant mortel.
Une association a été observée entre l'anémie pernicieuse et certains types de cancer gastrique, mais un lien de causalité n'a pas été établi.
Épidémiologie
On estime que l'AP affecte 0,1 % de la population générale et 1,9 % des personnes de plus de 60 ans, ce qui représente 20 à 50 % de la carence en vitamine B 12 chez les adultes. Une revue de la littérature montre que la prévalence de l'AP est plus élevée en Europe du Nord, en particulier dans les pays scandinaves, et parmi les personnes d'ascendance africaine, et qu'une sensibilisation accrue à la maladie et de meilleurs outils de diagnostic pourraient jouer un rôle dans des taux d'incidence apparemment plus élevés.
Histoire
Les symptômes sont décrits pour la première fois en 1822 par le Dr James Scarth Combe dans les Transactions de la Société médico-chirurgique d'Édimbourg , sous le titre Histoire d'un cas d'anémie .
Cependant, cela n'a pas été étudié plus en profondeur jusqu'en 1849, par le médecin britannique Thomas Addison , à partir duquel il a acquis le nom commun d'anémie d'Addison. En 1871, le médecin allemand Michael Anton Biermer (1827-1892) remarqua la particularité de l'anémie chez l'un de ses patients ; il a plus tard inventé le terme « anémie pernicieuse progressive ». En 1907, Richard Clarke Cabot a rapporté une série de 1200 patients atteints d'AP ; leur survie moyenne était comprise entre un et trois ans. William Bosworth Castle a réalisé une expérience dans laquelle il a ingéré de la viande de hamburger crue et l'a régurgitée après une heure, puis l'a donnée à un groupe de 10 patients. De la viande de hamburger crue non traitée a été donnée au groupe témoin. Le premier groupe a montré une réponse à la maladie, contrairement au dernier groupe. Ce n'était pas une pratique durable, mais cela démontrait l'existence d'un «facteur intrinsèque» du suc gastrique.
L'anémie pernicieuse était une maladie mortelle avant l'année 1920 environ, lorsque George Whipple a suggéré le foie cru comme traitement. Le premier traitement viable pour l'anémie pernicieuse a commencé lorsque Whipple a fait une découverte au cours d'expériences dans lesquelles il saignait des chiens pour les rendre anémiques, puis les nourrissait de divers aliments pour voir ce qui les ferait récupérer le plus rapidement (il cherchait des traitements pour l'anémie de saignement, pas d'anémie pernicieuse). Whipple a découvert que l'ingestion de grandes quantités de foie semblait guérir l'anémie due à la perte de sang, et a essayé l'ingestion de foie comme traitement de l'anémie pernicieuse, signalant également une amélioration dans un article en 1920. George Minot et William Murphy ont alors entrepris d'isoler en partie le propriété curative dans le foie, et en 1926 a montré qu'il était contenu dans le jus de foie cru (ce qui a également montré que c'était le fer dans le tissu hépatique, et non le facteur soluble dans le jus de foie, qui a guéri l'anémie due aux saignements chez les chiens) ; ainsi, la découverte du facteur de jus de foie comme traitement de l'anémie pernicieuse avait été une coïncidence. Frieda Robscheit-Robbins a travaillé en étroite collaboration avec Whipple, co-auteur de 21 articles de 1925 à 1930. Pour la découverte du traitement d'une maladie auparavant mortelle de cause inconnue, Whipple, Minot et Murphy ont partagé le prix Nobel de médecine 1934 .
Après la vérification par Minot et Murphy des résultats de Whipple en 1926, les victimes d'anémie pernicieuse mangeaient ou buvaient au moins une demi-livre de foie cru, ou buvaient du jus de foie cru, chaque jour. Cela a continué pendant plusieurs années, jusqu'à ce qu'un concentré de jus de foie devienne disponible. En 1928, le chimiste Edwin Cohn a préparé un extrait de foie qui était 50 à 100 fois plus puissant que l'aliment naturel (foie). L'extrait pouvait même être injecté dans le muscle, ce qui signifiait que les patients n'avaient plus besoin de manger de grandes quantités de foie ou de jus. Cela a également réduit considérablement le coût du traitement.
L'ingrédient actif dans le foie est resté inconnu jusqu'en 1948, quand il a été isolé par deux chimistes, Karl A. Folkers des États-Unis et Alexander R. Todd de Grande-Bretagne. La substance était un cobalamine , que les découvreurs nommés vitamine B 12 . La nouvelle vitamine contenue dans le jus de foie a finalement été complètement purifiée et caractérisée dans les années 1950, et d'autres méthodes de production à partir de bactéries ont été développées. Il pourrait être injecté dans le muscle avec encore moins d'irritation, permettant de traiter l'AP avec encore plus de facilité. L'anémie pernicieuse a finalement été traitée par des injections ou de fortes doses orales de B 12 , généralement entre 1 et 4 mg par jour.
Un écrivain a émis l'hypothèse que Mary Todd Lincoln , l'épouse du président américain Abraham Lincoln , souffrait d'anémie pernicieuse depuis des décennies et en est morte.
Recherche
Complexe SNAC
Bien que les mégadoses orales et les injections intramusculaires soient les méthodes de traitement les plus courantes actuellement disponibles, plusieurs nouvelles méthodes sont en cours de test, avec de fortes promesses pour une future incorporation dans les méthodes de traitement traditionnelles. Les injections étant des véhicules défavorables à l'administration de médicaments, la recherche actuelle consiste à améliorer la diffusion passive à travers l'iléon lors de l'ingestion orale de dérivés de la cobalamine. Les chercheurs ont récemment tiré parti du nouveau composé de sodium N-[8-(2-hydroxybenzoyl)amino]caprylate (SNAC), qui améliore considérablement la biodisponibilité et la stabilité métabolique. Le SNAC est capable de former un complexe non covalent avec la cobalamine tout en préservant son intégrité chimique. Ce complexe est beaucoup plus lipophile que la vitamine B 12 soluble dans l'eau , il est donc capable de traverser les membranes cellulaires avec une plus grande facilité.
Facteur intrinsèque recombinant
Une autre méthode pour augmenter l'absorption à travers l'iléon consiste à ingérer un complexe Cbl auquel IF est déjà lié. Le manque de facteur intrinsèque produit par le corps du patient peut être complété par l'utilisation d'IF humain synthétique produit à partir de recombinants de pois . Cependant, dans les cas où les anticorps IF- sont à l'origine d'une malabsorption à travers l'iléon, ce traitement serait inefficace.
Livraison sublinguale
Les traitements sublinguaux ont également été postulés pour être plus efficaces que les traitements oraux seuls. Une étude de 2003 a révélé que, bien que cette méthode soit efficace, une dose de 500 g de cyanocobalamine administrée par voie orale ou sublinguale est tout aussi efficace pour rétablir les concentrations physiologiques normales de cobalamine.
Les références
Liens externes
| Classification | |
|---|---|
| Ressources externes |

