Récepteur gamma activé par les proliférateurs de peroxysomes - Peroxisome proliferator-activated receptor gamma
Le récepteur gamma activé par les proliférateurs de peroxysomes ( PPAR-γ ou PPARG ), également connu sous le nom de récepteur de résistance inverse à l'insuline de la glitazone , ou NR1C3 (récepteur nucléaire de la sous-famille 1, groupe C, membre 3) est un récepteur nucléaire de type II (gènes de régulation des protéines) qui chez l'homme est codé par le gène PPRG .
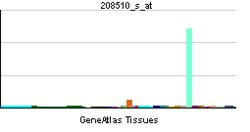
Distribution de tissus
PPARG est principalement présent dans le tissu adipeux , le côlon et les macrophages. Deux isoformes de PPARG sont détectées chez l'humain et chez la souris : PPAR-γ1 (présent dans presque tous les tissus à l'exception des muscles) et PPAR-γ2 (principalement présent dans le tissu adipeux et l'intestin).
L'expression du gène
Ce gène code pour un membre de la sous-famille des récepteurs nucléaires activés par les proliférateurs de peroxysomes (PPAR). Les PPAR forment des hétérodimères avec les récepteurs X des rétinoïdes (RXR) et ces hétérodimères régulent la transcription de divers gènes. Trois sous-types de PPAR sont connus : PPAR-alpha , PPAR-delta et PPAR-gamma. La protéine codée par ce gène est PPAR-gamma et est un régulateur de la différenciation adipocytaire . Des variantes de transcrits épissés en variante qui codent pour différentes isoformes ont été décrites.
L'activité PPRG peut être régulée par phosphorylation via la voie MEK/ERK. Cette modification diminue l'activité transcriptionnelle de PPARG et conduit à des modifications des gènes diabétiques, et entraîne une insensibilité à l'insuline. Par exemple, la phosphorylation de la sérine 112 inhibera la fonction PPRG et augmentera le potentiel adipogène des fibroblastes.
Fonction
PPRG régule le stockage des acides gras et le métabolisme du glucose. Les gènes activés par PPARG stimulent l'absorption des lipides et l' adipogenèse par les cellules graisseuses. Les souris knock-out de PPARG sont dépourvues de tissu adipeux, faisant de PPARG un régulateur maître de la différenciation adipocytaire .
PPARG augmente la sensibilité à l'insuline en améliorant le stockage des acides gras dans les cellules adipeuses (réduction de la lipotoxicité ), en augmentant la libération d' adiponectine par les cellules adipeuses, en induisant le FGF21 et en améliorant la production de phosphate d'adénine dinucléotide d'acide nicotinique par régulation positive de l' enzyme CD38 .
PPARG favorise l' activation des macrophages M2 anti-inflammatoires chez la souris.
L'adiponectine induit le transport inverse du cholestérol médié par ABCA1 par activation de PPAR-γ et LXRα/β .
De nombreux agents naturels se lient directement au PPAR gamma et l'activent. Ces agents comprennent divers acides gras polyinsaturés comme l'acide arachidonique et les métabolites de l'acide arachidonique tels que certains membres de la famille des acides 5-hydroxyicosatétraénoïque et 5-oxo-eicosatétraénoïque , par exemple le 5-oxo-15(S)-HETE et le 5-oxo-ETE ou Famille d' acide 15-hydroxyicosatétraénoïque comprenant le 15( S )-HETE, le 15( R )-HETE et le 15( S )-HpETE. Le phytocannabinoïde tétrahydrocannabinol (THC), son métabolite THC-COOH et son analogue synthétique, l' acide ajulémique (AJA). L'activation de PPAR gamma par ces ligands et d'autres peut être responsable de l'inhibition de la croissance de lignées cellulaires cancéreuses mammaires, gastriques, pulmonaires, prostatiques et autres cultivées.
Au cours de l'embryogenèse, PPRG s'exprime d'abord substantiellement dans le coussinet adipeux brun interscapulaire. L'épuisement de PPARG entraînera une létalité embryonnaire à E10,5, en raison des anomalies vasculaires du placenta, sans perméation des vaisseaux sanguins fœtaux et sans dilatation et rupture des sinus sanguins maternels. L'expression PPARG peut être détectée dans le placenta dès E8.5 et pendant le reste de la gestation, principalement localisée dans la cellule trophoblastique primaire du placenta humain. PPARG est nécessaire pour la différenciation épithéliale du tissu trophoblastique, ce qui est essentiel pour une bonne vascularisation du placenta. Les agonistes de PPARG inhibent l'invasion des cytotrophoblastes extravilleux. PPARG est également nécessaire pour l'accumulation de gouttelettes lipidiques par le placenta.
Interactions
Il a été démontré que le récepteur gamma activé par les proliférateurs de peroxysomes interagit avec :
Pertinence clinique
Le PPAR-gamma a été impliqué dans la pathologie de nombreuses maladies, notamment l'obésité, le diabète, l'athérosclérose et le cancer. Les agonistes PPAR-gamma ont été utilisés dans le traitement de l' hyperlipidémie et de l' hyperglycémie . Le PPAR-gamma diminue la réponse inflammatoire de nombreuses cellules cardiovasculaires, en particulier les cellules endothéliales . PPAR-gamma active le gène PON1 , augmentant la synthèse et la libération de paraoxonase 1 par le foie, réduisant l' athérosclérose .
Une alimentation pauvre en fibres réduit la production d' acide butyrique et d' acide propionique par le microbiote du côlon, ce qui peut induire une inflammation et avoir d'autres effets indésirables dans la mesure où ces acides gras à chaîne courte activent le PPAR-gamma. Un faible PPAR-gamma réduit la capacité du tissu adipeux à stocker les graisses, ce qui entraîne un stockage accru des graisses dans les tissus non adipeux ( lipotoxicité ). Un régime à base de protéines de soja augmente le PPAR-gamma du tissu adipeux, réduisant ainsi la lipotoxicité.
De nombreux médicaments sensibilisant à l'insuline (à savoir, les thiazolidinediones ) utilisés dans le traitement du diabète activent le PPARG comme moyen d'abaisser la glycémie sans augmenter la sécrétion pancréatique d'insuline. L'activation de PPARG est plus efficace pour la résistance à l'insuline des muscles squelettiques que pour la résistance à l'insuline du foie. Différentes classes de composés qui activent PPARG plus faiblement que les thiazolidinediones (appelés "agonistes partiels de PPARgamma") sont actuellement étudiées dans l'espoir que de tels composés seraient encore des agents hypoglycémiants efficaces mais avec moins d'effets secondaires.
L' acide décanoïque triglycéride à chaîne moyenne s'est avéré être un ligand PPAR-gamma partiellement activant qui n'augmente pas l'adipogenèse. Il a été démontré que l'activation de PPAR-gamma par l'acide décanoïque augmente le nombre de mitochondries, augmente l'enzyme mitochondriale citrate synthase , augmente l' activité du complexe I dans les mitochondries et augmente l'activité de l'enzyme antioxydante catalase .
Une protéine de fusion de PPAR-γ1 et du facteur de transcription thyroïdien PAX8 est présente dans environ un tiers des carcinomes folliculaires de la thyroïde, pour être spécifique les cancers avec une translocation chromosomique de t(2;3)(q13;p25), ce qui permet la juxtaposition de portions des deux gènes.
Il a été démontré que le phytocannabinoïde cannabidiol (CBD) active le PPAR gamma dans des modèles in vitro et in vivo . Les acides carboxyliques cannabinoïdes THCA , CBDA et CBGA activent PAARy plus efficacement que leurs produits décarboxylés ; cependant, le THCA était l'acide trouvé avec la plus grande activité. En tant qu'analogue synthétique du THC-COOH (le principal métabolite non psychotrope du THC ), l' acide ajulémique est également un puissant agoniste du PPARγ. Le groupe acide carboxylique est essentiel pour un temps d'activation plus fort et plus long.
Les références
Lectures complémentaires
- Qi C, Zhu Y, Reddy JK (2001). « Récepteurs activés par les proliférateurs de peroxysomes, coactivateurs et cibles en aval ». Biochimie cellulaire et biophysique . 32 Printemps (1–3) : 187–204. doi : 10.1385/cbb:32:1-3:187 . PMID 11330046 . S2CID 31795393 .
- Kadowaki T, Hara K, Kubota N, Tobe K, Terauchi Y, Yamauchi T, et al. (2002). "Le rôle de PPARgamma dans l'obésité et la résistance à l'insuline induites par un régime riche en graisses". Journal du diabète et de ses complications . 16 (1) : 41–5. doi : 10.1016/S1056-8727(01)00206-9 . PMID 11872365 .
- Wakino S, Law RE, Hsueh WA (2002). « Effets protecteurs vasculaires par activation du récepteur nucléaire PPARgamma ». Journal du diabète et de ses complications . 16 (1) : 46-9. doi : 10.1016/S1056-8727(01)00197-0 . PMID 11872366 .
- Takano H, Komuro I (2002). « Rôles du récepteur gamma activé par les proliférateurs de peroxysomes dans les maladies cardiovasculaires ». Journal du diabète et de ses complications . 16 (1) : 108-14. doi : 10.1016/S1056-8727(01)00203-3 . PMID 11872377 .
- Stumvoll M, Häring H (août 2002). "Le polymorphisme du récepteur gamma2 Pro12Ala activé par les proliférateurs de peroxysomes" . Diabète . 51 (8) : 2341–7. doi : 10.2337/diabetes.51.8.2341 . PMID 12145143 .
- Koeffler HP (janvier 2003). « Le récepteur gamma activé par les proliférateurs de peroxysomes et les cancers ». Recherche clinique sur le cancer . 9 (1) : 1-9. PMID 12538445 .
- Puigserver P, Spiegelman BM (février 2003). « Coactivateur du récepteur gamma activé par les proliférateurs de peroxysomes 1 alpha (PGC-1 alpha) : coactivateur transcriptionnel et régulateur métabolique » . Examens endocriniens . 24 (1) : 78-90. doi : 10.1210/er.2002-0012 . PMID 12588810 .
- Takano H, Hasegawa H, Nagai T, Komuro I (mai 2003). « Le rôle de la voie dépendante de PPARgamma dans le développement de l'hypertrophie cardiaque ». Drogues d'aujourd'hui . 39 (5) : 347-57. doi : 10.1358/dot.2003.39.5.799458 . PMID 12861348 .
- Rangwala SM, Lazar MA (juin 2004). « Le récepteur gamma activé par les proliférateurs de peroxysomes dans le diabète et le métabolisme ». Tendances des sciences pharmacologiques . 25 (6) : 331-6. doi : 10.1016/j.tips.2004.03.012 . PMID 15165749 .
- Cuzzcrea S (juillet 2004). "Ligands gamma des récepteurs activés par les proliférateurs de peroxysomes et lésion d'ischémie et de reperfusion". Pharmacologie vasculaire . 41 (6) : 187-95. doi : 10.1016/j.vph.2004.10.004 . PMID 15653094 .
- Savage DB (janvier 2005). « PPAR gamma en tant que régulateur métabolique : aperçu de la génomique et de la pharmacologie ». Avis d'experts en médecine moléculaire . 7 (1) : 1-16. doi : 10.1017/S1462399405008793 . PMID 15673477 .
- Pégorier JP (avril 2005). "[Récepteurs PPAR et sensibilité à l'insuline: nouveaux agonistes en développement]". Annales d'endocrinologie . 66 (2 Pt 2) : 1S10-7. PMID 15959400 .
- Tsai YS, Maeda N (avril 2005). « PPARgamma : un déterminant critique de la distribution de graisse corporelle chez les humains et les souris ». Tendances en médecine cardiovasculaire . 15 (3) : 81–5. doi : 10.1016/j.tcm.2005.04.002 . PMID 16039966 .
- Gurnell M (décembre 2005). « Peroxisome proliferator-activated receptor gamma et la régulation de la fonction adipocytaire : leçons des études génétiques humaines ». Meilleures pratiques et recherche. Endocrinologie clinique et métabolisme . 19 (4) : 501–23. doi : 10.1016/j.beem.2005.10.001 . PMID 16311214 .
- Cecil JE, Watt P, Palmer CN, Hetherington M (juin 2006). « Bilan énergétique et apport alimentaire : le rôle des polymorphismes du gène PPARgamma ». Physiologie & Comportement . 88 (3) : 227-33. doi : 10.1016/j.physbeh.2006.05.028 . PMID 16777151 . S2CID 54243343 .
- Rousseaux C, Desreumaux P (2007). "[Le récepteur gamma activé par les proliférateurs de peroxysomes et la maladie inflammatoire chronique de l'intestin (PPARgamma et IBD)]". Journal de la Société de Biologie . 200 (2) : 121–31. doi : 10.1051/jbio:2006015 . PMID 17151549 .
- Eriksson JG (avril 2007). "Polymorphismes géniques, taille à la naissance et développement de l'hypertension et du diabète de type 2" . Le Journal de la Nutrition . 137 (4) : 1063–5. doi : 10.1093/jn/137.4.1063 . PMID 17374678 .
- Tönjes A, Stumvoll M (juillet 2007). « Le rôle du polymorphisme Pro12Ala dans le récepteur gamma activé par les proliférateurs de peroxysomes dans le risque de diabète ». Opinion actuelle en nutrition clinique et soins métaboliques . 10 (4) : 410-4. doi : 10.1097/MCO.0b013e3281e389d9 . PMID 17563457 . S2CID 30323803 .
- Burgermeister E, Seger R (juillet 2007). "Les kinases MAPK en tant que navettes nucléo-cytoplasmiques pour PPARgamma" . Cycle cellulaire . 6 (13) : 1539-1548. doi : 10.4161/cc.6.13.4453 . PMID 17611413 .
- Papageorgiou E, Pitulis N, Msaouel P, Lembessis P, Koutsilieris M (août 2007). « La diaphonie non génomique entre les ligands PPAR-gamma et ERK1/2 dans les lignées cellulaires cancéreuses ». Avis d'expert sur les cibles thérapeutiques . 11 (8) : 1071-1085. doi : 10.1517/14728222.11.8.1071 . PMID 17665979 . S2CID 86480850 .
Cet article incorpore du texte de la National Library of Medicine des États-Unis , qui est dans le domaine public .