Facteur pionnier - Pioneer factor
Les facteurs pionniers sont des facteurs de transcription qui peuvent se lier directement à la chromatine condensée . Ils peuvent avoir des effets positifs et négatifs sur la transcription et sont importants dans le recrutement d'autres facteurs de transcription et enzymes de modification des histones ainsi que dans le contrôle de la méthylation de l'ADN . Ils ont été découverts pour la première fois en 2002 en tant que facteurs capables de se lier à des sites cibles sur l'ADN nucléosomique dans la chromatine compactée et dotant la compétence pour l'activité génique au cours de l'hépatogenèse. Des facteurs pionniers sont impliqués dans l'initiation de la différenciation cellulaire et l'activation de gènes spécifiques à la cellule . Cette propriété est observée dans le domaine de repli des histones contenant des facteurs de transcription (fork head box (FOX) et NF-Y ) et d'autres facteurs de transcription qui utilisent des doigts de zinc pour la liaison à l'ADN (Groucho TLE, Gal4 et GATA).
La cellule eucaryote condense son génome en une chromatine et des nucléosomes très compacts . Cette capacité permet d'économiser de l'espace dans le noyau uniquement pour les gènes activement transcrits et empêche la transcription des gènes inutiles ou nuisibles. L'accès à ces régions condensées se fait par le remodelage de la chromatine en équilibrant les modifications des histones ou directement avec des facteurs pionniers qui peuvent relâcher la chromatine eux-mêmes ou en tant que drapeau recrutant d'autres facteurs. Les facteurs pionniers ne sont pas nécessairement requis pour l'assemblage de l'appareil de transcription et peuvent se dissocier après avoir été remplacés par d'autres facteurs.
Réarrangement actif

Les facteurs pionniers peuvent également affecter activement la transcription en ouvrant directement la chromatine condensée dans un processus indépendant de l'ATP. C'est un trait commun des facteurs de boîte de tête de fourche (qui contiennent un domaine de liaison à l'ADN en hélice ailée qui imite le domaine de liaison à l'ADN de l'histone de liaison H1) et NF-Y (dont les sous - unités NF-YB et NF-YC contiennent l'histone -fold domaines similaires à ceux des histones centrales H2A/H2B).
Facteurs de boîte de tête de fourche
La similitude avec l' histone H1 explique comment les facteurs de tête de fourche sont capables de se lier à la chromatine en interagissant avec le sillon principal du seul côté disponible de l'ADN enroulé autour d'un nucléosome. Les domaines de tête de fourche ont également une hélice qui confère une spécificité de séquence contrairement à l'histone de liaison. Le terminus C est associé à une mobilité plus élevée autour du nucléosome que l'histone de liaison, le déplaçant et réarrangeant efficacement les paysages nucléosomiques. Ce réarrangement actif des nucléosomes permet à d'autres facteurs de transcription de se lier à l'ADN disponible. Dans la différenciation des cellules thyroïdiennes, FoxE se lie à la chromatine compactée du promoteur de la peroxydase thyroïdienne et l'ouvre pour la liaison NF1 .
NF-Y
NF-Y est un complexe hétérotrimérique composé de sous - unités NF-YA , NF-YB et NF-YC . La caractéristique structurelle clé du complexe NF-Y/ADN est l'interaction mineure de sa sous - unité contenant le domaine de liaison à l'ADN NF-YA , qui induit une courbure d'environ 80° dans l'ADN. NF-YB et NF-YC interagissent avec l'ADN par le biais de contacts ADN-domaine à repliement histone non spécifiques. Le mode de liaison à l'ADN unique de NF-YA et les propriétés de liaison à l'ADN non spécifique de NF-YB/NF-YC imposent des contraintes spatiales suffisantes pour induire le glissement des nucléosomes flanquants vers l'extérieur, rendant ainsi accessibles les sites de reconnaissance à proximité pour d'autres facteurs de transcription.
Facteurs passifs

Les facteurs pionniers peuvent fonctionner de manière passive, en agissant comme un signet permettant à la cellule de recruter d'autres facteurs de transcription pour des gènes spécifiques dans la chromatine condensée. Cela peut être important pour amorcer la cellule pour une réponse rapide car l' amplificateur est déjà lié par un facteur de transcription pionnier lui donnant une longueur d'avance vers l'assemblage du complexe de pré-initiation de la transcription . Les réponses hormonales sont souvent induites rapidement dans la cellule en utilisant cette méthode d'amorçage comme avec le récepteur d'œstrogènes . Une autre forme d'amorçage est lorsqu'un activateur est simultanément lié par l'activation et la répression de facteurs pionniers. Cet équilibre peut être renversé par dissociation de l'un des facteurs. Dans la différenciation des cellules hépatiques, le facteur pionnier d'activation FOXA1 recrute un répresseur , grg3, qui empêche la transcription jusqu'à ce que le répresseur soit régulé à la baisse plus tard dans le processus de différenciation.
Dans un rôle direct, les facteurs pionniers peuvent se lier à un amplificateur et recruter un complexe d'activation qui modifiera directement la chromatine. Le changement de la chromatine modifie l'affinité, diminuant l'affinité du facteur pionnier de telle sorte qu'il est remplacé par un facteur de transcription qui a une affinité plus élevée. Il s'agit d'un mécanisme permettant à la cellule d'activer un gène qui a été observé avec des facteurs de modification de recrutement de récepteurs de glucocorticoïdes qui modifient ensuite le site pour se lier au récepteur d'œstrogène activé qui a été inventé comme un mécanisme « appât et commutateur ».
Effets épigénétiques
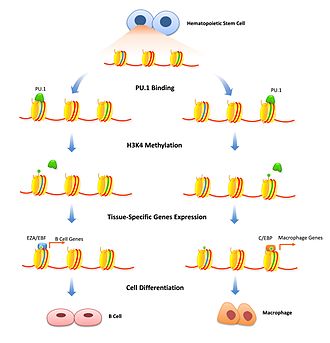
Les facteurs pionniers peuvent présenter leur plus grande gamme d'effets sur la transcription par la modulation de facteurs épigénétiques en recrutant des enzymes de modification des histones activant ou réprimant et en contrôlant la méthylation des CpG en protégeant des résidus de cystéine spécifiques . Cela a des effets sur le contrôle de la synchronisation de la transcription au cours des processus de différenciation cellulaire.
Modification des histones
La modification des histones est un mécanisme bien étudié pour ajuster de manière transitoire la densité de la chromatine. Des facteurs pionniers peuvent jouer un rôle à cet égard en liant des amplificateurs spécifiques et en signalant des enzymes de modification d'histone à ce gène spécifique. Des facteurs pionniers répressifs peuvent inhiber la transcription en recrutant des facteurs qui modifient les histones qui resserrent davantage la chromatine. Ceci est important pour limiter l'expression des gènes à des types cellulaires spécifiques et ne doit être supprimé que lorsque la différenciation cellulaire commence. FoxD3 a été associé en tant que répresseur des deux cellules B et cellules mélanocytaires voies de différenciation, en maintenant les modifications des histones répressives où liées, qui doivent être surmontés pour commencer la différenciation. Des facteurs pionniers peuvent également être associés au recrutement de modifications des histones activant la transcription. Les enzymes qui modifient H3K4 par mono et diméthylation sont associées à une transcription croissante et il a été démontré qu'elles se lient à des facteurs pionniers. Dans la différenciation des cellules B, PU.1 est nécessaire pour signaler des histones spécifiques pour activer les modifications H3K4me1 qui différencient les cellules souches hématopoïétiques en lignées de cellules B ou de macrophages. La liaison FoxA1 induit HSK4me2 lors de la différenciation neuronale des cellules souches pluripotentes ainsi que la perte de la méthylation de l'ADN.
méthylation de l'ADN
Les facteurs pionniers peuvent également affecter la transcription et la différenciation par le contrôle de la méthylation de l'ADN. Des facteurs pionniers qui se lient aux îlots CpG et aux résidus cytosine bloquent l'accès aux méthyltransférases. De nombreuses cellules eucaryotes ont des îlots CpG dans leurs promoteurs qui peuvent être modifiés par méthylation ayant des effets néfastes sur leur capacité à contrôler la transcription. Ce phénomène est également présent dans les promoteurs sans îlots CpG où les résidus cytosine uniques sont protégés de la méthylation jusqu'à une différenciation cellulaire ultérieure. Un exemple est FoxD3 empêchant la méthylation d'un résidu de cytosine dans l' amplificateur Alb1 , agissant comme un espace réservé pour FoxA1 plus tard dans les îlots de gènes hépatiques et CpG dans la leucémie lymphoïde chronique . Pour un contrôle stable de l'état de méthylation, les résidus de cytosine sont recouverts pendant la mitose , contrairement à la plupart des autres facteurs de transcription, pour empêcher la méthylation. Des études ont montré que pendant la mitose, 15 % de tous les sites de liaison interphase FoxA1 étaient liés. La protection de la méthylation de la cytosine peut être rapidement supprimée, ce qui permet une induction rapide lorsqu'un signal est présent.
Autres facteurs pionniers
Une famille de facteurs pionniers bien étudiée est celle des facteurs de transcription liés à Groucho (Gro/TLE/Grg) qui ont souvent un effet négatif sur la transcription. Ces domaines de liaison à la chromatine peuvent couvrir jusqu'à 3-4 nucléosomes. Ces grands domaines sont des échafaudages pour d'autres interactions protéiques et modifient également la chromatine pour d'autres facteurs pionniers tels que FoxA1 qui s'est avéré se lier à Grg3. Facteurs de transcription avec des domaines de liaison à l'ADN à doigt de zinc , tels que la famille GATA et le récepteur des glucocorticoïdes. Les domaines en doigt de zinc ne semblent pas bien se lier aux nucléosomes et peuvent être déplacés par des facteurs FOX.
Rôle dans le cancer
La capacité des facteurs pionniers à répondre aux signaux extracellulaires pour différencier le type cellulaire a été étudiée en tant que composant potentiel des cancers hormono-dépendants. Il a été démontré que des hormones telles que l' œstrogène et l' IGFI augmentent la concentration en facteur pionnier, entraînant un changement dans la transcription. Les facteurs pionniers connus tels que FOXA1, PBX1 , TLE, AP2 ɣ , GATA facteurs 2 / 3 / 4 , et PU.1 ont été associés à un cancer hormono-dépendant. FoxA1 est nécessaire pour l'hépatocarcinogenèse médiée par les œstrogènes et les androgènes et est un gène déterminant pour le cancer du sein ER + luminal, tout comme un autre facteur pionnier GATA3. FOXA1 est particulièrement exprimé dans 90 % des métastases du cancer du sein et 89 % des cancers métastatiques de la prostate. Dans la lignée cellulaire du cancer du sein, MCF-7 , il a été découvert que FoxA1 était lié à 50 % des sites de liaison aux récepteurs d'œstrogènes indépendamment de la présence d'œstrogènes. Une expression élevée de facteurs pionniers est associée à un mauvais pronostic, à l'exception du cancer du sein où FoxA1 est associé à un résultat plus élevé.
La corrélation entre facteurs pionniers et cancer a conduit à un ciblage thérapeutique prospectif. Dans les études de knockdown dans la lignée cellulaire de cancer du sein MCF-7 , il a été constaté que les facteurs pionnier baisse FOXA1 et AP2 ɣ a diminué la signalisation ER. D'autres protéines de la tête de fourche ont été associées au cancer, notamment FoxO3 et FoxM qui répriment les voies de survie cellulaire Ras et PPI3K/AKT/IKK. Des médicaments tels que le paclitaxel , l' imatinib et la doxorubicine qui activent FoxO3a ou ses cibles sont utilisés. La modification pour moduler les facteurs liés avec l'activité pionnière est un sujet d'intérêt dans les premiers stades, car la suppression des facteurs pionniers peut avoir des effets toxiques par l'altération des voies de la lignée des cellules saines.
