Cavité pleurale - Pleural cavity
| Cavité pleurale | |
|---|---|
 La cavité pleurale est l' espace potentiel entre les plèvres du sac pleural qui entoure chaque poumon.
| |
| Des détails | |
| Précurseur | coelome intra-embryonnaire |
| Identifiants | |
| Latin | cavum pleurae, cavum pleurale, cavitas pleuralis |
| Engrener | D035422 |
| TA98 | A07.1.01.001 |
| TA2 | 3316 |
| E | H3.05.03.0.00013 |
| FMA | 9740 |
| Terminologie anatomique | |
La cavité pleurale , l' espace pleural , ou espace interpleurale , est l' espace potentiel entre les plèvres du sac pleural qui entoure chaque poumon . Une petite quantité de liquide pleural séreux est maintenue dans la cavité pleurale pour permettre la lubrification entre les membranes , et aussi pour créer un gradient de pression .
La membrane séreuse qui recouvre la surface du poumon est la plèvre viscérale et est séparée de la membrane externe la plèvre pariétale par juste le film de liquide pleural dans la cavité pleurale. La plèvre viscérale suit les fissures du poumon et la racine des structures pulmonaires . La plèvre pariétale est attachée au médiastin , à la surface supérieure du diaphragme et à l'intérieur de la cage thoracique .
Structure
Chez l' homme , les poumons gauche et droit sont complètement séparés par le médiastin, et il n'y a aucune communication entre leurs cavités pleurales. Par conséquent, en cas de pneumothorax unilatéral , le poumon controlatéral continuera de fonctionner normalement à moins qu'il n'y ait un pneumothorax de tension , qui peut déplacer le médiastin et la trachée , plier les gros vaisseaux et éventuellement effondrer la circulation cardiopulmonaire controlatérale.
La plèvre viscérale reçoit son apport sanguin des capillaires parenchymateux du poumon sous-jacent, qui sont alimentés à la fois par la circulation pulmonaire et bronchique . La plèvre pariétale reçoit son apport sanguin de toutes les structures sous-jacentes, qui peuvent être ramifiées depuis l' aorte ( artères intercostales , phréniques supérieures et phréniques inférieures ), la thoracique interne ( branches péricardiacophréniques , intercostales antérieures et musculophréniques ), ou leur anastomose .
Les plèvres viscérales sont innervées par les nerfs splanchniques du plexus pulmonaire , qui innervent également les poumons et les bronches. Cependant, les plèvres pariétales, comme leurs approvisionnements en sang, reçoivent des approvisionnements nerveux de différentes sources. La plèvre costale (y compris la partie renflée au-dessus de l' entrée thoracique ) et la périphérie de la plèvre diaphragmatique sont innervées par les nerfs intercostaux de la cage thoracique enveloppante , qui se ramifie à partir de la moelle épinière thoracique T1-T12 . Les plèvres médiastinales et les parties centrales de la plèvre diaphragmatique sont innervées par les nerfs phréniques . qui bifurque le cordon cervical C3-C5 . Seules les plèvres pariétales contiennent des nerfs somatosensoriels et sont capables de percevoir la douleur .
Développement
Au cours de la troisième semaine d' embryogenèse , chaque mésoderme latéral se scinde en deux couches. La couche dorsale rejoint les somites sus-jacents et l' ectoderme pour former la somatopleure ; et la couche ventrale rejoint l' endoderme sous-jacent pour former la splanchnopleure . La déhiscence de ces deux couches crée une cavité remplie de liquide de chaque côté, et avec le repliement ventral et la fusion subséquente de la ligne médiane du disque trilaminaire , forme une paire de coelomes intra-embryonnaires antérolatéralement autour du tube intestinal au cours de la quatrième semaine, avec le splanchnopleure sur la paroi interne de la cavité et la somatopleure sur la paroi externe de la cavité.
L' extrémité crânienne des coelomes intra-embryonnaires fusionne tôt pour former une seule cavité, qui tourne à l'envers et descend apparemment devant le thorax, et est ensuite envahie par le cœur primordial en croissance en tant que cavité péricardique . Les parties caudales des coelomes fusionnent plus tard sous la veine ombilicale pour devenir la plus grande cavité péritonéale , séparée de la cavité péricardique par le septum transversal . Les deux cavités communiquent via une mince paire de coelomes résiduels adjacents à l' intestin antérieur supérieur appelé canal péricardiopéritonéal . Au cours de la cinquième semaine, les bourgeons pulmonaires en développement commencent à s'invaginer dans ces canaux, créant une paire de cavités qui s'agrandissent qui empiètent sur les somites environnants et déplacent davantage le septum transversal caudale, à savoir les cavités pleurales. Les mésothélies expulsés par les poumons en développement naissent de la splanchnopleure et deviennent les plèvres viscérales ; tandis que les autres surfaces mésothéliales des cavités pleurales proviennent de la somatopleure et deviennent les plèvres pariétales .
Le tissu séparant les cavités pleurales nouvellement formées de la cavité péricardique est connu sous le nom de membranes péricardio- pleurales , qui deviennent plus tard les parois latérales du péricarde fibreux . Le septum transversal et les somites déplacés fusionnent pour former les membranes pleuropéritonéales , qui séparent les cavités pleurales de la cavité péritonéale et deviennent plus tard le diaphragme .
Fonction
La cavité pleurale, avec ses plèvres associées, contribue au fonctionnement optimal des poumons pendant la respiration . La cavité pleurale contient également du liquide pleural, qui agit comme un lubrifiant et permet aux plèvres de glisser sans effort les unes contre les autres lors des mouvements respiratoires . La tension superficielle du liquide pleural conduit également à une apposition étroite des surfaces pulmonaires avec la paroi thoracique. Cette relation permet un plus grand gonflement des alvéoles pendant la respiration. La cavité pleurale transmet les mouvements des muscles des côtes aux poumons, en particulier lors d'une respiration lourde. Lors de l'inspiration, les intercostaux externes se contractent, tout comme le diaphragme . Cela provoque l'expansion de la paroi thoracique, ce qui augmente le volume des poumons. Une pression négative est ainsi créée et l'inhalation se produit.
Fluide pleural
Le liquide pleural est un liquide séreux produit par la membrane séreuse recouvrant la plèvre normale. La plupart des fluides sont produits par l'exsudation dans la circulation pariétale ( artères intercostales ) via le flux de masse et réabsorbés par le système lymphatique . Ainsi, le liquide pleural est produit et réabsorbé en continu. La composition et le volume sont régulés par les cellules mésothéliales de la plèvre. Chez un humain normal de 70 kg, quelques millilitres de liquide pleural sont toujours présents dans l'espace intrapleural. De plus grandes quantités de liquide ne peuvent s'accumuler dans l'espace pleural que lorsque le taux de production dépasse le taux de réabsorption. Normalement, le taux de réabsorption augmente en réponse physiologique à l'accumulation de liquide, le taux de réabsorption augmentant jusqu'à 40 fois le taux normal avant que des quantités importantes de liquide ne s'accumulent dans l'espace pleural. Ainsi, une augmentation profonde de la production de liquide pleural - ou un certain blocage du système lymphatique réabsorbant - est nécessaire pour que le liquide s'accumule dans l'espace pleural.
Circulation du liquide pleural
Le modèle d'équilibre hydrostatique, le modèle d'écoulement visqueux et le modèle d'équilibre capillaire sont les trois modèles hypothétiques de circulation du liquide pleural.
Selon le modèle d'écoulement visqueux, le gradient de pression intra pleural entraîne un écoulement visqueux descendant du liquide pleural le long des surfaces planes des côtes. Le modèle d'équilibre capillaire indique que la pression pleurale apicale négative élevée conduit à un gradient baso-apical au niveau de la surface pleurale médiastinale, conduisant à un écoulement de fluide dirigé vers l'apex (aidé par le cœur battant et la ventilation dans les poumons). Ainsi se produit la recirculation du fluide. Enfin, un flux transversal des marges à la partie plate des côtes complète la circulation du fluide.
L'absorption se fait dans les vaisseaux lymphatiques au niveau de la plèvre diaphragmatique.
Signification clinique
épanchement pleural
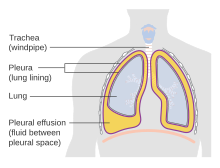
Une collection pathologique de liquide pleural s'appelle un épanchement pleural . Mécanismes :
- Obstruction lymphatique
- Augmentation de la perméabilité capillaire
- Diminution de la pression osmotique des colloïdes plasmatiques
- Augmentation de la pression veineuse capillaire
- Augmentation de la pression intrapleurale négative
Les épanchements pleuraux sont classés comme exsudatifs (riches en protéines) ou transsudatifs (faibles en protéines). Les épanchements pleuraux exsudatifs sont généralement causés par des infections telles que la pneumonie (épanchement pleural parapneumonique), une tumeur maligne, une maladie granulomateuse telle que la tuberculose ou la coccidioïdomycose, les maladies vasculaires du collagène et d'autres états inflammatoires. Les épanchements pleuraux transsudatifs surviennent dans l'insuffisance cardiaque congestive (ICC), la cirrhose ou le syndrome néphrotique.
L'épanchement pleural localisé observé au cours d'une embolie pulmonaire ( EP ) résulte probablement d'une augmentation de la perméabilité capillaire due à la libération de cytokines ou de médiateurs inflammatoires par les thrombus riches en plaquettes.
| Transsudation | Causes exsudatives |
|---|---|
| * Insuffisance cardiaque congestive (ICC) | * Malignité
|
Analyse du liquide pleural
Lorsqu'une accumulation de liquide pleural est notée, une évaluation cytopathologique du liquide, ainsi que la microscopie clinique, la microbiologie, les études chimiques, les marqueurs tumoraux, la détermination du pH et d'autres tests plus ésotériques sont nécessaires comme outils de diagnostic pour déterminer les causes de cette accumulation anormale. Même l'apparence grossière, la couleur, la clarté et l'odeur peuvent être des outils utiles pour le diagnostic. La présence d'une insuffisance cardiaque, d'une infection ou d'une tumeur maligne dans la cavité pleurale sont les causes les plus courantes pouvant être identifiées à l'aide de cette approche.
Aspect brut
- Clair de couleur paille : Si transsudatif, aucune autre analyse n'est nécessaire. Si exsudatif, des études supplémentaires sont nécessaires pour déterminer la cause (cytologie, culture, biopsie).
- Nuageux, purulent, trouble : Infection, empyème, pancréatite, malignité.
- Rose à rouge/sanglante : ponction traumatique, malignité, infarctus pulmonaire, infarctus intestinal, pancréatite, traumatisme.
- Blanc-vert, trouble : Polyarthrite rhumatoïde avec épanchement pleural.
- Vert-brun : maladie biliaire, perforation intestinale avec ascite.
- Blanc laiteux ou jaune et sanglant : épanchement chyleux.
- Laiteux ou vert, reflets métalliques : épanchement pseudochyle.
- Visqueux (hémorragique ou clair) : mésothéliome.
- Pâte d'anchois (ou 'sauce au chocolat'): Abcès amibien du foie rompu.
Aspect microscopique
La microscopie peut montrer des cellules résidentes (cellules mésothéliales, cellules inflammatoires) d'étiologie bénigne ou maligne. Une évaluation par un cytopathologiste est alors réalisée et un diagnostic morphologique peut être posé. Les neutrophiles sont nombreux dans l' empyème pleural . Si les lymphocytes prédominent et les cellules mésothéliales sont rares, cela suggère une tuberculose. Les cellules mésothéliales peuvent également être diminuées en cas de pleurésie rhumatoïde ou de pleurésie post-pleurodèse. Les éosinophiles sont souvent observés si un patient a récemment subi une ponction pleurale antérieure. Leur importance est limitée.
Si des cellules malignes sont présentes, un pathologiste peut effectuer des études supplémentaires, y compris l' immunohistochimie, pour déterminer l'étiologie de la malignité.
Analyse chimique
Des études chimiques peuvent être effectuées, y compris le pH, le rapport liquide pleural/protéine sérique, le rapport LDH, la densité, les taux de cholestérol et de bilirubine. Ces études peuvent aider à clarifier l'étiologie d'un épanchement pleural (exsudatif vs transsudatif). L'amylase peut être élevée dans les épanchements pleuraux liés à des perforations gastriques/œsophagiennes, une pancréatite ou une tumeur maligne. Les épanchements pleuraux sont classés comme exsudatifs (riches en protéines) ou transsudatifs (faibles en protéines).
Malgré tous les tests diagnostiques disponibles aujourd'hui, de nombreux épanchements pleuraux restent d'origine idiopathique . Si des symptômes graves persistent, des techniques plus invasives peuvent être nécessaires. Malgré le manque de connaissance de la cause de l'épanchement, un traitement peut être nécessaire pour soulager le symptôme le plus courant, la dyspnée , car cela peut être assez invalidant. La thoracoscopie est devenue le pilier des procédures invasives alors que la biopsie pleurale fermée est tombée en désuétude.
Maladie
Les maladies de la cavité pleurale comprennent :
- Pneumothorax : une collection d'air dans la cavité pleurale
- Épanchement pleural : une accumulation de liquide dans l'espace pleural.
- Tumeurs pleurales : excroissances anormales sur la plèvre.
Les références
Sources
- Lumière, Richard W. (2007). Maladies pleurales . Lippincott Williams & Wilkins. ISBN 978-0781769570.
Liens externes
- Photo de dissection sur kenyon.edu
