Polyphosphate - Polyphosphate
Les polyphosphates sont des sels ou des esters d' oxyanions polymères formés à partir d' unités structurales tétraédriques PO 4 ( phosphate ) liées entre elles en partageant des atomes d'oxygène. Les polyphosphates peuvent adopter des structures cycliques linéaires ou cycliques. En biologie, les esters polyphosphates ADP et ATP sont impliqués dans le stockage d'énergie. Une variété de polyphosphates trouve une application dans la séquestration minérale dans les eaux municipales, étant généralement présents à 1 à 5 ppm. GTP , CTP et UTP sont également des nucléotides importants dans la synthèse des protéines, la synthèse des lipides et le métabolisme des glucides, respectivement. Les polyphosphates sont également utilisés comme additifs alimentaires , marqués E452 .
Structure
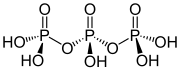
Structure de l' acide triphosphorique
Adénosine diphosphate (ADP)
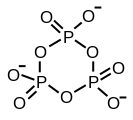
La structure de l'acide tripolyphosphorique illustre les principes qui définissent les structures des polyphosphates. Il se compose de trois unités tétraédriques PO 4 reliées entre elles en partageant des centres d'oxygène. Pour les chaînes linéaires, les groupes phosphore d'extrémité partagent un oxyde et les autres centres phosphorés partagent deux centres d'oxyde. Les phosphates correspondants sont liés aux acides par perte des protons acides . Dans le cas du trimère cyclique, chaque tétraèdre partage deux sommets avec des tétraèdres adjacents.
Le partage des trois coins est possible. Ce motif représente la réticulation du polymère linéaire. Les polyphosphates réticulés adoptent la structure en feuillets phyllosilicates , mais de telles structures n'apparaissent que dans des conditions extrêmes.
Formation et synthèse
Les polyphosphates résultent de la polymérisation de dérivés d'acide phosphorique. Le processus commence par la réunion de deux unités de phosphate dans une réaction de condensation.
- 2 H(PO 4 ) 2− (P 2 O 7 ) 4− + H 2 O
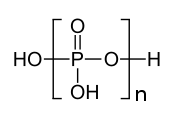
La condensation est représentée comme un équilibre car la réaction inverse, l' hydrolyse , est également possible. Le processus peut se poursuivre par étapes ; à chaque étape, une autre unité (PO 3 ) − est ajoutée à la chaîne, comme indiqué par la partie entre parenthèses dans l'illustration de l'acide polyphosphorique. P 4 O 10 peut être considéré comme le produit final des réactions de condensation, où chaque tétraèdre partage trois coins avec les autres. Inversement, un mélange complexe de polymères est produit lorsqu'une petite quantité d'eau est ajoutée au pentoxyde de phosphore.
Propriétés acido-basiques et de complexation
Les polyphosphates sont des bases faibles . Une seule paire d'électrons sur un atome d'oxygène peut être donnée à un ion hydrogène (proton) ou à un ion métallique dans une interaction acide de Lewis - base de Lewis typique . Cela a une signification profonde en biologie. Par exemple, l'adénosine triphosphate est protonée à environ 25 % en solution aqueuse à pH 7.
- ATP 4− + H + ATPH 3− , p K a 6,6
Une protonation supplémentaire se produit à des valeurs de pH inférieures.
La liaison phosphate "haute énergie"
L'ATP forme des complexes de chélate avec les ions métalliques. La constante de stabilité pour l'équilibre
- ATP 4− + Mg 2+ ⇌ MgATP 2− , log β 4
est particulièrement grand. La formation du complexe de magnésium est un élément critique dans le processus d'hydrolyse de l'ATP, car il affaiblit le lien entre le groupe phosphate terminal et le reste de la molécule.
L'énergie libérée lors de l'hydrolyse de l'ATP,
- ATP 4− + H 2 O → ADP 3− + P i −
à ΔG -36,8 kJ mol -1 est grand par rapport aux normes biologiques. P i signifie phosphate inorganique, qui est protoné au pH biologique. Cependant, il n'est pas grand par rapport aux normes inorganiques. Le terme "haute énergie" fait référence au fait qu'elle est élevée par rapport à la quantité d'énergie libérée dans les réactions chimiques organiques qui peuvent se produire dans les systèmes vivants.
Polyphosphates inorganiques à haute teneur en polymères
Les polyphosphates de haut poids moléculaire sont bien connus. Un dérivé est le sel de Graham vitreux (c'est-à-dire amorphe) . Les polyphosphates cristallins de poids moléculaire élevé comprennent le sel de Kurrol et le sel de Maddrell. Ces espèces ont la formule [NaPO 3 ] n [NaPO 3 (OH)] 2 où n peut aller jusqu'à 2000. En termes de structures, ces polymères sont constitués de PO 3 − "monomères", dont les chaînes sont terminées par phosphates protonés.
Dans la nature
Des polyphosphates inorganiques à haute teneur en polymères ont été trouvés dans des organismes vivants par L. Liberman en 1890. Ces composés sont des polymères linéaires contenant quelques à plusieurs centaines de résidus d' orthophosphate liés par des liaisons phosphoanhydrides riches en énergie .
Auparavant, il était considéré soit comme un « fossile moléculaire », soit comme une seule source de phosphore et d'énergie assurant la survie des micro-organismes dans des conditions extrêmes. Ces composés sont maintenant connus pour avoir également des rôles régulateurs et pour se produire dans des représentants de tous les règnes d'organismes vivants, participant à la correction et au contrôle métaboliques aux niveaux génétique et enzymatique. Le polyphosphate est directement impliqué dans le basculement du programme génétique caractéristique du stade exponentiel de croissance des bactéries vers le programme de survie cellulaire en conditions stationnaires, « une vie dans la voie lente ». Ils participent à de nombreux mécanismes de régulation intervenant chez les bactéries :
- Ils participent à l'induction de rpoS , une sous-unité d'ARN-polymérase qui est responsable de l'expression d'un large groupe de gènes impliqués dans les ajustements de la phase de croissance stationnaire et de nombreux agents stressants.
- Ils sont importants pour la motilité cellulaire, la formation de biofilms et la virulence.
- Les polyphosphates et les exopolyphosphatases participent à la régulation des niveaux du facteur de réponse stringente, la guanosine 5'-diphosphate 3'-diphosphate (ppGpp), un second messager dans les cellules bactériennes.
- Les polyphosphates participent à la formation de canaux à travers les membranes cellulaires vivantes. Les canaux ci-dessus formés par le polyphosphate et le poly-b-hydroxybutyrate avec Ca 2+ sont impliqués dans les processus de transport dans une variété d'organismes.
- Une fonction importante du polyphosphate dans les micro-organismes - les procaryotes et les eucaryotes inférieurs - est de gérer les conditions environnementales changeantes en fournissant des réserves de phosphate et d'énergie. Les polyphosphates sont présents dans les cellules animales et il existe de nombreuses données sur leur participation aux processus de régulation au cours du développement et de la prolifération et de la différenciation cellulaires, en particulier dans les tissus osseux et le cerveau.
Chez l'homme, il a été démontré que les polyphosphates jouent un rôle clé dans la coagulation du sang . Produites et libérées par les plaquettes, elles activent le facteur XII de coagulation sanguine qui est essentiel à la formation de caillots sanguins. Le facteur XII, également appelé facteur Hageman, initie la formation de fibrine et la génération d'un médiateur pro-inflammatoire, la bradykinine , qui contribue à la fuite des vaisseaux sanguins et à la thrombose. Les polyphosphates d'origine bactérienne altèrent la réponse immunitaire de l'hôte pendant l'infection et le ciblage des polyphosphates avec l'exopolyphosphatase recombinante améliore la survie au sepsis chez la souris. Les polyphosphates inorganiques jouent un rôle crucial dans la tolérance des cellules de levure aux cations toxiques de métaux lourds.
Utilisation comme additifs alimentaires
Le polyphosphate de sodium (E452(i)), le polyphosphate de potassium (E452(ii)), le polyphosphate de sodium et de calcium (E452(iii)) et le polyphosphate de calcium (E452(iv)) sont utilisés comme additifs alimentaires. Ils ne sont pas connus pour présenter un risque potentiel pour la santé autre que ceux généralement attribués à d'autres sources de phosphate (y compris ceux naturellement présents dans les aliments). Bien que des inquiétudes aient été exprimées concernant les effets néfastes sur les os et les maladies cardiovasculaires, ainsi que l' hyperphosphatémie , celles-ci ne semblent être pertinentes que pour une consommation exagérée de sources de phosphate. Au total, une consommation raisonnable (jusqu'à 40 mg de phosphate par kg de poids corporel par jour) semble ne présenter aucun risque pour la santé.
Voir également
Les références
Liens externes
- Pavlov E, Grimbly C, Diao CT, RJ français (septembre 2005). "Un mode de haute conductance d'un canal poly-3-hydroxybutyrate/calcium/polyphosphate isolé à partir de cellules Escherichia coli compétentes" . FEBS Lett . 579 (23): 5187-92. doi : 10.1016/j.febslet.2005.08.032 . PMID 16150446 . S2CID 35616647 .
- Koulaev I, Vagabov V, Kulakovskaya T (1999). « Nouveaux aspects du métabolisme et de la fonction des polyphosphates inorganiques ». J. Biosci. Bioeng . 88 (2) : 111–29. doi : 10.1016/S1389-1723(99)80189-3 . PMID 16232585 .
- Koulaev I, Koulakovskaya T (2000). "Pompe à polyphosphate et phosphate". Annu. Rév . Microbiol . 54 : 709–34. doi : 10.1146/annurev.micro.54.1.709 . PMID 11018142 .