Pom1 - Pom1
| Pom1 | |
|---|---|
| Identifiants | |
| Organisme | |
| symbole | SPAC2F7.03c |
| Entrez | 2541889 |
Pom1 est une protéine kinase de polarité dans la levure de fission, Schizosaccharomyces pombe ( S. pombe ), qui se localise aux extrémités des cellules et régule la division cellulaire. À mesure que la cellule s'allonge, le niveau de Pom1 au milieu diminue, ce qui déclenche la mitose.
Le gène pom1 code pour une protéine longue de 1087 acides aminés avec le domaine de la protéine kinase probablement situé à l'extrémité carboxyle. Pom1 régule une voie de signalisation qui comprend Cdk1 et régule finalement l'entrée mitotique . Les cellules avec pom1 mutant forment une cloison et une zone de croissance, mais présentent une foule d'anomalies, notamment des cloisons mal placées ou mal orientées, une croissance bipolaire remplacée par une croissance aléatoire à une extrémité ou une mauvaise localisation de l'axe de croissance conduisant à une ramification anormale.
Pom1 joue un rôle important dans la différenciation de l'ancienne et de la nouvelle extrémité d'une cellule de S. pombe . La croissance cellulaire normale commence immédiatement à l'ancienne extrémité de la cellule et est retardée à la nouvelle extrémité. Les mutants pom1 montrent une croissance immédiate aux deux extrémités. Puisqu'il a été démontré que Pom1 est très concentré à la nouvelle extrémité et presque absent de l'ancienne extrémité, il, avec d'autres facteurs, fait partie d'un signal inhibiteur qui empêche la croissance immédiate de la nouvelle extrémité. La surexpression de Pom1 peut également conduire à la formation de nouvelles extrémités de croissance.
Pom1 est une protéine kinase relativement unique car son homologue le plus proche chez S. pombe n'est identique qu'à 55%. Les homologues d'autres organismes comprennent Dyrk chez le rat, Dyrk2 et Dyrk3 chez l'homme, Yak1p chez S. cerevisiae et Minibrain chez la drosophile et l'homme.
Localisation cellulaire
Pendant l' interphase , Pom1 réside dans toute la cellule, y compris les nœuds corticaux médiaux. La localisation de Pom1 aux pôles pendant la division cellulaire est régulée par Tea1 et Tea2. En l'absence de Tea1 et Tea2, Pom1 maintient son activité kinase , mais ne se localise pas aux extrémités cellulaires. Les microtubules aident également à localiser Pom1 dans la cellule car il a été démontré que la délocalisation de Pom1 résulte du démontage des microtubules . Structurellement, les régions catalytiques et non catalytiques de Pom1 sont nécessaires pour la localisation de l'extrémité cellulaire.
Les protéines Cdr2, Cdr1, Wee1 , Mid1 et Blt1 sont également situées au nœud médial pendant l' interphase et sont censées faire partie de la voie de signalisation pour l'entrée mitotique. La localisation de Cdr2 vers le milieu de la cellule est régulée par l'expression de Pom1 et d'autres signaux car les mutants de pom1 permettent à Cdr2 de diffuser de la localisation du nœud médial vers la moitié de la cellule.
Taille de cellule et gradient spatial
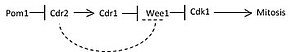
Pom1 forme un gradient spatial à mesure que les cellules s'allongent tout au long de la phase G2 . La figure 1 illustre sous forme de dessin animé le gradient de Pom1 (représenté par l'ombrage sombre) à travers d'abord une cellule relativement petite pendant l' interphase et une cellule allongée passant par la phase G2 . Au fur et à mesure que les cellules s'allongent, la concentration de Pom1 culmine aux deux pôles et diminue vers le centre de la cellule. Cdr2 lit le signal inhibiteur décroissant à partir du gradient de concentration de Pom1 et active Cdr1 et Blt1 qui ont été localisés au nœud médian en raison du recrutement de Cdr2. Cdr1 phosphoryle et inhibe alors Wee1 , également recruté au nœud médial par la présence de Cdr2. Le Wee1 phosphorylé permet à Cdc25 de déphosphoryler Cdk1 et de faire passer la cellule en mitose . La figure 2 illustre une voie de signalisation simplifiée pour l'entrée mitotique dépendante de la taille basée sur ce modèle. L'inhibition de Wee1 directement par Cdr2 indiquée par la ligne en pointillé n'a pas encore été confirmée.
Tests du modèle Pom1
Il a été montré que Pom1 marqué par GFP crée un gradient dans les cellules allongées comme caractérisé sur la figure 1. Selon la figure 2, la diminution de Pom1 à l'emplacement de Cdr2 dans le nœud médian diminue l'inhibition de Cdr2. Pour confirmer l'interaction de ce modèle, les résultats montrent que les cellules avec Pom1 délocalisé qui conservent la pleine activité kinase des mutants tea1 retardent l'entrée mitotique. Cela est probablement dû à l'inhibition continue de Cdr2. D'autres expériences qui localisaient ectopiquement Pom1 dans tout le cortex ont également montré une entrée mitotique retardée équivalente à un knockdown cdr2 suggérant une fois de plus que Pom1 inhibe Cdr2 et que Pom1 diminue avec l'élongation cellulaire, Cdr2 commence une voie de signalisation pour inhiber Wee1 et finalement entrer en mitose .
La recherche future
On ne sait toujours pas si Cdr2 inhibe directement Wee1 ou s'il n'agit qu'indirectement via Cdr1 ou d'autres kinases . De plus, Blt1, également localisé au niveau du nœud médial, peut jouer un rôle dans la régulation de l'entrée mitotique. Les mutants Blt1 montrent une longueur accrue compatible avec une entrée mitotique retardée. Bien qu'actuellement non confirmé, il est supposé que Blt1 agit en inhibant Wee1 .
Les références
- ^ a b c d e f Bahler, J., et Pringle, JR "Pom1p, une protéine kinase de levure de fission qui fournit des informations de position pour la croissance polarisée et la cytokinèse." Genes and Development 12, 1356-1370 (1998).
- ^ a b c d e f g h i j k Moseley, JB, Mayeux, A., Paoletti, A. et Nurse, P. "Un gradient spatial coordonne la taille des cellules et l'entrée mitotique dans la levure de fission." Nature 459, 857-861 (2009).
- ^ a b c d e Bahler, J., et Nurse, P. "L'activité de la levure de fission Pom1p kinase est régulée par le cycle cellulaire et essentielle pour la symétrie cellulaire pendant la croissance et la division." The EMBO Journal 20, 1064-1073 (2001).
- ^ Souza, GM, Lu, S. et Kuspa, A. «YakA, une protéine kinase nécessaire pour la transition de la croissance au développement dans Dictyostelium. Development 125, 2291-2302 (1998).
- ^ Tejedor, F., Zhu, XR, Kaltenbach, E., Ackermann, A., Baumann, A., Canal, I., Heisenberg, M., Fischbach, KF et Pongs, O. «Minibrain: Une nouvelle protéinefamille kinase impliquée dans la neurogenèse post-embryonnaire chez la drosophile. Neuron 14, 287 à 301 (1995).
- ^ Browning, H., Hayles, J., Mata, J., Aveline, L., Nurse, P. et McIntosh, JR "Tea2p est une protéine de type kinésine nécessaire pour générer une croissance polarisée dans la levure de fission." The Journal of Cell Biology 151, 15-27 (2000).
- ^ a b Behrens, R., et l'infirmière, P. "Rôles de la levure de fission tea1p dans la localisation des facteurs de polarité et dans l'organisation du cytosquelette microtubulaire." The Journal of Cell Biology 157, 783-793 (2002).
- ^ Morrell, JL, Nichols, CB et Gould, KL «La kinase de la famille GIN4, Cdr2p, agit indépendamment des septines dans la levure de fission. The Journal of Cell Science 117, 5293-5302 (2004).