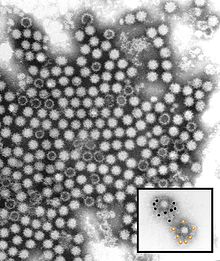
Maladie hémorragique du lapin - Rabbit hemorrhagic disease
| Virus de la maladie hémorragique du lapin | |
|---|---|
|
|
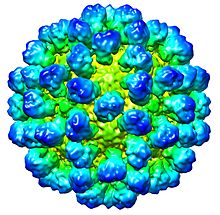
| Reconstruction cryoEM de la capside du virus . Entrée EMDB EMD-1933 | |
|
Classification des virus |
|
| (non classé): | Virus |
| Royaume : | Ribovirie |
| Royaume: | Orthornavire |
| Phylum: | Pisuviricota |
| Classer: | Pisoniviricètes |
| Commander: | Picornavirales |
| Famille: | Caliciviridae |
| Genre: | Lagovirus |
| Espèce: |
Virus de la maladie hémorragique du lapin
|
| Isole | |
|
|
| Synonymes | |
|
|
La maladie hémorragique du lapin ( RHD ), également connue sous le nom de maladie hémorragique virale (VHD), est une forme hautement infectieuse et mortelle d'hépatite virale qui affecte les lapins européens . Certaines souches virales affectent également les lièvres et les lapins à queue blanche. Les taux de mortalité varient généralement de 70 à 100 pour cent. La maladie est causée par des souches du virus de la maladie hémorragique du lapin ( RHDV ), un lagovirus de la famille des Caliciviridae .
Virus de la maladie hémorragique du lapin
Le virus de la maladie hémorragique du lapin (RHDV) est un virus du genre Lagovirus et de la famille des Caliciviridae . Il s'agit d'un virus non enveloppé d'un diamètre d'environ 35 à 40 nm, d'une symétrie icosaédrique et d'un génome à ARN linéaire de sens positif de 6,4 à 8,5 kb. Le RHDV provoque une infection généralisée chez le lapin qui se caractérise par une nécrose du foie, une coagulation intravasculaire disséminée et une mort rapide. La division en sérotypes a été définie par un manque de neutralisation croisée à l'aide d'antisérums spécifiques. Les lagovirus du lapin comprennent également des calicivirus apparentés tels que le virus du syndrome du lièvre brun européen .
Le RHDV semble avoir évolué à partir d'un calicivirus de lapin avirulent (RCV) préexistant. Des calicivirus de lapin non pathogènes apparentés au RHDV, mais distincts du RHDV, avaient circulé, apparemment sans danger, en Europe, en Australie et en Nouvelle-Zélande avant l'émergence du RHDV. Au cours de son évolution, le RHDV s'est divisé en six génotypes distincts, tous hautement pathogènes.
Les trois souches du virus de la maladie hémorragique du lapin d'importance médicale sont RHDV, RHDVa et RHDV2. Le RHDV (également appelé RHDV, RHDV1 ou RHD classique) n'affecte que les lapins européens adultes ( Oryctolagus cuniculus ). Ce virus a été signalé pour la première fois en Chine en 1984, d'où il s'est propagé dans une grande partie de l'Asie, de l'Europe, de l'Australie et d'ailleurs. Quelques foyers isolés de RHDV se sont produits aux États-Unis et au Mexique, mais ils sont restés localisés et ont été éradiqués.
En 2010, un nouveau lagovirus au profil antigénique distinct a été identifié en France. Le nouveau virus, nommé virus de la maladie hémorragique du lapin 2 (en abrégé RHDV2 ou RHDVb), a également causé la RHD, mais a présenté des caractéristiques génétiques, antigéniques et pathogènes distinctives. Il est important de noter que RHDV2 a tué des lapins préalablement vaccinés avec des vaccins RHDV et a affecté de jeunes lapins européens, ainsi que des lièvres ( Lepus spp.). Toutes ces caractéristiques suggèrent fortement que le virus n'était pas dérivé de RHDVa, mais d'une autre source inconnue. RHDV2 s'est depuis répandu dans la majorité de l'Europe, ainsi qu'en Australie, au Canada et aux États-Unis.
Épidémiologie et transmission
Les deux virus causant la RHD sont extrêmement contagieux. La transmission se fait par contact direct avec des animaux infectés, des carcasses, des fluides corporels (urine, fèces, sécrétions respiratoires) et des cheveux. Les lapins survivants peuvent être contagieux jusqu'à 2 mois. Les objets contaminés tels que les vêtements, la nourriture, les cages, la literie, les mangeoires et l'eau propagent également le virus. Les mouches, les puces et les moustiques peuvent transmettre le virus entre les lapins. Les prédateurs et les charognards peuvent également propager le virus en l'excrétant dans leurs selles. Les calicivirus sont très résistants dans l'environnement et peuvent survivre au gel pendant des périodes prolongées. Le virus peut persister dans la viande infectée pendant des mois et pendant des périodes prolongées dans les carcasses en décomposition. L'importation de viande de lapin peut être un contributeur majeur à la propagation du virus vers de nouvelles régions géographiques.
Les épidémies de RHD ont tendance à être saisonnières dans les populations de lapins sauvages, où la plupart des adultes ont survécu à l'infection et sont immunisés. Au fur et à mesure que les jeunes chatons grandissent et cessent d'allaiter, ils ne reçoivent plus les anticorps contenus dans le lait de leur mère et deviennent sensibles à l'infection. Ainsi, les épizooties RHD surviennent plus souvent pendant la saison de reproduction des lapins.
En général, il existe une spécificité d'hôte élevée parmi les lagovirus. Le RHDVa classique n'affecte que les lapins européens, une espèce originaire d'Europe et dont descend le lapin domestique. La nouvelle variante RHDV2 affecte également les lapins européens, mais provoque également une RHD mortelle chez diverses espèces de Lepus , notamment les lièvres sardes du Cap ( L. capensis mediterraneus ), les lièvres italiens ( L. corsicanus ) et les lièvres variables ( L. timidus ). Des rapports de RHD chez les espèces de Sylvilagus proviennent de l'épidémie actuelle aux États-Unis.
La RHD causée par RHDV et RHDVa montre une morbidité élevée (jusqu'à 100 %) et une mortalité (40 à 100 %) chez les lapins européens adultes. Les jeunes lapins âgés de 6 à 8 semaines sont moins susceptibles d'être infectés et les chatons de moins de 4 semaines ne tombent pas malades. Le plus récent RHDV2 provoque la mort et la maladie chez des lapins aussi jeunes que 15 jours. Les taux de mortalité de RHDV2 sont plus variables à 5-70%. Initialement moins virulente, la pathogénicité de RHDV2 a augmenté et est maintenant similaire à celle trouvée avec RHDV et RHDVa. Des décès par RHDV2 ont été confirmés chez des lapins préalablement vaccinés contre RHDVa.
Physiopathologie
Les deux souches virales de RHDV se répliquent dans le foie, provoquant une nécrose hépatique et une insuffisance hépatique, qui peuvent à leur tour entraîner une coagulation intravasculaire disséminée , une encéphalopathie hépatique et une néphrose . Des saignements peuvent survenir, car les facteurs de coagulation et les plaquettes sont épuisés.
Signes cliniques
La maladie hémorragique du lapin provoque une hépatite. La période d'incubation du RHDVa est de 1 à 2 jours et celle du RHDV2 de 3 à 5 jours. Les lapins infectés par RHDV2 sont plus susceptibles de présenter des signes subaigus ou chroniques que ceux infectés par RHDVa. Dans les élevages de lapins, une épidémie avec des taux de mortalité élevés chez les lapins adultes et subadultes est typique. Si l'épidémie est causée par le RHDV2, des décès surviennent également chez les jeunes lapins.
La RHD peut varier dans la fréquence à laquelle les signes cliniques surviennent. Dans les cas suraigus, les lapins sont généralement retrouvés morts sans symptômes prémonitoires. Les lapins peuvent être observés en train de brouter normalement juste avant leur mort.
Dans les cas aigus, les lapins sont inactifs et réticents à se déplacer. Ils peuvent développer de la fièvre jusqu'à 42 °C (107,6 °F) et avoir une fréquence cardiaque et respiratoire accrue. Des écoulements sanglants du nez, de la bouche ou de la vulve sont fréquents, tout comme le sang dans les selles ou l'urine. Un décubitus latéral, un coma et des convulsions peuvent être observés avant la mort. Les lapins atteints de la forme aiguë meurent généralement dans les 12 à 36 heures suivant l'apparition de la fièvre.
La RHD subaiguë à chronique a une évolution clinique plus longue et est plus fréquemment observée avec les infections à RHDV2. Les signes cliniques incluent la léthargie, l'anorexie, la perte de poids et la jaunisse . Une dilatation gastro-intestinale, des arythmies cardiaques , des souffles cardiaques et des anomalies neurologiques peuvent également survenir. La mort, si elle survient, survient généralement 1 à 2 semaines après le début des symptômes et est due à une insuffisance hépatique.
Tous les lapins exposés au RHDVa ou au RHDV2 ne tombent pas ouvertement malades. Une petite proportion de lapins infectés élimine le virus sans développer de signes de maladie. Des porteurs asymptomatiques sont également présents et peuvent continuer à excréter le virus pendant des mois, infectant ainsi d'autres animaux. Les lapins survivants développent une forte immunité contre la variante virale spécifique avec laquelle ils ont été infectés.
Diagnostic
Un diagnostic présomptif de RHD peut souvent être posé sur la base de la présentation clinique, du schéma d'infection au sein d'une population et des lésions post mortem . Le diagnostic définitif nécessite la détection du virus. Comme la plupart des calicivirus ne peuvent pas être cultivés en culture cellulaire, des méthodes moléculaires et sérologiques de détection virale sont souvent utilisées.
La numération globulaire complète des lapins atteints de RHD montre souvent de faibles niveaux de globules blancs et de plaquettes, et les panels de chimie montrent des enzymes hépatiques élevées. Des signes d'insuffisance hépatique peuvent également être présents, notamment une augmentation des acides biliaires et de la bilirubine, et une diminution du glucose et du cholestérol. Des temps de prothrombine prolongés et de thromboplastine partielle activée sont typiques. L'analyse d'urine peut montrer une bilirubinurie, une protéinurie et une GGT urinaire élevée.
La lésion post mortem classique observée chez les lapins atteints de RHD est une nécrose hépatique étendue et une jaunisse. Des hémorragies multifocales, une splénomégalie, une bronchopneumonie, une hémorragie ou un œdème pulmonaire et une nécrose myocardique peuvent également être observées.
Divers tests moléculaires peuvent être utilisés pour identifier les virus RHD. Les tests de réaction en chaîne par polymérase de transcription inverse sont une modalité de test précise et couramment utilisée pour les virus. Les autres tests utilisés comprennent le dosage immunoenzymatique , la microscopie électronique , l' immunocoloration , le transfert Western et l' hybridation in situ . Le tissu de choix pour les tests moléculaires est le foie frais ou congelé, car il contient généralement le plus grand nombre de virus, mais si cela n'est pas disponible, la rate et le sérum peuvent également être utilisés. L'identification de la souche de RHDV est nécessaire afin que les protocoles de vaccination puissent être ajustés en conséquence.
Prévention et contrôle
Vaccins
Un certain nombre de vaccins disponibles contre la RHD sont vendus dans les pays où la maladie est endémique. Tous offrent une protection de 12 mois contre les virus RHD. Étant donné que les virus RHD ne peuvent normalement pas être cultivés in vitro , la façon dont ces vaccins sont produits est affectée. Les vaccins RHD inactivés, y compris Eravac, Felavac et Cylap, sont « dérivés du foie », ce qui signifie que les lapins de laboratoire sont intentionnellement infectés par le RHD et que leurs foies et leur rate sont prélevés pour fabriquer des vaccins. Chaque lapin utilisé entraîne la production de milliers de doses de vaccin. Cela a suscité une controverse parmi les amateurs de lapins, qui remettent en question l'éthique de certains lapins devant mourir pour protéger les autres, mais ce n'est pas un problème lorsque les lapins sont principalement élevés pour la viande. Une autre méthode de reproduction du virus est la technologie de recombinaison, où des portions antigéniques des virus RHD sont insérées dans des virus qui peuvent être cultivés en culture. C'est la méthode utilisée pour créer Nobivac Myxo-RHD PLUS.
Les vaccins contre uniquement la souche RHDVa classique sont : Le vaccin Cylap RCD, fabriqué par Zoetis, protège les lapins de deux souches différentes de RHDVa (v351 et K5) qui sont utilisées pour le contrôle des lapins sauvages en Australie. CUNIPRAVAC RHD®, fabriqué par HIPRA, protège contre les souches RHDVa présentes en Europe. Nobivac Myxo-RHD, fabriqué par MSD Animal Health, est un vaccin vivant à vecteur de myxome qui offre une durée d'immunité d'un an contre la RHDVa et la myxomatose .
Les vaccins contre la souche RHDV2 la plus récente sont les suivants : Le vaccin Eravac, fabriqué par HIPRA, protège les lapins contre RHDV2 pendant un an.
Les vaccins qui protègent à la fois contre les souches RHDVa et RHDV2 comprennent : Filavac VHD K C+V, fabriqué par Filavie, protège à la fois contre le RHDVa classique et le RHDV-2. Il est disponible en flacons unidoses et multidoses. Un vaccin bientôt commercialisé par MSD Animal Health, Nobivac Myxo-RHD PLUS, est un vaccin vivant à vecteur recombinant actif contre RHDVa et RHDV2, ainsi que contre la myxomatose.
Les pays dans lesquels la RHD n'est pas considérée comme endémique peuvent imposer des restrictions à l'importation de vaccins contre la RHDV. L'importation de ces vaccins aux États-Unis ne peut se faire qu'avec l'approbation du ministère de l'Agriculture des États-Unis et du vétérinaire d'État approprié.
Désinfection
Les calicivirus sont stables dans l'environnement et difficiles à inactiver. Les produits couramment utilisés pour la désinfection domestique tels que les lingettes désinfectantes Clorox® et Lysol® ne fonctionnent pas contre ces virus. Une option efficace consiste à essuyer les surfaces avec une solution d' eau de Javel à 10 % , en laissant 10 minutes de temps de contact avant de rincer. Parmi les autres désinfectants qui ont fait leurs preuves, citons l'hydroxyde de sodium à 10 % , le One-Stroke Environ® à 2 %, le Virkon® S, les lingettes germicides à l'eau de Javel Clorox® Healthcare, Trifectant®, Rescue® et les nettoyants au peroxyde d'hydrogène. Les débris de surface doivent toujours être éliminés mécaniquement avant la désinfection. Une liste de désinfectants efficaces contre le calicivirus (en l'occurrence le norovirus) est disponible sur le site Web de l'Environmental Protection Agency. Des études ont montré que de nombreux désinfectants à base de composés d'ammonium quaternaire n'inactivent pas les calicivirus.
Quarantaine et autres mesures
En raison de la nature hautement infectieuse de la maladie, une quarantaine stricte est nécessaire lorsque des épidémies surviennent. Le dépeuplement, la désinfection, la vaccination, la surveillance et la quarantaine sont les seuls moyens d'éradiquer correctement et efficacement la maladie. Les lapins décédés doivent être retirés immédiatement et jetés de manière sûre. Les lapins survivants doivent être mis en quarantaine ou euthanasiés sans cruauté. Des lapins d'essai peuvent être utilisés pour surveiller le virus dans les élevages vaccinés.
Distribution géographique
La RHD est principalement une maladie affectant les lapins européens, qui sont originaires de la péninsule ibérique et que l'on trouve à l'état sauvage dans une grande partie de l'Europe occidentale. Les races domestiquées sont élevées dans le monde entier pour leur viande et leur fourrure, et deviennent des animaux de compagnie de plus en plus populaires. Les lapins européens ont été introduits et sont devenus sauvages et parfois invasifs en Australie, en Nouvelle-Zélande, au Chili, en Argentine et dans diverses îles.
La RHD a été signalée pour la première fois en 1984 en République populaire de Chine. Depuis lors, la RHD s'est propagée dans plus de 40 pays en Afrique, dans les Amériques, en Asie, en Europe et en Océanie , et est endémique dans la plupart des régions du monde.
Asie
La première épidémie signalée de RHD causée par RHDVa s'est produite en 1984 dans la province du Jiangsu en Chine . L'épidémie s'est produite dans un groupe de lapins angora qui avaient été importés d' Allemagne . La cause de la maladie a été déterminée comme étant un petit virus à ARN non enveloppé. Un vaccin inactivé a été développé qui s'est avéré efficace dans la prévention de la maladie. En moins d'un an, la maladie s'est propagée sur une superficie de 50 000 km 2 en Chine et a tué 140 millions de lapins domestiques.
La Corée du Sud a été le prochain pays à signaler des foyers de RHD suite à l'importation de fourrure de lapin de Chine. Depuis, la RHD s'est propagée et est devenue endémique dans de nombreux pays d'Asie, y compris l'Inde et le Moyen-Orient.
L'Europe
De la Chine, le RHDVa s'est propagé vers l'ouest jusqu'en Europe. Le premier rapport de RHD en Europe est venu d'Italie en 1986. De là, il s'est propagé à une grande partie de l'Europe. Le premier cas signalé en Espagne a eu lieu en 1988, suivi par la France, la Belgique et la Scandinavie en 1990. L'Espagne a connu une mortalité importante de lapins sauvages, ce qui a entraîné un déclin de la population de prédateurs qui mangeaient normalement des lapins, notamment le lynx ibérique et l' espagnol. aigle impérial .
La RHD causée par la RHDVa a été signalée pour la première fois au Royaume-Uni en 1992. Cette épidémie initiale a été maîtrisée à la fin des années 90 grâce à une combinaison de vaccination, de biosécurité stricte et d'un bon élevage. La nouvelle souche virale RHDV2 a été détectée pour la première fois en Angleterre et au Pays de Galles en 2014, et s'est rapidement propagée en Écosse et en Irlande.
En 2010, une nouvelle variante virale appelée virus de la maladie hémorragique du lapin 2 (RHDV2) est apparue en France. RHDV2 s'est depuis propagé de la France vers le reste de l'Europe, la Grande-Bretagne, l'Australie et la Nouvelle-Zélande. Des épidémies ont commencé à se produire aux États-Unis et sur l'île de Vancouver au Canada en 2019.
Le RHD a été détecté pour la première fois en Finlande en 2016. L'épidémie s'est produite chez des lapins européens sauvages, et les tests génétiques ont identifié la souche virale comme RHDV2. Des cas de transmission virale aux lapins domestiques domestiques ont été confirmés et la vaccination des lapins a été recommandée.
Océanie
En 1991, une souche du virus RHDVa, le CAPM tchèque 351RHDV, a été importée en Australie dans des conditions de quarantaine strictes pour rechercher l'innocuité et l'utilité du virus s'il était utilisé comme agent de lutte biologique contre le problème des lapins en Australie et en Nouvelle-Zélande . Des tests du virus ont été effectués sur l' île Wardang dans le golfe Spencer, au large de la péninsule de Yorke , en Australie-Méridionale . En 1995, le virus a échappé à la quarantaine et a par la suite tué 10 millions de lapins dans les 8 semaines suivant sa libération. En mars 2017, une nouvelle souche coréenne connue sous le nom de RHDV K5 a été lancée avec succès de manière délibérée après près d'une décennie de recherche. Cette souche a été choisie en partie parce qu'elle fonctionne mieux dans les régions fraîches et humides où le précédent Calicivirus était moins efficace.
En juillet 1997, après avoir examiné plus de 800 soumissions publiques, le ministère de la Santé de la Nouvelle-Zélande a décidé de ne pas autoriser l'importation de RHDVa en Nouvelle-Zélande pour contrôler les populations de lapins. Cependant, fin août, il a été confirmé que RHDVa avait été délibérément et illégalement introduit dans la région de Cromwell de l' île du Sud . Une tentative infructueuse a été faite par les autorités néo-zélandaises pour contrôler la propagation de la maladie. Cependant, elle était intentionnellement propagée et plusieurs agriculteurs (notamment dans la région du bassin du Mackenzie ) ont admis avoir traité des lapins morts de la maladie dans des mélangeurs de cuisine pour une propagation ultérieure. Si la maladie avait été introduite à un meilleur moment, le contrôle de la population aurait été plus efficace, mais elle a été libérée après le début de la reproduction pour la saison, et les lapins âgés de moins de 2 semaines au moment de l'introduction étaient résistants à la maladie. Ces jeunes lapins ont donc pu survivre et se reproduire. Dix ans plus tard, les populations de lapins (dans le bassin du Mackenzie en particulier) recommencent à atteindre des proportions proches d'avant la peste, bien qu'elles ne soient pas encore revenues aux niveaux d'avant la RHD. La résistance au RHD chez les lapins néo-zélandais a conduit à l'utilisation généralisée du composé 1080 (fluoroacétate de sodium) . Le gouvernement et le ministère de la conservation doivent augmenter leur utilisation de 1080 pour protéger les terres de la réserve des lapins et préserver les gains réalisés ces dernières années grâce à l'utilisation du RHD.
Amérique du Nord et du Sud
Des foyers isolés de RHDVa chez des lapins domestiques se sont produits aux États-Unis, dont le premier dans l'Iowa en 2000. En 2001, des foyers se sont produits dans l'Utah, l'Illinois et New York. Des épidémies plus récentes de RHDVa se sont produites en 2005 dans l'Indiana et en 2018 en Pennsylvanie. Chacune de ces épidémies a été contenue et était le résultat d'introductions séparées mais indéterminables de RHDVa. Le RHDVa n'affecte pas le lapin et les lièvres indigènes aux États-Unis, de sorte que le virus n'est pas devenu endémique.
Le premier signalement du virus RHDV2 en Amérique du Nord a eu lieu dans une ferme au Québec, en 2016. En 2018, une éclosion plus importante s'est produite chez des lapins sauvages européens à Delta et à l'île de Vancouver, en Colombie-Britannique. La maladie a été confirmée plus tard cette année-là chez un lapin de compagnie dans l'Ohio. En juillet 2019, le premier cas de RHDV2 à Washington a été confirmé chez un lapin de compagnie d' Orcas Island . RHDV2 a été signalé chez des lapins domestiques à Washington et à New York.
En 2020, des foyers de la maladie chez des lapins domestiques, ainsi que des lapins à queue blanche et des lièvres, ont été signalés en Arizona, au Nouveau-Mexique, au Colorado, au Texas, au Nevada, en Californie et en Utah. La faune affectée comprend les lapins de montagne ( Sylvilagus nutalli ), les lapins du désert ( S. audubonii ), les lièvres antilopes ( L. alleni ) et les lièvres à queue noire ( L. californicus ). Le virus circulant dans le sud-ouest des États-Unis est distinct du RHDV2 isolé à New York, Washington, Ohio et Colombie-Britannique, Canada. Les sources de ces épidémies sont inconnues.
Le Mexique a connu une épidémie de RHDVa chez des lapins domestiques de 1989 à 1991, vraisemblablement à la suite de l'importation de viande de lapin en provenance de la République populaire de Chine. Des mesures strictes de quarantaine et de dépeuplement ont pu éradiquer le virus, et le pays a été officiellement déclaré exempt de RHD en 1993. Une deuxième épidémie de RHD chez les lapins domestiques a commencé dans l'État de Chihuahua en avril 2020 et s'est depuis propagée à Sonora, Basse-Californie, Basse-Californie du Sud, Coahuila et Durango.
Depuis 1993, RHDVa est endémique à Cuba. Quatre épizooties impliquant des lapins domestiques ont été signalées en 1993, 1997, 2000-2001 et 2004-2005. En conséquence, des milliers de lapins sont morts ou ont été abattus à chaque fois. On pense également que le virus est en plein essor en Bolivie .
Voir également
Les références
- Une nouvelle éclosion au Canada a été signalée sur l'île de Vancouver « La Colombie-Britannique émet un avertissement aux propriétaires de lapins de compagnie alors que le virus se propage dans le Lower Mainland | CBC News » .