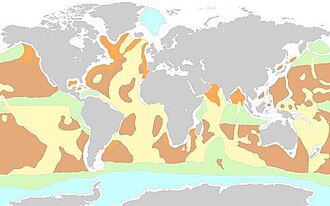
Limon siliceux - Siliceous ooze

Le limon siliceux est un type de sédiment pélagique biogénique situé au fond de l' océan profond . Les limons siliceux sont les moins communs des sédiments des grands fonds et représentent environ 15 % du fond océanique. Les limons sont définis comme des sédiments qui contiennent au moins 30 % de restes squelettiques de micro-organismes pélagiques. Les vases siliceux sont en grande partie composés de squelettes à base de silice d'organismes marins microscopiques tels que les diatomées et les radiolaires . D'autres composants des suintements siliceux près des marges continentales peuvent inclure des particules de silice d'origine terrestre et des spicules d'éponge. Les limons siliceux sont composés de squelettes fabriqués à partir de silice opale Si(O 2 ) , par opposition aux limons calcaires , qui sont constitués de squelettes d'organismes carbonatés de calcium (c'est-à-dire les coccolithophores ). La silice (Si) est un élément bioessentiel et est recyclée efficacement dans l'environnement marin à travers le cycle de la silice . La distance des masses continentales, la profondeur de l'eau et la fertilité des océans sont autant de facteurs qui affectent la teneur en silice opale dans l'eau de mer et la présence de suints siliceux.

Formation
Absorption biologique de la silice marine
Les organismes marins siliceux, tels que les diatomées et les radiolaires, utilisent la silice pour former des squelettes grâce à un processus connu sous le nom de biominéralisation . Les diatomées et les radiolaires ont évolué pour absorber la silice sous forme d'acide silicique, Si(OH) 4 . Une fois qu'un organisme a séquestré des molécules de Si(OH) 4 dans son cytoplasme , les molécules sont transportées vers des vésicules de dépôt de silice où elles sont transformées en silice opale (B-SiO 2 ). Les diatomées et les radiolaires possèdent des protéines spécialisées appelées transporteurs de silicium qui empêchent la minéralisation lors de la séquestration et du transport de l'acide silicique dans l'organisme.
La formule chimique de l'absorption biologique de l'acide silicique est :
État de saturation en silice opale
| Fait partie d'une série liée à |
| Biominéralisation |
|---|
 |
L'état de saturation de la silice opale augmente avec la profondeur de l'océan en raison de la dissolution des particules d'opale qui coulent produites dans les eaux océaniques de surface, mais reste suffisamment faible pour que la réaction pour former de la silice opale biogénique reste thermodynamiquement défavorable. Malgré les conditions défavorables, les organismes peuvent utiliser de l'acide silicique dissous pour fabriquer des coquilles de silice opale par biominéralisation contrôlée biologiquement. La quantité de silice opale qui atteint le fond marin est déterminée par les taux de naufrage, de dissolution et de profondeur de la colonne d'eau.
Exportation de silice vers l'océan profond
Le taux de dissolution de la silice opale descendante (B-SiO 2 ) dans la colonne d'eau affecte la formation de limon siliceux au fond de l'océan. Le taux de dissolution de la silice dépend de l'état de saturation de la silice opale dans la colonne d'eau et du reconditionnement des particules de silice opale dans des particules plus grosses de la surface de l'océan. Le reconditionnement est la formation (et parfois la reformation) de matière organique solide (généralement des boulettes fécales) autour de la silice opale. La matière organique protège contre la dissolution immédiate de la silice opale en acide silicique, ce qui permet une sédimentation accrue du fond marin. La profondeur de compensation d'opale, similaire à la profondeur de compensation de carbonate , se situe à environ 6000 mètres. En dessous de cette profondeur, il y a une plus grande dissolution de la silice opale dans l'acide silicique que la formation de silice opale à partir de l'acide silicique. Seulement quatre pour cent de la silice opale produite à la surface de l'océan seront, en moyenne, déposées au fond de la mer, tandis que les 96 % restants sont recyclés dans la colonne d'eau.
Taux d'accumulation
Les limons siliceux s'accumulent sur de longues périodes. En haute mer, la vase siliceuse s'accumule à un taux d'environ 0,01 mol Si m -2 an -1 . Les taux d'accumulation les plus rapides de limon siliceux se produisent dans les eaux profondes de l'océan Austral (0,1 mol Si m −2 an −1 ) où la production et l'exportation de silice biogénique sont les plus importantes. Les squelettes de diatomées et de radiolaires qui composent les suintements de l'océan Austral peuvent mettre 20 à 50 ans à couler au fond de la mer. Les particules siliceuses peuvent couler plus rapidement si elles sont enfermées dans les boulettes fécales d'organismes plus gros. Une fois déposée, la silice continue de se dissoudre et de cycler, retardant l'enfouissement à long terme des particules jusqu'à ce qu'une profondeur de 10 à 20 cm dans la couche de sédiments soit atteinte.
Formation de cherts marins
Lorsque la silice opale s'accumule plus vite qu'elle ne se dissout, elle est enfouie et peut fournir un environnement diagénétique pour la formation de chert marin . Les processus conduisant à la formation de chert ont été observés dans l'océan Austral, où l'accumulation de limon siliceux est la plus rapide. La formation de chert peut cependant prendre des dizaines de millions d'années. Les fragments de squelette d'organismes siliceux sont soumis à une recristallisation et à une cémentation. Le chert est le principal destin des limons siliceux enfouis et élimine définitivement la silice du cycle de la silice océanique .
Emplacements géographiques
Des limons siliceux se forment dans les zones d' upwelling qui fournissent des nutriments précieux pour la croissance des organismes siliceux vivant dans les eaux de surface océaniques. Un exemple notable se trouve dans l'océan Austral, où une remontée constante des eaux profondes circumpolaires de l'Inde, du Pacifique et de l'Antarctique a entraîné la formation d'un vase siliceux contigu qui s'étend autour du globe. Il existe une bande de vase siliceuse qui est le résultat d'une remontée équatoriale accrue dans les sédiments de l'océan Pacifique sous le courant nord-équatorial . Dans le Pacifique Nord subpolaire, l'upwelling se produit le long des côtés est et ouest du bassin à partir du courant d'Alaska et du courant d'Oyashio . Un limon siliceux est présent le long du fond marin dans ces régions subpolaires. Les courants de bordure des bassins océaniques, tels que le courant de Humboldt et le courant de Somalie, sont des exemples d'autres courants ascendants qui favorisent la formation de vase siliceuse.
Le limon siliceux est souvent classé en fonction de sa composition. Les limons de diatomées sont principalement formés de squelettes de diatomées et se trouvent généralement le long des marges continentales dans les latitudes plus élevées. Des suintements de diatomées sont présents dans l'océan Austral et l'océan Pacifique Nord. Les limons de radiolaires sont constitués principalement de squelettes de radiolaires et se trouvent principalement dans les régions tropicales équatoriales et subtropicales. Des exemples de vases de radiolaires sont les vases de la région équatoriale, de la région subtropicale du Pacifique et du bassin subtropical de l'océan Indien. Une petite surface de sédiments d'eau profonde est recouverte de vase de radiolaires dans le bassin équatorial de l'Atlantique Est.
Rôle dans le cycle de la silice océanique

Le dépôt des fonds marins sous forme de vase est le plus grand puits à long terme du cycle de la silice océanique (6,3 ± 3,6 Tmol Si an −1 ). Comme indiqué ci-dessus, cette vase est transformée par diagénétique en chert marin lithosphérique. Ce puits est à peu près équilibré par l'altération des silicates et les apports fluviaux d'acide silicique dans l'océan. La production de silice biogénique dans la zone photique est estimée à 240 ± 40 Tmol si an −1 . Une dissolution rapide à la surface élimine environ 135 Tmol d'opale Si an -1 , le reconvertissant en acide silicique soluble qui peut être réutilisé pour la biominéralisation. La silice opale restante est exportée vers l'océan profond sous forme de particules en train de couler. Dans l'océan profond, 26,2 Tmol Si An -1 supplémentaires sont dissous avant d'être déposés dans les sédiments sous forme de silice opale. À l'interface sédiment-eau, plus de 90 % de la silice est recyclée et remontée pour être réutilisée dans la zone photique. Le temps de séjour à l'échelle biologique est estimé à environ 400 ans, chaque molécule de silice étant recyclée 25 fois avant l'enfouissement des sédiments.
Les suintements siliceux et la séquestration du carbone
Les diatomées sont des producteurs primaires qui convertissent le dioxyde de carbone en carbone organique via la photosynthèse et exportent le carbone organique de la surface de l'océan vers la mer profonde via la pompe biologique . Les diatomées peuvent donc être un puits important pour le dioxyde de carbone dans les eaux de surface. En raison de la taille relativement grande des diatomées (par rapport aux autres phytoplanctons), elles sont capables d'absorber plus de dioxyde de carbone total. De plus, les diatomées ne libèrent pas de dioxyde de carbone dans l'environnement lors de la formation de leurs coquilles de silicate opale. Le phytoplancton qui construit les coquilles de carbonate de calcium (c'est-à-dire les coccolithophores) libère du dioxyde de carbone comme sous-produit lors de la formation de la coquille, ce qui en fait un puits moins efficace pour le dioxyde de carbone. Les squelettes de silicate opale améliorent la vitesse de descente des particules de diatomées (c'est-à-dire le carbone) de la surface de l'océan au fond marin.
Expériences de fertilisation en fer
Les niveaux de dioxyde de carbone atmosphérique ont augmenté de manière exponentielle depuis la révolution industrielle et les chercheurs explorent des moyens d'atténuer les niveaux de dioxyde de carbone atmosphérique en augmentant l'absorption de dioxyde de carbone dans la surface de l'océan via la photosynthèse. Une augmentation de l'absorption de dioxyde de carbone dans les eaux de surface peut entraîner une plus grande séquestration du carbone dans les grands fonds grâce à la pompe biologique. La dynamique de floraison des diatomées, leur ballastage par de la silice opale et divers besoins en nutriments ont fait des diatomées un objectif pour les expériences de séquestration du carbone.
Des projets de fertilisation en fer comme les expériences d'enrichissement en fer de SERIES ont introduit du fer dans les bassins océaniques pour tester si cela augmente le taux d'absorption de dioxyde de carbone par les diatomées et le fait finalement couler dans les profondeurs de l'océan. Le fer est un nutriment limitant pour la photosynthèse des diatomées dans les zones de l'océan riches en nutriments et pauvres en chlorophylle . Ainsi, l'augmentation de la quantité de fer disponible peut entraîner une augmentation ultérieure de la photosynthèse, entraînant parfois une prolifération de diatomées. Cette augmentation élimine plus de dioxyde de carbone de l'atmosphère. Bien qu'une plus grande quantité de dioxyde de carbone soit absorbée, le taux de séquestration du carbone dans les sédiments des grands fonds est généralement faible. La plupart du dioxyde de carbone absorbé au cours du processus de photosynthèse est recyclé plusieurs fois dans la couche de surface avant d'atteindre les profondeurs de l'océan pour y être séquestré.
Paléo suinte
| Fait partie d'une série sur |
| Cycles biogéochimiques |
|---|
 |
Avant les organismes siliceux
Au cours du Précambrien , les concentrations de silice océanique étaient d'un ordre de grandeur plus élevées que dans les océans modernes. On pense que l'évolution de la biosilicification est apparue au cours de cette période. Des suintements siliceux se sont formés une fois que des organismes séquestrants de silice tels que les radiolaires et les diatomées ont commencé à prospérer dans les eaux de surface.
Évolution des organismes siliceux
Radiolaires
Des preuves fossiles suggèrent que les radiolaires sont apparus pour la première fois à la fin du Cambrien en tant qu'organismes flottant librement dans les eaux peu profondes. Ils ne sont devenus importants dans les archives fossiles qu'à l' Ordovicien . Les radiolarites ont évolué dans les régions d'upwelling dans les zones de haute productivité primaire et sont les plus anciens organismes connus capables de sécrétion de coquilles. Les restes de radiolaires sont conservés dans du chert ; un sous-produit de la transformation du limon siliceux. Des événements majeurs de spéciation des radiolaires se sont produits pendant le Mésozoïque . Beaucoup de ces espèces sont maintenant éteintes dans l'océan moderne. Les scientifiques émettent l'hypothèse que la compétition avec les diatomées pour la silice dissoute au cours du Cénozoïque est la cause probable de l'extinction massive de la plupart des espèces de radiolaires.
Diatomées
Les plus anciens fossiles de diatomées bien conservés ont été datés du début de la période jurassique . Cependant, les archives moléculaires suggèrent que les diatomées ont évolué il y a au moins 250 millions d'années au cours du Trias . Au fur et à mesure que de nouvelles espèces de diatomées ont évolué et se sont propagées, les niveaux de silice océanique ont commencé à diminuer. Aujourd'hui, il existe environ 100 000 espèces de diatomées, dont la plupart sont microscopiques (2-200 μm). Certaines des premières diatomées étaient plus grosses et pouvaient mesurer entre 0,2 et 22 mm de diamètre.
Les premières diatomées étaient des centriques radiales et vivaient dans des eaux peu profondes près du rivage. Ces premières diatomées étaient adaptées pour vivre sur le benthos, car leurs coquilles extérieures étaient lourdes et les empêchaient de flotter librement. Les diatomées flottantes, connues sous le nom de bipolaires et multipolaires, ont commencé à évoluer il y a environ 100 millions d'années au Crétacé . Les diatomées fossiles sont conservées dans la diatomite (également connue sous le nom de terre de diatomées ), qui est l'un des sous-produits de la transformation du limon en formation rocheuse. Lorsque les particules de diatomées ont commencé à couler au fond de l'océan, le carbone et la silice ont été séquestrés le long des marges continentales. Le carbone séquestré le long des marges continentales est devenu aujourd'hui les principales réserves pétrolières. L'évolution des diatomées marque un moment dans l'histoire géologique de la Terre d'élimination significative du dioxyde de carbone de l'atmosphère tout en augmentant simultanément les niveaux d'oxygène atmosphérique.
Comment les scientifiques utilisent Paleo-Ooze
Les paléoocéanographes étudient les limons préhistoriques pour en savoir plus sur les changements dans les océans au fil du temps. La distribution des sédiments et les modèles de dépôt des limons informent les scientifiques sur les zones préhistoriques des océans qui présentaient des conditions idéales pour la croissance des organismes siliceux.
Les scientifiques examinent le paléo-boue en prélevant des carottes de sédiments des grands fonds. Les couches de sédiments dans ces carottes révèlent les modèles de dépôt de l'océan au fil du temps. Les scientifiques utilisent les paléo-boues comme outils pour mieux déduire les conditions des paléoocéans. Les taux d'accrétion de paléo-boue peuvent être utilisés pour déterminer la circulation en haute mer, l'activité tectonique et le climat à un moment donné. Les limons sont également utiles pour déterminer les abondances historiques d'organismes siliceux.
Formation Burubaital
La formation Burubatial, située dans la région de Balkhach ouest au Kazakhstan, est le plus ancien gisement biogénique abyssal connu. La formation Burubaital est principalement composé de chert qui a été formé sur une période de 15 millions d' années (fin Cambrian -Moyen Ordovicien ). Il est probable que ces dépôts se soient formés dans une région d'upwelling aux latitudes subéquatoriales. La Formation de Burubaital est en grande partie composée de radiolarites, car les diatomées n'avaient pas encore évolué au moment de sa formation. Les gisements de Burubaital ont conduit les chercheurs à croire que les radiolaires ont joué un rôle important dans le cycle de la silice du Cambrien supérieur. Le Cambrien supérieur (497-485,4 millions d'années) marque une période de transition pour la biodiversité marine et marque le début de l'accumulation de limon sur le fond marin.
Changements de distribution au Miocène
Un changement dans la répartition géographique des limons siliceux s'est produit au cours du Miocène . Il y a seize millions d'années, il y a eu un déclin progressif des dépôts de vase siliceuse dans l'Atlantique Nord et une augmentation simultanée des dépôts de vase siliceuse dans le Pacifique Nord. Les scientifiques spéculent que ce changement de régime pourrait avoir été causé par l'introduction de l'eau de débordement de la mer nordique, qui a contribué à la formation des eaux profondes de l'Atlantique Nord (NADW). La formation des eaux de fond de l' Antarctique (AABW) s'est produite à peu près au même moment que la formation de NADW. La formation de NADW et AABW a radicalement transformé l'océan et a entraîné un déplacement spatial de la population d'organismes siliceux.
Floraison du plancton du Paléocène
La limite Crétacé-Tertiaire était une période d'extinction de masse mondiale, communément appelée extinction de masse KT . Alors que la plupart des organismes disparaissaient, les organismes siliceux marins prospéraient dans les mers du Paléocène inférieur. Un tel exemple s'est produit dans les eaux près de Marlborough, en Nouvelle-Zélande. Les dépôts de paléo-exsudation indiquent qu'il y a eu une croissance rapide des diatomées et des radiolaires à cette époque. Les scientifiques pensent que cette période de forte productivité en biosilice est liée aux changements climatiques mondiaux. Ce boom du plancton siliceux a été le plus important au cours du premier million d'années de l'ère tertiaire et on pense qu'il a été alimenté par une augmentation des remontées d'eau en réponse à un climat de refroidissement et à une augmentation du cycle des nutriments en raison d'un changement du niveau de la mer.
Voir également
Les références
- ^ Mulder, Thierry; Hüneke, Heiko; Van Loon, AJ (2011), "Progress in Deep-Sea Sedimentology", Deep-Sea Sediments , Elsevier, pp. 1-24, doi : 10.1016/b978-0-444-53000-4.0001-9 , ISBN 9780444530004
- ^ Bohrmann, Gerhard; Abelmann, Andréa ; Gersonde, Rainer ; Hubberten, Hans ; Kuhn, Gerhard (1994). « Limon pur siliceux, un environnement diagénétique pour la formation précoce du chert ». Géologie . 22 (3): 207. bibcode : 1994Geo .... 22..207B . doi : 10.1130/0091-7613(1994)022<0207:psoade>2.3.co;2 .
- ^ A b c DeMaster, David J. (Octobre 1981). « L'approvisionnement et l'accumulation de silice dans le milieu marin ». Geochimica et Cosmochimica Acta . 45 (10) : 1715-1732. Bibcode : 1981GeCoA..45.1715D . doi : 10.1016/0016-7037(81)90006-5 .
- ^ un b "Cristallisation et biominéralisation de la silice végétale : Observations de base" . ResearchGate . Récupéré le 28-11-2018 .
- ^ Dixit, Suvasis; Van Cappellen, Philippe (juillet 2002). « Chimie de surface et réactivité de la silice biogénique ». Geochimica et Cosmochimica Acta . 66 (14) : 2559-2568. Bibcode : 2002GeCoA..66.2559D . doi : 10.1016/s0016-7037(02)00854-2 .
- ^ A b c d Stoecker, DK; Gustafson, DE; Verity, PG (1996). "Micro- et mésoprotozooplancton à 140*W dans le Pacifique équatorial : hétérotrophes et mixotrophes" . Écologie microbienne aquatique . 10 : 273-282. doi : 10.3354/ame010273 .
- ^ A b c Burckle, Lloyd H .; Cirilli, Jérôme (1987). « L'origine de la ceinture de limon de diatomées dans l'océan Austral : implications pour la paléocéanographie du Quaternaire tardif ». Micropaléontologie . 33 (1) : 82. doi : 10.2307/1485529 . JSTOR 1485529 .
- ^ A b c d "atmosphère, l' océan et la dynamique climatique: un texte d' introduction" . Avis de choix en ligne . 45 (10) : 45-5595-45-5595. Juin 2008. doi : 10.5860/choice.45-5595 . S2CID 127409245 .
- ^ un b c d e f g h i j k KELLER, GERTA; BARRON, JOHN A. (1983). « Implications paléocéanographiques des hiatus en eaux profondes du Miocène ». Bulletin de la Société géologique d'Amérique . 94 (5): 590. bibcode : 1983GSAB ... 94..590K . doi : 10.1130/0016-7606 (1983)94<590:piomdh>2.0.co;2 .
- ^ A b c d Van Cappellen, P. (Janvier 2003). "Biominéralisation et cycles biogéochimiques mondiaux". Revues en Minéralogie et Géochimie . 54 (1) : 357-381. Bibcode : 2003RvMG ... 54..357V . CiteSeerX 10.1.1.499.4327 . doi : 10.211/0540357 .
- ^ A b c d e f g Tréguer PJ, De La Rocha CL (03/01/2013). « Le cycle mondial de la silice océanique ». Revue annuelle des sciences marines . 5 (1) : 477–501. doi : 10.1146/annurev-marine-121211-172346 . PMID 22809182 .
- ^ A b c d Armbrust EV (mai 2009). « La vie des diatomées dans les océans du monde ». Nature . 459 (7244) : 185-92. Bibcode : 2009Natur.459..185A . doi : 10.1038/nature08057 . PMID 19444204 . S2CID 3738371 .
- ^ A b c d Groupe d' experts intergouvernemental sur les changements climatiques, ed. (2014), "Carbon and Other Biogeochemical Cycles Pages 465 to 514", Climate Change 2013 - the Physical Science Basis , Cambridge University Press, pp. 465-514, doi : 10.1017/cbo9781107415324.014 , ISBN 9781107415324
- ^ un b Iversen, MH; Plough, H. (2010-09-07). "Les minéraux de ballast et le flux de carbone descendant dans l'océan: taux de respiration spécifiques au carbone et vitesse de chute des agrégats de neige marine" . Biogéosciences . 7 (9) : 2613–2624. Bibcode : 2010BGeo .... 7.2613I . doi : 10.5194/bg-7-2613-2010 . ISSN 1726-4189 .
- ^ un b "Une promenade à travers le temps - Il y a 208 millions d'années - Symétrie de silicium : Extinction de masse Trias-Jurassique" . www.globalcommunity.org . Récupéré le 2018-11-26 .
-
^ A b c enregistrement fossile . 11 (1). Février 2008. doi : 10.1002/mmng.v11:1 . ISSN 1435-1943 . Manquant ou vide
|title=( aide ) - ^ un b Kemp, AES; Pearce, RB; Grigorov, I.; Rance, J.; Lange, CB ; Quilty, P.; Salter, I. (2006-10-13). « Production de diatomées marines géantes et leur exportation dans les zones frontales océaniques : Implications pour le flux de Si et de C des océans stratifiés » (PDF) . Cycles biogéochimiques mondiaux . 20 (4) : n/a. Bibcode : 2006GBioC..20.4S04K . doi : 10.1029/2006gb002698 . ISSN 0886-6236 .
- ^ Danelian, Taniel; Aitchison, Jonathan C.; Noble, Paula ; Caridroit, Martial ; Suzuki, Noritoshi ; O'Dogherty, Luis (septembre 2017). « Aperçus historiques sur près de 130 ans de recherche sur les radiolaires paléozoïques ». Geodiversitas . 39 (3) : 351-361. doi : 10.5252/g2017n3a2 . ISSN 1280-9659 . S2CID 134007679 .
- ^ A b c d e f g Renaudie, Johan; Drews, Effi-Laura; Böhne, Simon (2018-08-20). "Le dossier paléocène des diatomées marines dans les sédiments des grands fonds" . Registre des fossiles . 21 (2) : 183-205. doi : 10.5194/fr-21-183-2018 . ISSN 2193-0074 .
- ^ A b c d e f Tolmacheva, Tatiana J .; Danelian, Taniel; Popov, Leonid E. (2001). « Preuve pour 15 ma de sédimentation siliceuse biogénique continue en haute mer dans les océans paléozoïques précoces ». Géologie . 29 (8): 755. bibcode : 2001Geo .... 29..755T . doi : 10.1130/0091-7613(2001)029<0755:efmyoc>2.0.co;2 . ISSN 0091-7613 .
- ^ KELLER, GERTA; BARRON, JOHN A. (1983). « Implications paléocéanographiques des hiatus en eaux profondes du Miocène ». Bulletin de la Société géologique d'Amérique . 94 (5): 590. bibcode : 1983GSAB ... 94..590K . doi : 10.1130/0016-7606 (1983)94<590:piomdh>2.0.co;2 .
- ^ un b Hollis, CJ; Rodgers, KA ; Parker, RJ (1995-09-01). « Floraison de plancton siliceux dans le premier Tertiaire de Marlborough, Nouvelle-Zélande ». Géologie . 23 (9) : 835-838. Bibcode : 1995Geo .... 23..835H . doi : 10.1130/0091-7613(1995)023<0835:SPBITE>2.3.CO;2 . ISSN 0091-7613 .