Poids atomique standard - Standard atomic weight
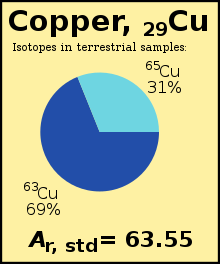
Le poids standard atomique ( A r, la norme (E)) d'un élément chimique est la moyenne arithmétique pondérée des masses isotopiques relatifs de tous les isotopes de cet élément pondéré par l'abondance de chaque isotope sur la Terre . Par exemple, l'isotope 63 Cu ( A r = 62,929) constitue 69 % du cuivre sur Terre, le reste étant 65 Cu ( A r = 64,927), donc
Parce que les masses isotopiques relatives sont des quantités sans dimension , cette moyenne pondérée est également sans dimension. Elle peut être convertie en une mesure de masse (de dimension M ) en la multipliant par le dalton , également connu sous le nom de constante de masse atomique.
Parmi les différentes variantes de la notion de poids atomique ( A r , également appelée masse atomique relative ) utilisées par les scientifiques, le poids atomique standard ( A r , standard ) est le plus courant et le plus pratique. Le poids atomique standard de chaque élément chimique est déterminé et publié par la Commission des abondances isotopiques et des poids atomiques (CIAAW) de l' Union internationale de chimie pure et appliquée (IUPAC) sur la base des sources naturelles, stables et terrestres de l'élément. La définition spécifie l'utilisation d'échantillons provenant de nombreuses sources représentatives de la Terre, de sorte que la valeur peut être largement utilisée comme « le » poids atomique des substances telles qu'elles sont rencontrées dans la réalité, par exemple dans les produits pharmaceutiques et la recherche scientifique. Les poids atomiques non standardisés d'un élément sont spécifiques aux sources et aux échantillons, tels que le poids atomique du carbone dans un os particulier d'un site archéologique particulier. Le poids atomique standard fait la moyenne de ces valeurs par rapport à la gamme de poids atomiques qu'un chimiste pourrait s'attendre à tirer de nombreux échantillons aléatoires de la Terre. Cette plage est la justification de la notation d'intervalle donnée pour certaines valeurs de poids atomiques standard.
Sur les 118 éléments chimiques connus, 80 ont des isotopes stables et 84 ont cette valeur basée sur l'environnement terrestre. Typiquement, une telle valeur est par exemple l'hélium : A r, standard (He) = 4.002 602 (2) . Le "(2)" indique l'incertitude dans le dernier chiffre affiché, à lire4.002 602 ± 0.000 002 . L'IUPAC publie également des valeurs abrégées , arrondies à cinq chiffres significatifs. Pour l'hélium, A r, abrégé (He) = 4.0026 .
Pour treize éléments, les échantillons divergent sur cette valeur, car leurs sources d'échantillons ont eu une histoire de désintégration différente. Par exemple, le thallium (Tl) dans les roches sédimentaires a une composition isotopique différente de celle des roches ignées et des gaz volcaniques. Pour ces éléments, le poids atomique standard est noté comme un intervalle : A r, standard (Tl) = [204,38, 204,39] . Avec un tel intervalle, pour les situations moins exigeantes, l'IUPAC publie également une valeur conventionnelle . Pour le thallium, A r, conventionnel (Tl) = 204.38 .
Définition

Le poids atomique standard est une valeur spéciale de la masse atomique relative. Il est défini comme les "valeurs recommandées" des masses atomiques relatives des sources dans l'environnement local de la croûte terrestre et de l' atmosphère telles que déterminées par la Commission IUPAC sur les poids atomiques et les abondances isotopiques (CIAAW). En général, les valeurs provenant de différentes sources sont soumises à des variations naturelles en raison d'une histoire radioactive différente des sources. Ainsi, les poids atomiques standard sont une plage d'attente de poids atomiques à partir d'une plage d'échantillons ou de sources. En limitant les sources à l'origine terrestre uniquement, les valeurs déterminées par la CIAAW ont moins de variance et sont une valeur plus précise pour les masses atomiques relatives (poids atomiques) réellement trouvées et utilisées dans les matériaux du monde.
Les valeurs publiées par la CIAAW sont utilisées et parfois légalement requises dans les calculs de masse. Les valeurs ont une incertitude (notée entre parenthèses) ou sont un intervalle d'attente (voir l'exemple dans l'illustration immédiatement ci-dessus). Cette incertitude reflète la variabilité naturelle de la distribution isotopique d'un élément, plutôt que l'incertitude de la mesure (qui est beaucoup plus petite avec des instruments de qualité).
Bien qu'il y ait une tentative de couvrir la plage de variabilité sur Terre avec des chiffres de poids atomique standard, il existe des cas connus d'échantillons minéraux qui contiennent des éléments avec des poids atomiques qui sont des valeurs aberrantes de la plage de poids atomique standard.
Pour les éléments synthétiques, l'isotope formé dépend du moyen de synthèse, donc le concept d'abondance d'isotopes naturels n'a aucun sens. Par conséquent, pour les éléments synthétiques, le nombre total de nucléons de l'isotope le plus stable (c'est-à-dire l'isotope ayant la demi-vie la plus longue) est indiqué entre parenthèses, à la place du poids atomique standard.
Lorsque le terme "poids atomique" est utilisé en chimie, c'est généralement le poids atomique standard plus spécifique qui est impliqué. Ce sont les poids atomiques standard qui sont utilisés dans les tableaux périodiques et de nombreuses références standard en chimie terrestre ordinaire.
Le lithium représente un cas unique où les abondances naturelles des isotopes se sont avérées dans certains cas perturbées par les activités de séparation isotopique humaine au point d'affecter l'incertitude de son poids atomique standard, même dans des échantillons obtenus à partir de sources naturelles, telles que rivières.
Définition terrestre
Un exemple de la raison pour laquelle les « sources terrestres conventionnelles » doivent être spécifiées en donnant des valeurs de poids atomique standard est l'élément argon. Entre les emplacements du système solaire , le poids atomique de l'argon varie jusqu'à 10 %, en raison de la variation extrême de la composition isotopique. Lorsque la principale source d'argon est la désintégration de40
K dans les rochers,40
Ar sera l'isotope dominant. De tels emplacements incluent les planètes Mercure et Mars et la lune Titan. Sur Terre, les rapports des trois isotopes 36 Ar : 38 Ar : 40 Ar sont d'environ 5 : 1 : 1600, ce qui donne à l'argon terrestre un poids atomique standard de 39,948 (1).
Cependant, tel n'est pas le cas dans le reste de l'univers. L'argon produit directement, par nucléosynthèse stellaire , est dominé par le nucléide à processus alpha36
Ar . En conséquence, l'argon solaire contient 84,6%36
Ar (selon les mesures du vent solaire ), et le rapport des trois isotopes 36 Ar : 38 Ar : 40 Ar dans les atmosphères des planètes extérieures est de 8400 : 1600 : 1. Le poids atomique de l'argon dans le Soleil et la plupart des l'univers, par conséquent, ne serait que d'environ 36,3.
Les causes de l'incertitude sur Terre
Célèbre, la valeur de poids atomique publiée est accompagnée d'une incertitude. Cette incertitude (et connexe : la précision) découle de sa définition, la source étant « terrestre et stable ». Les causes systématiques d'incertitude sont :
- Limites de mesure. Comme toujours, la mesure physique n'est jamais finie. Il y a toujours plus de détails à trouver et à lire. Ceci est valable pour tous unique , pur isotope Trouvées. Par exemple, aujourd'hui, la masse du principal isotope naturel du fluor ( fluor-19 ) peut être mesurée avec une précision de onze décimales :18,998 403 163 (6) . Mais un système de mesure encore plus précis pourrait devenir disponible, produisant plus de décimales.
- Mélanges imparfaits d'isotopes. Dans les échantillons prélevés et mesurés, le mélange (abondance relative) de ces isotopes peut varier. Par exemple le cuivre. Alors qu'en général ses deux isotopes représentent 69,15 % et 30,85 % chacun de tout le cuivre trouvé, l' échantillon naturel mesuré peut avoir eu une « agitation » incomplète et les pourcentages sont donc différents. La précision est améliorée en mesurant plus d'échantillons bien sûr, mais il reste cette cause d'incertitude. (Exemple : les échantillons de plomb varient tellement, il ne peut être noté plus précisément que quatre chiffres :207.2 )
- Des sources terrestres avec une histoire différente. Une source est la plus grande zone étudiée, par exemple « l'eau de mer » ou « la roche volcanique » (par opposition à un « échantillon » : le seul tas de matière à l'étude). Il apparaît que certains éléments ont un mélange isotopique différent par source. Par exemple, le thallium dans la roche ignée a plus d'isotopes plus légers, tandis que dans la roche sédimentaire, il a plus d'isotopes lourds. Il n'y a pas de nombre moyen terrestre. Ces éléments montrent la notation d'intervalle : A r, standard (Tl) = [204.38 , 204,39 ]. Pour des raisons pratiques, un numéro « conventionnel » simplifié est également publié (pour Tl : 204,38).
Ces trois incertitudes sont cumulatives. La valeur publiée est le résultat de tout cela.
Détermination de la masse atomique relative
Les masses atomiques relatives modernes (un terme spécifique à un échantillon d'élément donné) sont calculées à partir des valeurs mesurées de la masse atomique (pour chaque nucléide) et de la composition isotopique d'un échantillon. Des masses atomiques très précises sont disponibles pour pratiquement tous les nucléides non radioactifs, mais les compositions isotopiques sont à la fois plus difficiles à mesurer avec une grande précision et plus sujettes à des variations entre les échantillons. Pour cette raison, les masses atomiques relatives des 22 éléments mononucléidiques (qui sont les mêmes que les masses isotopiques pour chacun des nucléides naturels uniques de ces éléments) sont connues avec une précision particulièrement élevée. Par exemple, il existe une incertitude de seulement une partie sur 38 millions pour la masse atomique relative du fluor , une précision qui est supérieure à la meilleure valeur actuelle de la constante d'Avogadro (une partie sur 20 millions).
| Isotope | Masse atomique | Abondance | |
|---|---|---|---|
| Standard | Varier | ||
| 28 Si | 27,976 926 532 46 (194) | 92,2297(7)% | 92,21–92,25% |
| 29 Si | 28,976 494 700(22) | 4.6832(5)% | 4,67–4,69% |
| 30 Si | 29.973 770 171(32) | 3,0872(5)% | 3,08-3,10 % |
Le calcul est illustré pour le silicium , dont la masse atomique relative est particulièrement importante en métrologie . Le silicium existe dans la nature sous la forme d'un mélange de trois isotopes : 28 Si, 29 Si et 30 Si. Les masses atomiques de ces nucléides sont connues avec une précision d'une partie sur 14 milliards pour le 28 Si et d'environ une partie sur un milliard pour les autres. Cependant, la gamme d' abondance naturelle des isotopes est telle que l'abondance standard ne peut être donnée qu'à environ ± 0,001 % (voir tableau). Le calcul est
- A r (Si) = (27,97693 × 0,922297) + (28,97649 × 0,046832) + (29,97377 × 0,030872) = 28,0854
L'estimation de l' incertitude est compliquée, d'autant plus que la distribution de l' échantillon n'est pas nécessairement symétrique : les masses atomiques relatives standard IUPAC sont citées avec des incertitudes symétriques estimées, et la valeur pour le silicium est de 28,0855(3). L'incertitude type relative de cette valeur est de 1 × 10 –5 ou 10 ppm. Pour refléter davantage cette variabilité naturelle, en 2010, l'UICPA a pris la décision de répertorier les masses atomiques relatives de 10 éléments sous forme d'intervalle plutôt que de nombre fixe.
Controverse sur le nom
L'utilisation du nom de "poids atomique" a suscité une grande controverse parmi les scientifiques. Les opposants au nom préfèrent généralement le terme « masse atomique relative » (à ne pas confondre avec la masse atomique ). L'objection de base est que le poids atomique n'est pas un poids , c'est-à-dire la force exercée sur un objet dans un champ gravitationnel , mesurée en unités de force telles que le newton ou la livre .
En réponse, les partisans du terme « poids atomique » soulignent (entre autres arguments) que
- le nom a été utilisé en continu pour la même quantité depuis sa première conceptualisation en 1808;
- pendant la plupart de ce temps, les poids atomiques étaient réellement mesurés par pesée (c'est-à-dire par analyse gravimétrique ) et le nom d'une quantité physique ne devrait pas changer simplement parce que la méthode de sa détermination a changé ;
- le terme « masse atomique relative » doit être réservé à la masse d'un nucléide (ou isotope ) spécifique , tandis que « poids atomique » doit être utilisé pour la moyenne pondérée des masses atomiques sur tous les atomes de l'échantillon ;
- il n'est pas rare d'avoir des noms trompeurs de grandeurs physiques qui sont retenus pour des raisons historiques, telles que
- force électromotrice , qui n'est pas une force
- pouvoir de résolution , qui n'est pas une grandeur de puissance
- concentration molaire , qui n'est pas une quantité molaire (une quantité exprimée par quantité unitaire de substance).
On pourrait ajouter que le poids atomique n'est souvent pas vraiment "atomique" non plus, car il ne correspond à la propriété d'aucun atome individuel. Le même argument pourrait être avancé contre la "masse atomique relative" utilisée dans ce sens.
Valeurs publiées
L'IUPAC publie une valeur formelle pour chaque élément stable, appelée poids atomique standard . Toutes les mises à jour sont publiées deux fois par an (les années impaires). En 2015, le poids atomique de l'ytterbium a été mis à jour. En 2017, 14 poids atomiques ont été modifiés, y compris l'argon passant d'un nombre unique à une valeur d'intervalle.
La valeur publiée peut avoir une incertitude, comme pour le néon : 20.1797(6) , ou peut être un intervalle, comme pour le bore : [10.806, 10.821].
À côté de ces 84 valeurs, l'IUPAC publie également des valeurs abrégées (jusqu'à cinq chiffres par numéro uniquement) et pour les douze valeurs d'intervalle, des valeurs conventionnelles (valeurs à un seul numéro).
Le symbole A r est une masse atomique relative, par exemple d'un échantillon spécifique. Pour être précis, le poids atomique standard peut être noté comme A r, standard (E) , où (E) est le symbole de l'élément.
Poids atomique abrégé
Le poids atomique abrégé , également publié par la CIAAW, est dérivé du poids atomique standard réduisant les nombres à cinq chiffres (cinq chiffres significatifs). Le nom ne dit pas "arrondi".
Les bordures d'intervalle sont arrondies vers le bas pour la première bordure (la plus basse) et vers le haut pour la bordure vers le haut (la plus haute). De cette façon, l'intervalle d'origine le plus précis est entièrement couvert.
Exemples:
- Calcium : A r, standard (Ca) = 40,078(4) → A r, abrégé (Ca) = 40,078
- Hélium : A r, standard (He) = 4.002602(2) → A r, abrégé (He) = 4.0026
- Hydrogène : A r, standard (H) = [1.00784, 1.00811] → A r, abrégé (H) = [1.0078, 1.0082]
Poids atomique conventionnel
Treize éléments chimiques ont un poids atomique standard qui est défini non pas comme un nombre unique, mais comme un intervalle. Par exemple, l'hydrogène a A r, standard (H) = [1.00 784, 1.00811] . Cette notation indique que les diverses sources sur Terre ont des constitutions isotopiques sensiblement différentes, et des incertitudes sont incorporées dans les deux nombres. Pour ces éléments, il n'y a pas de constitution 'Terre moyenne', et la 'bonne' valeur n'est pas son milieu (ce serait 1,007975 pour l'hydrogène, avec une incertitude de (±0,000135) qui ferait juste couvrir l'intervalle). Cependant, pour les situations où une valeur moins précise est acceptable, la CIAAW a publié un poids atomique conventionnel à un seul nombre qui peut être utilisé par exemple dans le commerce. Pour l'hydrogène, A r, conventionnel (H) = 1,008 . Les treize éléments sont : l'hydrogène, le lithium, le bore, le carbone, l'azote, l'oxygène, le magnésium, le silicium, le soufre, le chlore, l'argon, le brome et le thallium.
Un poids atomique court formel
En utilisant la valeur abrégée et la valeur conventionnelle pour les treize valeurs d'intervalle, une courte valeur définie par l'IUPAC (5 chiffres plus l'incertitude) peut être donnée pour tous les éléments stables. Dans de nombreuses situations, et dans les tableaux périodiques, cela peut être suffisamment détaillé.
|
Vue d'ensemble : valeurs formelles du poids atomique standard
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Élément
(E) |
A r, norme (E) Tableau 1 |
Type de valeur |
A r, std abrégé (E) Tableau 2 |
A r, std conventionnel (E) Tableau 3 |
A r, std formel court (E) Tableaux 2 et 3 |
Nombre de masse [isotope le plus stable] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| hydrogène | 1 heure | [1.007 84 , 1.008 11 ] | Intervalle | [1.0078 , 1.0082 ] | 1.008 | 1.008 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| azote | 7 N | [14.006 43 , 14.007 28 ] | Intervalle | [14.006 , 14.008 ] | 14.007 | 14.007 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| fluor | 9 F | 18,998 403 163 (6) | Valeur (incertitude) | 18.998 | 18.998 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| calcium | 20 ca | 40.078(4) | Valeur (incertitude) | 40.078(4) | 40.078(4) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| technétium | 43 Tc | (rien) | Isotope le plus stable | [97] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Liste des poids atomiques
| Z | symbole | Nom | A r, norme | abrégé | conventionnel | → formel, court | l'année a changé |
|---|---|---|---|---|---|---|---|
| 1 | H | hydrogène | [1.007 84 , 1.008 11 ] | [1.0078 , 1.0082 ] | 1.008 | 1.008 | 2009 |
| 2 | Il | hélium | 4.002 602 (2) | 4.0026 | 4.0026 | 1983 | |
| 3 | Li | lithium | [6.938 , 6.997 ] | [6.938 , 6.997 ] | 6,94 | 6,94 | 2009 |
| 4 | Être | béryllium | 9,012 1831 (5) | 9.0122 | 9.0122 | 2013 | |
| 5 | B | bore | [10.806 , 10.821 ] | [10.806 , 10.821 ] | 10,81 | 10,81 | 2009 |
| 6 | C | carbone | [12.0096 , 12.0116 ] | [12.009 , 12.012 ] | 12.011 | 12.011 | 2009 |
| 7 | N | azote | [14.006 43 , 14.007 28 ] | [14.006 , 14.008 ] | 14.007 | 14.007 | 2009 |
| 8 | O | oxygène | [15.999 03 , 15.999 77 ] | [15.999 , 16.000 ] | 15.999 | 15.999 | 2009 |
| 9 | F | fluor | 18,998 403 163 (6) | 18.998 | 18.998 | 2013 | |
| dix | Ne | néon | 20.1797(6) | 20.180 | 20.180 | 1985 | |
| 11 | N / A | sodium | 22.989 769 28 (2) | 22.990 | 22.990 | 2005 | |
| 12 | mg | magnésium | [24.304 , 24.307 ] | [24.304 , 24.307 ] | 24.305 | 24.305 | 2011 |
| 13 | Al | aluminium | 26,981 5384 (3) | 26,982 | 26,982 | 2017 | |
| 14 | Si | silicium | [28.084 , 28.086 ] | [28.084 , 28.086 ] | 28.085 | 28.085 | 2009 |
| 15 | P | phosphore | 30,973 761 998 (5) | 30.974 | 30.974 | 2013 | |
| 16 | S | soufre | [32.059 , 32.076 ] | [32.059 , 32.076 ] | 32.06 | 32.06 | 2009 |
| 17 | Cl | chlore | [35.446 , 35.457 ] | [35.446 , 35.457 ] | 35.45 | 35.45 | 2009 |
| 18 | Ar | argon | [39,792 , 39.963 ] | [39,792 , 39.963 ] | 39,95 | 39,95 | 2017 |
| 19 | K | potassium | 39.0983(1) | 39.098 | 39.098 | 1979 | |
| 20 | Californie | calcium | 40.078(4) | 40.078(4) | 40.078(4) | 1983 | |
| 21 | Sc | scandium | 44.955 908 (5) | 44.956 | 44.956 | 2013 | |
| 22 | Ti | titane | 47.867(1) | 47.867 | 47.867 | 1993 | |
| 23 | V | vanadium | 50.9415(1) | 50,942 | 50,942 | 1977 | |
| 24 | Cr | chrome | 51.9961(6) | 51.996 | 51.996 | 1983 | |
| 25 | Mn | manganèse | 54,938 043 (2) | 54,938 | 54,938 | 2017 | |
| 26 | Fe | le fer | 55,845(2) | 55,845(2) | 55,845(2) | 1993 | |
| 27 | Co | cobalt | 58,933 194 (3) | 58,933 | 58,933 | 2017 | |
| 28 | Ni | nickel | 58.6934(4) | 58.693 | 58.693 | 2007 | |
| 29 | Cu | cuivre | 63,546(3) | 63,546(3) | 63,546(3) | 1969 | |
| 30 | Zn | zinc | 65.38(2) | 65.38(2) | 65.38(2) | 2007 | |
| 31 | Géorgie | gallium | 69,723(1) | 69,723 | 69,723 | 1987 | |
| 32 | Gé | germanium | 72.630(8) | 72.630(8) | 72.630(8) | 2009 | |
| 33 | Comme | arsenic | 74,921 595 (6) | 74,922 | 74,922 | 2013 | |
| 34 | Se | sélénium | 78.971(8) | 78.971(8) | 78.971(8) | 2013 | |
| 35 | Br | brome | [79.901 , 79.907 ] | [79.901 , 79.907 ] | 79.904 | 79.904 | 2011 |
| 36 | Kr | krypton | 83.798(2) | 83.798(2) | 83.798(2) | 2001 | |
| 37 | Rb | rubidium | 85.4678(3) | 85,468 | 85,468 | 1969 | |
| 38 | Sr | strontium | 87.62(1) | 87,62 | 87,62 | 1969 | |
| 39 | Oui | yttrium | 88.905 84 (1) | 88.906 | 88.906 | 2017 | |
| 40 | Zr | zirconium | 91.224(2) | 91.224(2) | 91.224(2) | 1983 | |
| 41 | Nb | niobium | 92.906 37 (1) | 92.906 | 92.906 | 2017 | |
| 42 | Mo | molybdène | 95,95(1) | 95,95 | 95,95 | 2013 | |
| 43 | Tc | technétium | - | - | |||
| 44 | Ru | ruthénium | 101.07(2) | 101.07(2) | 101.07(2) | 1983 | |
| 45 | Rhésus | rhodium | 102.905 49 (2) | 102,91 | 102,91 | 2017 | |
| 46 | PD | palladium | 106.42(1) | 106,42 | 106,42 | 1979 | |
| 47 | Ag | argent | 107.8682(2) | 107,87 | 107,87 | 1985 | |
| 48 | CD | cadmium | 112.414(4) | 112,41 | 112,41 | 2013 | |
| 49 | Dans | indium | 114.818(1) | 114,82 | 114,82 | 2011 | |
| 50 | Sn | étain | 118.710(7) | 118.71 | 118.71 | 1983 | |
| 51 | Sb | antimoine | 121.760(1) | 121.76 | 121.76 | 1993 | |
| 52 | Te | tellure | 127.60(3) | 127.60(3) | 127.60(3) | 1969 | |
| 53 | je | iode | 126.904 47 (3) | 126,90 | 126,90 | 1985 | |
| 54 | Xe | xénon | 131.293(6) | 131,29 | 131,29 | 1999 | |
| 55 | Cs | césium | 132.905 451 96 (6) | 132,91 | 132,91 | 2013 | |
| 56 | Ba | baryum | 137.327(7) | 137,33 | 137,33 | 1985 | |
| 57 | La | lanthane | 138,905 47 (7) | 138,91 | 138,91 | 2005 | |
| 58 | Ce | cérium | 140.116(1) | 140.12 | 140.12 | 1995 | |
| 59 | Pr | praséodyme | 140.907 66 (1) | 140,91 | 140,91 | 2017 | |
| 60 | nd | néodyme | 144.242(3) | 144,24 | 144,24 | 2005 | |
| 61 | après-midi | prométhium | - | - | |||
| 62 | SM | samarium | 150.36(2) | 150.36(2) | 150.36(2) | 2005 | |
| 63 | UE | europium | 151.964(1) | 151,96 | 151,96 | 1995 | |
| 64 | Dieu | gadolinium | 157.25(3) | 157.25(3) | 157.25(3) | 1969 | |
| 65 | To | terbium | 158,925 354 (8) | 158,93 | 158,93 | 2017 | |
| 66 | Dy | dysprosium | 162.500(1) | 162,50 | 162,50 | 2001 | |
| 67 | Ho | holmium | 164,930 328 (7) | 164,93 | 164,93 | 2017 | |
| 68 | Euh | erbium | 167.259(3) | 167,26 | 167,26 | 1999 | |
| 69 | Tm | thulium | 168,934 218 (6) | 168.93 | 168.93 | 2017 | |
| 70 | Yb | ytterbium | 173.045(10) | 173.05 | 173.05 | 2015 | |
| 71 | Lu | lutécium | 174.9668(1) | 174,97 | 174,97 | 2007 | |
| 72 | Hf | hafnium | 178.486(6) | 178,49 | 178.49(2) | 2019 | |
| 73 | Ta | tantale | 180.947 88 (2) | 180,95 | 180,95 | 2005 | |
| 74 | W | tungstène | 183,84(1) | 183,84 | 183,84 | 1991 | |
| 75 | Ré | rhénium | 186.207(1) | 186.21 | 186.21 | 1973 | |
| 76 | Os | osmium | 190.23(3) | 190.23(3) | 190.23(3) | 1991 | |
| 77 | Je | iridium | 192.217(2) | 192.22 | 192.22 | 2017 | |
| 78 | pt | platine | 195.084(9) | 195.08 | 195.08 | 2005 | |
| 79 | Au | or | 196.966 570 (4) | 196,97 | 196,97 | 2017 | |
| 80 | Hg | Mercure | 200.592(3) | 200.59 | 200.59 | 2011 | |
| 81 | Tl | thallium | [204.382 , 204.385 ] | [204.38 , 204.39 ] | 204,38 | 204,38 | 2009 |
| 82 | Pb | conduire | [206.14 , 207.94 ] | [206.14 , 207.94 ] | 207,2 ± 1,1 | 207,2 ± 1,1 | 2021 |
| 83 | Bi | bismuth | 208.980 40 (1) | 208.98 | 208.98 | 2005 | |
| 84 | Pô | polonium | - | - | |||
| 85 | À | astate | - | - | |||
| 86 | Rn | radon | - | - | |||
| 87 | Fr | francium | - | - | |||
| 88 | Ra | radium | - | - | |||
| 89 | c.a. | actinium | - | - | |||
| 90 | E | thorium | 232.0377(4) | 232.04 | 232.04 | 2013 | |
| 91 | Pennsylvanie | protactinium | 231,035 88 (1) | 231.04 | 231.04 | 2017 | |
| 92 | U | uranium | 238,028 91 (3) | 238.03 | 238.03 | 1999 | |
| 93 | Np | neptunium | - | - | |||
| 94 | Pu | plutonium | - | - | |||
| 95 | Un m | américium | - | - | |||
| 96 | Cm | curium | - | - | |||
| 97 | Noir | berkélium | - | - | |||
| 98 | Cf. | Californie | - | - | |||
| 99 | Es | einsteinium | - | - | |||
| 100 | FM | fermium | - | - | |||
| 101 | Maryland | mendelevium | - | - | |||
| 102 | Non | nobélium | - | - | |||
| 103 | G / D | lawrencium | - | - | |||
| 104 | Rf | rutherfordium | - | - | |||
| 105 | DB | dubnium | - | - | |||
| 106 | Sg | seaborgium | - | - | |||
| 107 | Bh | bohème | - | - | |||
| 108 | hs | hassium | - | - | |||
| 109 | Mont | meitnerium | - | - | |||
| 110 | DS | darmstadtium | - | - | |||
| 111 | Rg | roentgenium | - | - | |||
| 112 | Cn | copernicium | - | - | |||
| 113 | Nh | nihonium | - | - | |||
| 114 | Fl | flérovium | - | - | |||
| 115 | Mc | Moscou | - | - | |||
| 116 | Niv | foiemorium | - | - | |||
| 117 | Ts | tennessine | - | - | |||
| 118 | Og | oganesson | - | - | |||
Dans le tableau périodique
Voir également
- Union internationale de chimie pure et appliquée (UICPA)
- Commission sur les abondances isotopiques et les poids atomiques (CIAAW)

