Organosulfate - Organosulfate
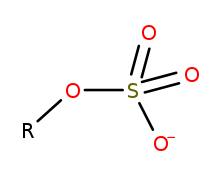
Les organosulfates sont une classe de composés organiques partageant un groupe fonctionnel commun avec la structure RO-SO 3 - . Le noyau SO 4 est un groupe sulfate et le groupe R est tout résidu organique. Tous les organosulfates sont formellement des esters dérivés d' alcools et d'acide sulfurique , bien que beaucoup ne soient pas préparés de cette manière. De nombreux esters de sulfate sont utilisés dans les détergents, et certains sont des réactifs utiles . Les alkylsulfates sont constitués d'une chaîne hydrocarbonée hydrophobe , d'un groupe sulfate polaire (contenant un anion) et d'un cation ou d'une amine pour neutraliser le groupe sulfate. Les exemples incluent: le laurylsulfate de sodium (également connu sous le nom de sel de sodium de monodécylester d'acide sulfurique) et les sels de potassium et d'ammonium associés.
Applications
Les sulfates d'alkyle sont couramment utilisés comme tensioactifs anioniques dans les savons liquides et les détergents utilisés pour nettoyer la laine, comme nettoyants de surface et comme ingrédients actifs dans les détergents à lessive, les shampooings et les revitalisants. Ils peuvent également être trouvés dans les produits ménagers tels que le dentifrice, les antiacides, les cosmétiques et les aliments. En général, ils se retrouvent dans les produits de consommation à des concentrations allant de 3 à 20%. En 2003, environ 118 000 t / an d'alkylsulfates ont été utilisés aux États-Unis.
Organosulfates synthétiques
Un exemple courant est le laurylsulfate de sodium , de formule CH 3 (CH 2 ) 11 OSO 3 Na. Les esters sulfatés d' alcools gras éthoxylés tels que ceux dérivés de l' alcool laurylique sont également courants dans les produits de consommation . Un exemple est le laureth sulfate de sodium , un ingrédient de certains cosmétiques .
L'alkylsulfate peut être produit à partir d'alcools, qui à leur tour sont obtenus par hydrogénation d'huiles et de graisses animales ou végétales ou en utilisant le procédé Ziegler ou par oxo-synthèse . Si elle est produite à partir d'une charge oléochimique ou du procédé Ziegler, la chaîne hydrocarbonée de l'alcool sera linéaire. S'il est dérivé en utilisant le procédé oxo, un faible niveau de ramification apparaîtra habituellement avec un groupe méthyle ou éthyle en position C-2, contenant des quantités paires et impaires de chaînes alkyle. Ces alcools réagissent avec l'acide chlorosulfurique :
- ClSO 3 H + ROH → ROSO 3 H + HCl
En variante, les alcools peuvent être convertis en esters demi-sulfate en utilisant du trioxyde de soufre :
- SO 3 + ROH → ROSO 3 H
Certains organosulfates peuvent être préparés par l' oxydation au persulfate d'Elbs des phénols et l' oxydation Boyland – Sims des anilines.
Dialkylsulfates
Une famille d'organosulfates moins courante a la formule RO-SO 2 -O-R '. Ils sont préparés à partir d'acide sulfurique et d'alcool. Les principaux exemples sont le sulfate de diéthyle et le sulfate de diméthyle , des liquides incolores qui sont utilisés comme réactifs dans la synthèse organique . Ces composés sont des agents alkylants potentiellement dangereux .
Esters de sulfate naturels
La réduction du sulfate dans la nature implique la formation d'un ou parfois deux esters de sulfate, l'adénosine 5'-phosphosulfate (APS) et le 3'-phosphoadénosine-5'-phosphosulfate (PAPS). Le sulfate est un anion inerte, donc la nature l'active par la formation de ces dérivés esters, qui sont susceptibles de se réduire en sulfite. De nombreux organismes utilisent ces réactions à des fins métaboliques ou pour la biosynthèse des composés soufrés nécessaires à la vie.
Sécurité
Parce qu'ils sont largement utilisés dans les produits commerciaux, les aspects de sécurité des organosulfates sont largement étudiés.
Santé humaine
Les sulfates d'alkyle, s'ils sont ingérés, sont bien absorbés et sont métabolisés en un sulfate en C 3 , C 4 ou C 5 et un métabolite supplémentaire. L'irritant le plus élevé des alkylsulfates est le laurylsulfate de sodium, le seuil avant l'irritation étant à une concentration de 20%. Les surfactants dans les produits de consommation sont généralement mélangés, ce qui réduit le risque d'irritation. Selon l' OCDE TG 406, les sulfates d'alkyle dans les études sur les animaux ne se sont pas avérés sensibilisants cutanés.
Les études en laboratoire n'ont pas révélé que les sulfates d'alkyle étaient génotoxiques , mutagènes ou cancérigènes . Aucun effet à long terme sur la reproduction n'a été trouvé.
Environnement
La principale élimination de l'alkylsulfate des produits commerciaux usagés est les eaux usées. La concentration d'alkylsulfates dans les effluents des stations d'épuration des eaux usées (STEP) a été mesurée à 10 microgrammes par litre (5,8 × 10 −9 oz / cu in) et moins. Les sulfates d'alkyle se biodégradent facilement, même en commençant probablement avant d'atteindre la station d'épuration. Une fois à la station d'épuration, ils sont rapidement éliminés par biodégradation . Les invertébrés sont le groupe trophique le plus sensible aux sulfates d'alkyle. Le laurylsulfate de sodium testé sur Uronema parduczi , un protozoaire, s'est avéré avoir la valeur d'effet la plus faible, le 20 h-EC5 étant de 0,75 milligrammes par litre (4,3 × 10 -7 oz / cu in). Des tests d'exposition chronique avec du C 12 à C 18 avec l'invertébré Ceriodaphnia dubia ont révélé que la toxicité la plus élevée était avec le C 14 (la CSEO était de 0,045 mg / l).
En termes de stabilité thermique, les alkylsulfates se dégradent bien avant d'atteindre leur point d'ébullition en raison de la faible pression de vapeur (pour C 8-18 de 10-11 à 10-15 hPa). La sorption du sol est proportionnelle à la longueur de la chaîne de carbone, avec une longueur de 14 et plus ayant le taux de sorption le plus élevé. On a constaté que les concentrations dans le sol variaient de 0,0035 à 0,21 milligramme par kilogramme (5,6 × 10 -8 à 3,4 × 10 -6 oz / lb) ps.
Les références
-
^
CEH (octobre 2004). "Tensioactifs, détergents ménagers et leurs matières premières". Rapport de recherche marketing CEH . Manquant ou vide
|url=( aide ) - ^ Eduard Smulders, Wolfgang von Rybinski, Eric Sung, Wilfried Rähse, Josef Steber, Frederike Wiebel, Anette Nordskog "Détergents de blanchisserie" dans l'Encyclopédie d'Ullmann de chimie industrielle 2007, Wiley-VCH, Weinheim. doi : 10.1002 / 14356007.a08_315.pub2 .
- ^ Klaus Noweck, Wolfgang Grafahrend, "Alcools Gras" dans l'Encyclopédie d'Ullmann de Chimie Industrielle 2006, Wiley-VCH, Weinheim. doi : 10.1002 / 14356007.a10_277.pub2
- ^ Kosswig, Kurt (2000). "Tensioactifs". Encyclopédie Ullmann de chimie industrielle . Weinheim: Wiley-VCH. doi : 10.1002 / 14356007.a25_747 .
- ^ MT Madigan, JM Martinko, J. Parker "Brock Biologie des Microorganismes" Prentice Hall, 1997. ISBN 0-13-520875-0 .
- ^ un b SDA / Consortium d'alkylsulfate (2007). «Profil d'évaluation initiale du SMSN. SIAM 25: sulfates d'alkyle, sulfonates d'alcane et sulfonates d'α-oléfine» (PDF) . PEID de l'OCDE . Helsinki.
- ^ DE / ICCA (2009). «Profil d'évaluation initiale de SIDS SIAM 25: sulfates d'alkyle, sulfonates d'alcane et sulfonates d'α-oléfine» . OCDE .
- ^ Wibbertmann, A; Mangelsdorf, I .; Gamon, K .; Sedlak, R. (2011). "Propriétés toxicologiques et évaluation des risques de la catégorie des tensioactifs anioniques: sulfates d'alkyle, sulfonates d'alcane primaire et sulfonate d'α-oléfine". Écotoxicologie et sécurité environnementale . 74 (5): 1089-1106. doi : 10.1016 / j.ecoenv.2011.02.007 .