Imagerie pondérée en susceptibilité - Susceptibility weighted imaging
L'imagerie pondérée en fonction de la susceptibilité ( SWI ), appelée à l'origine imagerie phlébographique BOLD, est une séquence d'IRM extrêmement sensible au sang veineux, aux hémorragies et au stockage du fer. SWI utilise une séquence d'impulsions à écho long, à écho de gradient (GRE) entièrement compensé en débit pour acquérir des images. Cette méthode exploite les différences de sensibilité entre les tissus et utilise l'image de phase pour détecter ces différences. Les données d'amplitude et de phase sont combinées pour produire une image d'amplitude de contraste améliorée. L'imagerie du sang veineux avec SWI est une technique dépendante du niveau d'oxygène dans le sang (BOLD), c'est pourquoi elle était (et est parfois encore) appelée phlébographie BOLD. En raison de sa sensibilité au sang veineux, le SWI est couramment utilisé dans les lésions cérébrales traumatiques (TCC) et pour les phlébographies cérébrales à haute résolution, mais a de nombreuses autres applications cliniques. SWI est proposé sous forme de package clinique par Philips et Siemens, mais peut être exécuté sur n'importe quelle machine de fabricant à des intensités de champ de 1,0 T, 1,5 T, 3,0 T et plus.
Acquisition et traitement d'images
SWI utilise un balayage d'écho à rappel de gradient (GRE) 3D entièrement compensé en vitesse, gâché par RF, haute résolution. Les images d'amplitude et de phase sont toutes deux enregistrées, et l'image de phase est filtrée passe-haut (HP) pour supprimer les artefacts indésirables. L'image d'amplitude est ensuite combinée avec l'image de phase pour créer une image d'amplitude à contraste amélioré appelée image pondérée en fonction de la sensibilité (SW). Il est également courant de créer des projections d'intensité minimale (mIP) sur 8 à 10 mm pour mieux visualiser la connectivité veineuse. De cette manière, quatre ensembles d'images sont générés, la magnitude d'origine, la phase filtrée HP, la sensibilité pondérée et les mIP sur les images pondérées de la sensibilité.
Filtrage des phases
Les valeurs dans les images de phase sont contraintes de -π à , donc si la valeur dépasse π, elle passe à -π, des inhomogénéités dans le champ magnétique provoquent des gradients de fond à basse fréquence. Cela provoque une augmentation lente de toutes les valeurs de phase sur l'image, ce qui crée un enroulement de phase et obscurcit l'image. Ce type d'artefact peut être supprimé par dépliage de phase ou par filtrage passe-haut des données complexes d'origine pour supprimer les variations de basse fréquence dans l'image de phase.
Création d'images pondérées par la sensibilité
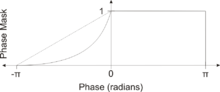
L'image pondérée en susceptibilité est créée en combinant les images d'amplitude et de phase filtrée. Un masque est créé à partir de l'image de phase en mappant toutes les valeurs au-dessus de 0 radians à 1 et en mappant linéairement les valeurs de -π à 0 radians pour aller de 0 à 1, respectivement. Alternativement, une fonction puissance (généralement 4e degré) peut être utilisée à la place d'un mappage linéaire de -π à 0 pour augmenter l'effet du masque. L'image de magnitude est ensuite multipliée par ce masque. De cette façon, les valeurs de phase supérieures à 0 radians n'ont aucun effet et les valeurs de phase inférieures à 0 radians assombrissent l'image de magnitude. Cela augmente le contraste de l'image de magnitude pour les objets avec de faibles valeurs de phase tels que les veines, le fer et les hémorragies.
Applications cliniques
SWI est le plus souvent utilisé pour détecter de petites quantités d'hémorragie ou de calcium. Des applications cliniques sont en cours de recherche dans différents domaines de la médecine.
Lésion cérébrale traumatique (TCC)
La détection des micro-hémorragies, du cisaillement et des lésions axonales diffuses (DAI) chez les patients traumatisés est souvent difficile car les lésions ont tendance à être de taille relativement petite et peuvent être facilement ignorées par des scans à faible résolution. SWI est généralement exécuté à une résolution relativement élevée (1 mm 3 ) et est extrêmement sensible aux saignements dans les limites substance grise/substance blanche, ce qui permet de voir de très petites lésions, ce qui augmente la capacité de détecter des blessures plus subtiles.
AVC et hémorragie
L'imagerie pondérée en diffusion offre un moyen puissant de détecter un AVC aigu. Bien qu'il soit bien connu que l'imagerie par écho de gradient puisse détecter une hémorragie, elle est mieux détectée avec le SWI. Dans l'exemple présenté ici, l'image en écho de gradient montre la région de probable œdème cytotoxique alors que l'image SW montre la localisation probable de l'AVC et le territoire vasculaire affecté (données acquises à 1,5 T).
La région claire de l'image pondérée en écho de gradient montre la zone affectée dans cet exemple d'AVC aigu. Les flèches dans l'image SWI peuvent montrer le tissu à risque qui a été affecté par l'AVC (A, B, C) et l'emplacement de l'AVC lui-même (D). La raison pour laquelle nous sommes en mesure de voir le territoire vasculaire affecté pourrait être parce qu'il y a un niveau réduit de saturation en oxygène dans ce tissu, ce qui suggère que le flux vers cette région du cerveau pourrait être réduit après un AVC. Une autre explication possible est qu'il y a une augmentation du volume sanguin veineux local. Dans les deux cas, cette image suggère que le tissu associé à ce territoire vasculaire pourrait être un tissu à risque. Les futures recherches sur l'AVC impliqueront des comparaisons de l'imagerie pondérée par perfusion et du SWI pour en savoir plus sur le débit local et la saturation en oxygène.
Maladie de Sturge-Weber
Une phlébographie SWI d'un nouveau-né atteint du syndrome de Sturge-Weber qui n'a pas présenté de symptômes neurologiques est montrée à droite. Les premières méthodes conventionnelles d'imagerie par résonance magnétique n'ont montré aucune anomalie. La vascularisation veineuse anormale du lobe occipital gauche s'étendant entre la corne postérieure du ventricule et la surface corticale est clairement visible sur la phlébographie. En raison de la haute résolution, même les garanties peuvent être résolues.
Tumeurs
Une partie de la caractérisation des tumeurs réside dans la compréhension du comportement angiographique des lésions tant du point de vue de l'angiogenèse que des micro-hémorragies. Les tumeurs agressives ont tendance à avoir une vascularisation à croissance rapide et de nombreuses micro-hémorragies. Par conséquent, la capacité de détecter ces changements dans la tumeur pourrait conduire à une meilleure détermination du statut tumoral. La sensibilité accrue du SWI au sang veineux et aux produits sanguins en raison de leurs différences de sensibilité par rapport au tissu normal conduit à un meilleur contraste dans la détection des limites tumorales et de l'hémorragie tumorale.
Sclérose en plaque
La sclérose en plaques (SEP) est généralement étudiée avec FLAIR et l'imagerie T1 à contraste amélioré. SWI ajoute à cela en révélant la connectivité veineuse dans certaines lésions et présente des preuves de fer dans certaines lésions. Ces nouvelles informations clés peuvent aider à comprendre la physiologie de la SEP.
La fréquence de résonance magnétique mesurée avec un balayage SWI s'est avérée sensible à la formation de lésions MS. La fréquence augmente des mois avant qu'une nouvelle lésion n'apparaisse sur un scanner à contraste amélioré. Au moment de la prise de contraste, la fréquence augmente rapidement et reste élevée pendant au moins six mois.
Démence vasculaire et angiopathie amyloïde cérébrale (AAC)
L'imagerie par écho de rappel de gradient (GRE) est le moyen conventionnel de détecter une hémorragie dans l' AAC , mais le SWI est une technique beaucoup plus sensible qui peut révéler de nombreuses micro-hémorragies qui sont manquées sur les images GRE. Une image conventionnelle pondérée en écho de gradient T2* (à gauche, TE=20 ms) montre quelques foyers à faible signal associés à la CAA. D'autre part, une image SWI (au centre, avec une résolution de 0,5 mm x 0,5 mm x 2,0 mm, projetée sur 8 mm) montre de nombreux autres foyers à faible signal associés. Des images de phase ont été utilisées pour renforcer l'effet de l'accumulation locale d'hémosidérine. Un exemple d'image de phase (à droite) avec une résolution encore plus élevée de 0,25 mm x 0,25 mm x 2,0 mm montre une capacité claire à localiser plusieurs foyers associés à la CAA.
Pneumocéphalie
Des études récentes suggèrent que SWI pourrait être adapté pour surveiller les patients neurochirurgicaux se remettant d'une pneumocéphalie , car l'air peut être facilement détecté avec SWI.
SWI haut champ
SWI est particulièrement bien adapté pour tirer parti des systèmes à champ plus élevé, car le contraste dans l'image de phase est linéairement proportionnel au temps d'écho (TE) et à l'intensité du champ. Des champs plus élevés permettent ainsi des temps d'écho plus courts sans perte de contraste, ce qui peut réduire le temps de balayage et les artefacts liés au mouvement. Le rapport signal/bruit élevé disponible à des champs plus élevés augmente également la qualité de numérisation et permet des numérisations à plus haute résolution.
Voir également
Liens externes
- Brochures d'information SWI, y compris le logiciel SWI
- Étude pilote IRM-CCSVI avec MRA et SWI
- BELLE IRM
- Institut IRM pour la recherche biomédicale
Notes de bas de page
Les références
- Ashwal S, et al. (2008). « Imagerie pondérée en fonction de la sensibilité et spectroscopie de résonance magnétique des protons dans l'évaluation des résultats après un traumatisme crânien pédiatrique ». Arch Phys Med Rehabil . 87 (12 Suppl 2) : S50–8. doi : 10.1016/j.apmr.2006.07.275 . PMID 17140880 .
- Barth M, et al. (2003). « Phlébographie par résonance magnétique dépendant du niveau d'oxygénation du sang en trois dimensions à haute résolution de tumeurs cérébrales à 3 Tesla : première expérience clinique et comparaison avec 1,5 Tesla ». Investir Radiol . 38 (7) : 409–14. doi : 10.1097/01.RLI.0000069790.89435.e7 . PMID 12821854 . S2CID 25855019 .
- Deistung A, et al. (2008). « Imagerie pondérée en susceptibilité à des intensités de champ magnétique ultra élevées : considérations théoriques et résultats expérimentaux » . Magn Reson Med . 60 (5) : 1155-168. doi : 10.1002/mrm.21754 . PMID 18956467 .
- Denk & Rauscher, A (2010). "Imagerie pondérée en susceptibilité avec échos multiples" . Journal d'imagerie par résonance magnétique . 31 (1) : 185-91. doi : 10.1002/jmri.21995 . PMID 20027586 .
- de Souza JM, et al. (2008). "Imagerie pondérée en susceptibilité pour l'évaluation des patients atteints de malformations cérébrales caverneuses familiales : une comparaison avec des séquences d'écho de spin rapide et d'écho de gradient pondérées en t" . Suis J Neuroradiol . 29 (1) : 154–8. doi : 10.3174/ajnr.A0748 . PMC 8119083 . PMID 17947370 .
- Haacke EM, et al. (2005). « Imagerie des réserves de fer dans le cerveau à l'aide de l'imagerie par résonance magnétique ». Imagerie Magn Reson . 23 (1) : 1–25. doi : 10.1016/j.mri.2004.10.001 . PMID 15733784 .
- Haacke EM, et al. (2009). "Imagerie de susceptibilité pondérée : aspects techniques et applications cliniques, partie 1" . Suis J Neuroradiol . 30 (1) : 19-30. doi : 10.3174/ajnr.A1400 . PMC 3805391 . PMID 19039041 .
- Mittal S, et al. (2009). « Imagerie pondérée en fonction de la sensibilité : aspects techniques et applications cliniques, partie 2 » . Suis J Neuroradiol . 30 (2) : 232-52. doi : 10.3174/ajnr.A1461 . PMC 3805373 . PMID 19131406 .
- Rauscher A, et al. (1er avril 2005). "Imagerie de phase IRM pondérée en susceptibilité magnétique du cerveau humain" . Suis J Neuroradiol . 26 (4) : 736–42. PMC 7977092 . PMID 15814914 .
- Reichenbach JR, et al. (1 juillet 1997). « Petits vaisseaux dans le cerveau humain : phlébographie MR avec désoxyhémoglobine comme agent de contraste intrinsèque ». Radiologie . 204 (1) : 272-7. doi : 10.1148/radiology.204.1.9205259 . PMID 9205259 .
- Reichenbach JR, et al. (2000). " Phlébographie MR haute résolution à 3,0 Tesla " . J Comput Assist Tomogr . 24 (6) : 949-57. doi : 10.1097/00004728-200011000-00023 . PMID 11105717 . S2CID 37704005 .
- Reichenbach JR, et al. (2001). « Imagerie phlébographique BOLD haute résolution : une fenêtre sur la fonction cérébrale » . RMN Biomed . 14 (7-8): 453-67. doi : 10.1002/nbm.722 . PMID 11746938 .
- Sedlacik J, et al. (2007). "Obtenir des niveaux d'oxygénation du sang à partir du comportement du signal MR en présence de vaisseaux veineux uniques" . Magn Reson Med . 58 (5) : 1035-1044. doi : 10.1002/mrm.21283 . PMID 17969121 .
- Sehgal V, et al. (2005). "Applications cliniques de la neuroimagerie avec imagerie pondérée en susceptibilité" . Imagerie J Magn Reson . 22 (4) : 439-50. doi : 10.1002/jmri.20404 . PMID 16163700 .
- Sehgal V, et al. (2006). « Imagerie pondérée en fonction de la sensibilité pour visualiser les produits sanguins et améliorer le contraste tumoral dans l'étude des masses cérébrales ». Imagerie J Magn Reson . 24 (1) : 41-51. doi : 10.1002/jmri.20598 . PMID 16755540 . S2CID 34669397 .
- Thomas B, et al. (2008). « Applications cliniques de l'imagerie par résonance magnétique pondérée en fonction de la sensibilité du cerveau - une revue picturale ». Neuroradiologie . 50 (2) : 105-16. doi : 10.1007/s00234-007-0316-z . PMID 17929005 . S2CID 12492779 .
- Tong K, et al. (2008). « Imagerie par résonance magnétique pondérée en fonction de la susceptibilité : une revue des applications cliniques chez l'enfant » . Suis J Neuroradiol . 29 (1) : 9-17. doi : 10.3174/ajnr.A0786 . PMC 8119104 . PMID 17925363 .
- Wiggermann, et al. (2013). « Déplacements de fréquence de résonance magnétique pendant la formation de lésions aiguës de la SEP » . Neurologie . 81 (2) : 211-218. doi : 10.1212/WNL.0b013e31829bfd63 . PMC 3770162 . PMID 23761621 .
- Le juge Palma et al. (2009). « Pneumocéphalie imitant les malformations caverneuses cérébrales en imagerie pondérée en fonction de la sensibilité IRM » . AJNR Am J Neuroradiol . 30 (6) : e83. doi : 10.3174/ajnr.A1549 . PMC 7051328 . PMID 19342538 .