Tendon -Tendon
| Tendon | |
|---|---|
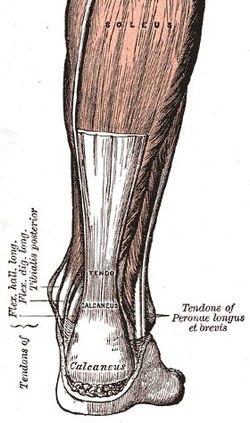
| |
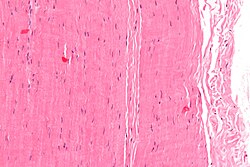
Micrographie d'un morceau de tendon ; Tache H&E
| |
| Des détails | |
| Identifiants | |
| Latin | tendon |
| Engrener | D013710 |
| E | H3.03.00.0.00020 |
| FMA | 9721 |
| Terminologie anatomique | |
Un tendon ou un tendon est une bande dure et à haute résistance à la traction de tissu conjonctif fibreux dense qui relie le muscle à l'os . Il est capable de transmettre efficacement les forces mécaniques de contraction musculaire au système squelettique sans sacrifier sa capacité à résister à des tensions importantes .
Les tendons sont semblables aux ligaments ; les deux sont faits de collagène . Les ligaments relient un os à un autre, tandis que les tendons relient le muscle à l'os.
Structure
Histologiquement , les tendons sont constitués de tissu conjonctif dense et régulier . Les principaux composants cellulaires des tendons sont des fibroblastes spécialisés appelés cellules tendineuses (ténocytes). Les ténocytes synthétisent la matrice extracellulaire des tendons, abondante en fibres de collagène denses . Les fibres de collagène sont parallèles entre elles et organisées en faisceaux tendineux. Les fascicules individuels sont liés par l' endotendinum , qui est un tissu conjonctif lâche délicat contenant de fines fibrilles de collagène et des fibres élastiques. Des groupes de fascicules sont délimités par l' épiténon , qui est une gaine de tissu conjonctif dense et irrégulier . L'ensemble du tendon est entouré d'un fascia . L'espace entre le fascia et le tissu tendineux est rempli de paratenon , un tissu adipeux aréolaire . Les tendons sains normaux sont ancrés à l'os par les fibres de Sharpey .
Matrice extracellulaire
La masse sèche des tendons normaux, qui représente 30 à 45 % de leur masse totale, est composée de :
- 60-85% collagène
- 60-80% collagène I
- 0-10% collagène III
- 2 % de collagène IV
- de petites quantités de collagènes V, VI et autres
- 15 à 40 % de composants de la matrice extracellulaire non collagène, dont :
- 3% de protéine de matrice oligomérique de cartilage ,
- 1-2% d'élastine ,
- 1 à 5 % de protéoglycanes ,
- 0,2 % de composants inorganiques tels que le cuivre , le manganèse et le calcium .
Alors que le collagène de type I constitue la majeure partie du collagène du tendon, de nombreux collagènes mineurs sont présents et jouent un rôle vital dans le bon développement et le bon fonctionnement du tendon. Ceux-ci comprennent le collagène de type II dans les zones cartilagineuses , le collagène de type III dans les fibres de réticuline des parois vasculaires, le collagène de type IX, le collagène de type IV dans les membranes basales des capillaires , le collagène de type V dans les parois vasculaires et le collagène de type X dans le fibrocartilage minéralisé près de l'interface avec l'os.
Ultrastructure et synthèse de collagène
Les fibres de collagène fusionnent en macroagrégats . Après sécrétion de la cellule, clivée par les protéases N- et C- du procollagène , les molécules de tropocollagène s'assemblent spontanément en fibrilles insolubles. Une molécule de collagène mesure environ 300 nm de long et 1 à 2 nm de large, et le diamètre des fibrilles qui se forment peut varier de 50 à 500 nm. Dans les tendons, les fibrilles s'assemblent ensuite pour former des faisceaux d'environ 10 mm de long avec un diamètre de 50 à 300 μm, et enfin en une fibre tendineuse d'un diamètre de 100 à 500 μm.
Le collagène des tendons est lié à des composants protéoglycanes (un composé constitué d'une protéine liée à des groupes glycosaminoglycanes, présents notamment dans le tissu conjonctif), dont la décorine et, dans les régions comprimées du tendon, l'aggrécane , qui sont capables de se lier aux fibrilles de collagène à emplacements spécifiques. Les protéoglycanes sont entrelacés avec les fibrilles de collagène - leurs chaînes latérales de glycosaminoglycanes (GAG) ont de multiples interactions avec la surface des fibrilles - montrant que les protéoglycanes sont structurellement importants dans l'interconnexion des fibrilles. Les principaux composants GAG du tendon sont le sulfate de dermatane et le sulfate de chondroïtine , qui s'associent au collagène et sont impliqués dans le processus d'assemblage des fibrilles au cours du développement du tendon. On pense que le sulfate de dermatane est responsable de la formation d'associations entre les fibrilles, tandis que le sulfate de chondroïtine serait davantage impliqué dans l'occupation du volume entre les fibrilles pour les maintenir séparées et aider à résister à la déformation. Les chaînes latérales de sulfate de dermatane de la décorine s'agrègent en solution, et ce comportement peut aider à l'assemblage des fibrilles de collagène. Lorsque les molécules de décorine sont liées à une fibrille de collagène, leurs chaînes de sulfate de dermatane peuvent s'étendre et s'associer à d'autres chaînes de sulfate de dermatane sur la décorine qui est liée à des fibrilles séparées, créant ainsi des ponts interfibrillaires et provoquant éventuellement un alignement parallèle des fibrilles.
Ténocytes
Les ténocytes produisent les molécules de collagène, qui s'agrègent bout à bout et côte à côte pour produire des fibrilles de collagène. Les faisceaux de fibrilles sont organisés pour former des fibres avec les ténocytes allongés étroitement serrés entre eux. Il existe un réseau tridimensionnel de processus cellulaires associés au collagène dans le tendon. Les cellules communiquent entre elles via des jonctions lacunaires , et cette signalisation leur donne la capacité de détecter et de répondre aux charges mécaniques.
Les vaisseaux sanguins peuvent être visualisés dans l'endotendon parallèlement aux fibres de collagène, avec des anastomoses transversales ramifiées occasionnelles .
On pense que la masse interne du tendon ne contient pas de fibres nerveuses, mais l'épiténon et le paraténon contiennent des terminaisons nerveuses, tandis que les organes tendineux de Golgi sont présents à la jonction myotendineuse entre le tendon et le muscle.
La longueur des tendons varie dans tous les grands groupes et d'une personne à l'autre. La longueur du tendon est, en pratique, le facteur décisif concernant la taille réelle et potentielle du muscle. Par exemple, tous les autres facteurs biologiques pertinents étant égaux, un homme avec des tendons plus courts et un muscle biceps plus long aura un plus grand potentiel de masse musculaire qu'un homme avec un tendon plus long et un muscle plus court. Les bodybuilders qui réussissent auront généralement des tendons plus courts. À l'inverse, dans les sports où les athlètes doivent exceller dans des actions telles que la course ou le saut, il est avantageux d'avoir un tendon d'Achille plus long que la moyenne et un muscle du mollet plus court .
La longueur du tendon est déterminée par une prédisposition génétique et il n'a pas été démontré qu'elle augmente ou diminue en réponse à l'environnement, contrairement aux muscles, qui peuvent être raccourcis par un traumatisme, utiliser des déséquilibres et un manque de récupération et d'étirement.
Les fonctions
Traditionnellement, les tendons ont été considérés comme un mécanisme par lequel les muscles se connectent aux os ainsi qu'aux muscles eux-mêmes, fonctionnant pour transmettre des forces. Cette connexion permet aux tendons de moduler passivement les forces pendant la locomotion, offrant une stabilité supplémentaire sans travail actif. Cependant, au cours des deux dernières décennies, de nombreuses recherches se sont concentrées sur les propriétés élastiques de certains tendons et leur capacité à fonctionner comme des ressorts. Tous les tendons ne sont pas tenus de remplir le même rôle fonctionnel, certains membres étant principalement positionneurs, comme les doigts lors de l'écriture (tendons de position) et d'autres agissant comme des ressorts pour rendre la locomotion plus efficace (tendons de stockage d'énergie). Les tendons de stockage d'énergie peuvent stocker et récupérer de l'énergie à haut rendement. Par exemple, lors d'une foulée humaine, le tendon d'Achille s'étire lorsque l'articulation de la cheville est en flexion dorsale. Au cours de la dernière partie de la foulée, lorsque le pied fléchit plantairement (pointant les orteils vers le bas), l'énergie élastique stockée est libérée. De plus, comme le tendon s'étire, le muscle est capable de fonctionner avec moins ou même pas de changement de longueur , ce qui permet au muscle de générer plus de force.
Les propriétés mécaniques du tendon dépendent du diamètre et de l'orientation des fibres de collagène. Les fibrilles de collagène sont parallèles les unes aux autres et serrées, mais présentent une apparence ondulatoire due à des ondulations planes, ou frisures, sur une échelle de plusieurs micromètres. Dans les tendons, les fibres de collagène ont une certaine flexibilité en raison de l'absence de résidus d'hydroxyproline et de proline à des endroits spécifiques de la séquence d'acides aminés, ce qui permet la formation d'autres conformations telles que des courbures ou des boucles internes dans la triple hélice et entraîne le développement de sertissages. Les frisures dans les fibrilles de collagène permettent aux tendons d'avoir une certaine flexibilité ainsi qu'une faible rigidité en compression. De plus, comme le tendon est une structure multibrin composée de nombreuses fibrilles et fascicules partiellement indépendants, il ne se comporte pas comme une seule tige, et cette propriété contribue également à sa flexibilité.
Les composants protéoglycanes des tendons sont également importants pour les propriétés mécaniques. Alors que les fibrilles de collagène permettent aux tendons de résister aux contraintes de traction, les protéoglycanes leur permettent de résister aux contraintes de compression. Ces molécules sont très hydrophiles, c'est-à-dire qu'elles peuvent absorber une grande quantité d'eau et donc avoir un taux de gonflement élevé. Puisqu'ils sont liés de manière non covalente aux fibrilles, ils peuvent s'associer et se dissocier de manière réversible afin que les ponts entre les fibrilles puissent être rompus et reformés. Ce processus peut être impliqué en permettant à la fibrille de s'allonger et de diminuer de diamètre sous tension. Cependant, les protéoglycanes peuvent également avoir un rôle dans les propriétés de traction du tendon. La structure du tendon est en fait un matériau composite fibreux, construit comme une série de niveaux hiérarchiques. À chaque niveau de la hiérarchie, les unités de collagène sont liées entre elles soit par des réticulations de collagène, soit par les protéoglycanes, pour créer une structure hautement résistante à la charge de traction. L'allongement et la déformation des fibrilles de collagène seuls se sont avérés bien inférieurs à l'allongement total et à la déformation de l'ensemble du tendon sous la même quantité de contrainte, démontrant que la matrice riche en protéoglycanes doit également subir une déformation et un raidissement de la matrice se produit à des taux de déformation élevés. Cette déformation de la matrice non collagénique se produit à tous les niveaux de la hiérarchie tendineuse, et en modulant l'organisation et la structure de cette matrice, les différentes propriétés mécaniques requises par les différents tendons peuvent être atteintes. Il a été démontré que les tendons de stockage d'énergie utilisent des quantités importantes de glissement entre les fascicules pour permettre les caractéristiques de déformation élevées dont ils ont besoin, tandis que les tendons de position dépendent davantage du glissement entre les fibres de collagène et les fibrilles. Cependant, des données récentes suggèrent que les tendons de stockage d'énergie peuvent également contenir des fascicules qui sont de nature tordue ou hélicoïdale - un agencement qui serait très bénéfique pour fournir le comportement de type ressort requis dans ces tendons.
Mécanique
Les tendons sont des structures viscoélastiques , ce qui signifie qu'ils présentent à la fois un comportement élastique et visqueux. Lorsqu'ils sont étirés, les tendons présentent un comportement typique des "tissus mous". La courbe force-extension ou contrainte-déformation commence par une région de très faible rigidité, car la structure de sertissage se redresse et les fibres de collagène s'alignent, ce qui suggère un rapport de Poisson négatif dans les fibres du tendon. Plus récemment, des tests effectués in vivo (par IRM) et ex vivo (par des tests mécaniques de divers tissus tendineux cadavériques) ont montré que les tendons sains sont fortement anisotropes et présentent un coefficient de Poisson négatif ( auxétique ) dans certains plans lorsqu'ils sont étirés jusqu'à 2 % sur leur longueur, c'est-à-dire dans leur amplitude de mouvement normale. Après cette région « d'orteil », la structure devient nettement plus rigide et présente une courbe contrainte-déformation linéaire jusqu'à ce qu'elle commence à se rompre. Les propriétés mécaniques des tendons varient considérablement, car elles sont adaptées aux exigences fonctionnelles du tendon. Les tendons de stockage d'énergie ont tendance à être plus élastiques ou moins rigides, de sorte qu'ils peuvent stocker plus facilement l'énergie, tandis que les tendons de position plus rigides ont tendance à être un peu plus viscoélastiques et moins élastiques, de sorte qu'ils peuvent fournir un contrôle plus fin du mouvement. Un tendon de stockage d'énergie typique échouera à environ 12-15% de déformation et une contrainte dans la région de 100-150 MPa, bien que certains tendons soient nettement plus extensibles que cela, par exemple le fléchisseur numérique superficiel chez le cheval , qui s'étire dans excès de 20% au galop. Les tendons positionnels peuvent céder à des déformations aussi faibles que 6 à 8 %, mais peuvent avoir des modules dans la région de 700 à 1 000 MPa.
Plusieurs études ont démontré que les tendons répondent aux changements de charge mécanique par des processus de croissance et de remodelage, un peu comme les os . En particulier, une étude a montré que la non-utilisation du tendon d'Achille chez le rat entraînait une diminution de l'épaisseur moyenne des faisceaux de fibres de collagène composant le tendon. Chez l'homme, une expérience au cours de laquelle des personnes ont été soumises à un environnement de microgravité simulé a révélé que la raideur des tendons diminuait de manière significative, même lorsque les sujets devaient effectuer des exercices d'agitation. Ces effets ont des implications dans des domaines allant du traitement des patients alités à la conception d'exercices plus efficaces pour les astronautes .
Guérison
Les tendons du pied sont très complexes et complexes. Par conséquent, le processus de guérison d'un tendon cassé est long et douloureux. La plupart des personnes qui ne reçoivent pas de soins médicaux dans les 48 premières heures suivant la blessure souffriront d'un gonflement important, de douleurs et d'une sensation de brûlure à l'endroit où la blessure s'est produite.
On croyait que les tendons ne pouvaient pas subir de renouvellement de la matrice et que les ténocytes n'étaient pas capables de se réparer. Cependant, il a depuis été démontré que, tout au long de la vie d'une personne, les ténocytes du tendon synthétisent activement des composants de la matrice ainsi que des enzymes telles que les métalloprotéinases matricielles (MMP) peuvent dégrader la matrice. Les tendons sont capables de guérir et de se remettre de blessures dans un processus contrôlé par les ténocytes et leur matrice extracellulaire environnante.
Les trois principales étapes de la cicatrisation tendineuse sont l'inflammation, la réparation ou la prolifération et le remodelage, qui peuvent être subdivisés en consolidation et maturation. Ces étapes peuvent se chevaucher. Dans la première étape, les cellules inflammatoires telles que les neutrophiles sont recrutées sur le site de la blessure, avec les érythrocytes . Les monocytes et les macrophages sont recrutés dans les 24 premières heures et la phagocytose des matériaux nécrotiques au site de la lésion se produit. Après la libération des facteurs vasoactifs et chimiotactiques , l'angiogenèse et la prolifération des ténocytes sont initiées. Les ténocytes se déplacent alors dans le site et commencent à synthétiser le collagène III. Après quelques jours, la phase de réparation ou de prolifération commence. À ce stade, les ténocytes sont impliqués dans la synthèse de grandes quantités de collagène et de protéoglycanes au site de la lésion, et les taux de GAG et d'eau sont élevés. Après environ six semaines, la phase de remodelage commence. La première partie de cette étape est la consolidation, qui dure environ six à dix semaines après la blessure. Pendant ce temps, la synthèse de collagène et de GAG est diminuée, et la cellularité est également diminuée à mesure que le tissu devient plus fibreux en raison de l'augmentation de la production de collagène I et que les fibrilles s'alignent dans la direction du stress mécanique. La dernière étape de maturation se produit au bout de dix semaines, et pendant ce temps, il y a une augmentation de la réticulation des fibrilles de collagène, ce qui rend le tissu plus rigide. Progressivement, sur environ un an, le tissu passera de fibreux à cicatriciel.
Les métalloprotéinases matricielles (MMP) ont un rôle très important dans la dégradation et le remodelage de la MEC au cours du processus de cicatrisation après une lésion tendineuse. Certaines MMP, notamment MMP-1, MMP-2, MMP-8, MMP-13 et MMP-14, ont une activité de collagénase, ce qui signifie que, contrairement à de nombreuses autres enzymes, elles sont capables de dégrader les fibrilles de collagène I. La dégradation des fibrilles de collagène par la MMP-1 ainsi que la présence de collagène dénaturé sont des facteurs qui sont censés provoquer un affaiblissement de l'ECM du tendon et une augmentation du risque qu'une autre rupture se produise. En réponse à une charge mécanique ou à une blessure répétée, des cytokines peuvent être libérées par les ténocytes et peuvent induire la libération de MMP, provoquant une dégradation de la MEC et entraînant des blessures récurrentes et des tendinopathies chroniques.
Une variété d'autres molécules sont impliquées dans la réparation et la régénération des tendons. Il existe cinq facteurs de croissance qui se sont avérés significativement régulés positivement et actifs pendant la cicatrisation des tendons : le facteur de croissance analogue à l'insuline 1 (IGF-I), le facteur de croissance dérivé des plaquettes (PDGF), le facteur de croissance endothélial vasculaire (VEGF), le fibroblaste basique facteur de croissance (bFGF) et facteur de croissance transformant bêta (TGF-β). Ces facteurs de croissance ont tous des rôles différents au cours du processus de guérison. L'IGF-1 augmente la production de collagène et de protéoglycanes au cours du premier stade de l'inflammation, et le PDGF est également présent au cours des premiers stades après une blessure et favorise la synthèse d'autres facteurs de croissance ainsi que la synthèse d'ADN et la prolifération des cellules tendineuses. Les trois isoformes de TGF-β (TGF-β1, TGF-β2, TGF-β3) sont connues pour jouer un rôle dans la cicatrisation et la formation de cicatrices. Le VEGF est bien connu pour favoriser l'angiogenèse et pour induire la prolifération et la migration des cellules endothéliales, et il a été démontré que l'ARNm du VEGF est exprimé au site des lésions tendineuses avec l'ARNm du collagène I. Les protéines morphogénétiques osseuses (BMP) sont un sous-groupe de la superfamille TGF-β qui peut induire la formation d'os et de cartilage ainsi que la différenciation tissulaire, et il a été démontré que la BMP-12 influence spécifiquement la formation et la différenciation du tissu tendineux et favorise la fibrogenèse.
Effets de l'activité sur la guérison
Dans des modèles animaux, des études approfondies ont été menées pour étudier les effets de la contrainte mécanique sous la forme d'un niveau d'activité sur les lésions et la cicatrisation des tendons. Alors que les étirements peuvent perturber la cicatrisation pendant la phase inflammatoire initiale, il a été démontré qu'un mouvement contrôlé des tendons après environ une semaine après une blessure aiguë peut aider à favoriser la synthèse de collagène par les ténocytes, entraînant une augmentation de la résistance à la traction et du diamètre de la tendons cicatrisés et moins d'adhérences que les tendons immobilisés. Dans les lésions tendineuses chroniques, il a également été démontré que la charge mécanique stimule la prolifération des fibroblastes et la synthèse du collagène, ainsi que le réalignement du collagène, qui favorisent tous la réparation et le remodelage. Pour étayer davantage la théorie selon laquelle le mouvement et l'activité contribuent à la guérison des tendons, il a été démontré que l'immobilisation des tendons après une blessure a souvent un effet négatif sur la guérison. Chez les lapins, les fascicules de collagène immobilisés ont montré une résistance à la traction réduite, et l'immobilisation entraîne également une diminution des quantités d'eau, de protéoglycanes et de réticulations de collagène dans les tendons.
Plusieurs mécanismes de mécanotransduction ont été proposés comme raisons de la réponse des ténocytes à la force mécanique qui leur permettent de modifier leur expression génique, leur synthèse protéique et leur phénotype cellulaire, et éventuellement de provoquer des modifications de la structure du tendon. Un facteur majeur est la déformation mécanique de la matrice extracellulaire , qui peut affecter le cytosquelette d'actine et donc affecter la forme, la motilité et la fonction des cellules. Les forces mécaniques peuvent être transmises par les sites d'adhésion focale, les intégrines et les jonctions cellule-cellule. Des changements dans le cytosquelette d'actine peuvent activer les intégrines, qui interviennent dans la signalisation "de l'extérieur vers l'intérieur" et "de l'intérieur vers l'extérieur" entre la cellule et la matrice. Les protéines G , qui induisent des cascades de signalisation intracellulaires, peuvent également être importantes, et les canaux ioniques sont activés par étirement pour permettre aux ions tels que le calcium, le sodium ou le potassium de pénétrer dans la cellule.
Société et culture
Le tendon a été largement utilisé tout au long des époques préindustrielles en tant que fibre résistante et durable . Certaines utilisations spécifiques incluent l'utilisation de tendons comme fil pour coudre, attacher des plumes aux flèches (voir fletch ), attacher les lames d'outils aux arbres, etc. Il est également recommandé dans les guides de survie comme matériau à partir duquel des cordages solides peuvent être fabriqués pour des articles comme des pièges ou structures vivantes. Le tendon doit être traité de manière spécifique pour fonctionner utilement à ces fins. Les Inuits et d'autres peuples circumpolaires utilisaient le tendon comme seul cordage à toutes fins domestiques en raison du manque d'autres sources de fibres appropriées dans leurs habitats écologiques. Les propriétés élastiques de tendons particuliers ont également été utilisées dans les arcs recourbés composites privilégiés par les nomades des steppes d'Eurasie et les Amérindiens. La première artillerie à jet de pierre utilisait également les propriétés élastiques du tendon.
Le tendon est un excellent matériau de cordage pour trois raisons : il est extrêmement solide, il contient des colles naturelles et il rétrécit en séchant, éliminant ainsi le besoin de nœuds.
Utilisations culinaires
Le tendon (en particulier le tendon de bœuf ) est utilisé comme aliment dans certaines cuisines asiatiques (souvent servi dans les restaurants yum cha ou dim sum ). Un plat populaire est le suan bao niu jin , dans lequel le tendon est mariné à l'ail. On le trouve aussi parfois dans le plat de nouilles vietnamiennes phở .
Signification clinique
Blessure
Les tendons sont sujets à de nombreux types de blessures. Il existe diverses formes de tendinopathies ou de lésions tendineuses dues à une surutilisation. Ces types de blessures entraînent généralement une inflammation et une dégénérescence ou un affaiblissement des tendons, ce qui peut éventuellement entraîner une rupture du tendon. Les tendinopathies peuvent être causées par un certain nombre de facteurs liés à la matrice extracellulaire du tendon (ECM), et leur classification est difficile car leurs symptômes et leur histopathologie sont souvent similaires.
La première catégorie de tendinopathies est la paraténonite, qui désigne une inflammation du paratenon, ou feuillet paratendineux situé entre le tendon et sa gaine. La tendinose fait référence à une lésion non inflammatoire du tendon au niveau cellulaire. La dégradation est causée par des dommages au collagène, aux cellules et aux composants vasculaires du tendon, et est connue pour entraîner une rupture. Les observations de tendons qui ont subi une rupture spontanée ont montré la présence de fibrilles de collagène qui ne sont pas dans la bonne orientation parallèle ou qui ne sont pas uniformes en longueur ou en diamètre, ainsi que des ténocytes arrondis, d'autres anomalies cellulaires et la croissance de vaisseaux sanguins. D'autres formes de tendinose qui n'ont pas conduit à une rupture ont également montré la dégénérescence, la désorientation et l'amincissement des fibrilles de collagène, ainsi qu'une augmentation de la quantité de glycosaminoglycanes entre les fibrilles. La troisième est la paraténonite avec tendinose, dans laquelle des combinaisons d'inflammation du paraténon et de dégénérescence du tendon sont toutes deux présentes. La dernière est la tendinite , qui désigne une dégénérescence avec inflammation du tendon ainsi qu'une perturbation vasculaire.
Les tendinopathies peuvent être causées par plusieurs facteurs intrinsèques, notamment l'âge, le poids corporel et la nutrition. Les facteurs extrinsèques sont souvent liés aux sports et comprennent des forces ou des charges excessives, de mauvaises techniques d'entraînement et des conditions environnementales.
Autres animaux
Chez certains organismes, notamment les oiseaux et les dinosaures ornithischiens , des parties du tendon peuvent s'ossifier. Dans ce processus, les ostéocytes infiltrent le tendon et déposent l'os comme ils le feraient dans l'os sésamoïde tel que la rotule. Chez les oiseaux, l'ossification des tendons se produit principalement dans le membre postérieur, tandis que chez les dinosaures ornithischiens, les tendons musculaires axiaux ossifiés forment un treillis le long des épines neurales et hémales de la queue, vraisemblablement pour le soutien.


