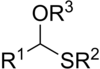
Thioacétal - Thioacetal
Les thioacétals sont les analogues soufrés des acétals . Il existe deux classes: les monothioacétals et les dithioacétals. Les monothioacétals sont moins courants, ont le groupe fonctionnel RC (OR ') (SR ") H. Les dithioacétals ont la formule RC (SR') 2 H (dithioacétals symétriques) et RC (SR ') (SR") H (dithioacétals asymétriques) .
Les dithioacétals symétriques sont relativement courants. Ils sont préparés par condensation de thiols ou de dithiols avec des aldéhydes. Ces réactions se déroulent par l'intermédiaire d' hémithioacétals :
- Ajout de thiol pour donner de l'hémithioacétal: RSH + R'CH (O) → R'CH (SR) (OH)
- Ajout de thiol avec perte d'eau pour donner du dithioacétal: RSH + R'CH (OH) SR → R'CH (SR) 2 + H 2 O
De telles réactions utilisent généralement soit un acide de Lewis ou acide de Brönsted en tant que catalyseur .
Les dithioacétals générés à partir d'aldéhydes et soit du 1,2-éthanedithiol soit du 1,3-propanedithiol sont particulièrement courants parmi cette classe de molécules à utiliser dans la synthèse organique .
Le carbone carbonyle d'un aldéhyde est électrophile et donc susceptible d'être attaqué par des nucléophiles , tandis que le carbone central analogue d'un dithioacétal n'est pas électrophile. En conséquence, les dithioacétals peuvent servir de groupes protecteurs pour les aldéhydes.
Loin d'être non réactif, et dans une réaction différente de celle des aldéhydes, ce carbone peut être déprotoné pour le rendre nucléophile:
- R'CHS 2 C 2 H 4 + R 2 NLi → R'CLiS 2 C 2 H 4 + R 2 NH
L'inversion de polarité entre R '(H) C δ + = O δ− et R'CLi (SR) 2 est appelée umpolung . La réaction est couramment réalisée en utilisant le 1,3-dithiane . L'intermédiaire lithié peut être utilisé pour diverses réactions de formation de liaisons nucléophiles, puis le dithiocétal est hydrolysé à sa forme carbonyle. Ce processus global, la réaction Corey-Seebach , donne l'équivalent synthétique d'un anion acyle.
Voir également
Les références
- ^ IUPAC , Compendium de terminologie chimique , 2e éd. (le "Livre d'or") (1997). Version corrigée en ligne: (2006–) " thioacétals ". doi : 10.1351 / livre d'or.T06348
- ^ P. Stütz Et PA Stadler "Indoles 3-alkylés Et 3-acylés D'un Précurseur Commun: 3-benzylindole Et 3-benzoylindole" Org. Synth. 1977, 56, 8. doi : 10.15227 / orgsyn.056.0008