Thiostrepton - Thiostrepton

|
|
| Noms | |
|---|---|
|
Nom IUPAC
N-[3-[(3-amino-3-oxoprop-1-én-2-yl)amino]-3-oxoprop-1-én-2-yl]-2-[(1R,8S,11Z,18S ,25S,26R,53S,59S)-37-butan-2-yl-18-[(2S,3R)-2,3-dihydroxybutan-2-yl]-11-éthylidène-59-hydroxy-8-[( 1R)-1-hydroxyéthyl]-31-[(1S)-1-hydroxyéthyl]-26,40,46-triméthyl-43-méthylidène-6,9,16,23,28,38,41,44,47- nonaoxo-27-oxa-3,13,20,56-tétrathie-7,10,17,24,36,39,42,45,48,52,58,61,62,63,64-pentadecazanonacyclo[23.23. 9.329,35.12,5.112,15.119,22.154,57,01,53,032,60]tétrahexaconta-2(64),4,12(63),19(62),21,29(61),30,32(60),33 ,51,54,57-dodécaén-51-yl]-1,3-thiazole-4-carboxamide
|
|
| Autres noms
Alaninamide, Bryamycine, Thiactine
|
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChEMBL | |
| ChemSpider | |
| Carte d'information de l'ECHA |
100.014.304 |
| Numéro CE | |
|
CID PubChem
|
|
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 72 H 85 N 19 O 18 S 5 | |
| Masse molaire | 1664,83 g/mol |
| Apparence | Poudre blanche à blanc cassé |
| Point de fusion | 246 à 256 °C (475 à 493 °F ; 519 à 529 K) |
| Insoluble | |
| Solubilité dans d'autres solvants | Soluble dans CHCl 3 , CH 2 Cl 2 , dioxane, pyridine, acide acétique glacial, DMF. Pratiquement insoluble dans les alcools inférieurs, les solvants organiques non polaires, les acides ou bases aqueux dilués. Peut être dissous par l' acide méthanolique ou une base, mais avec décomposition. |
| Dangers | |
| Pictogrammes SGH |

|
| Mention d'avertissement SGH | Avertissement |
| H302 | |
| P264 , P270 , P301+312 , P330 , P501 | |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Références de l'infobox | |
Le thiostrepton est un antibiotique oligopeptidique cyclique naturel de la classe des thiopeptides , dérivé de plusieurs souches de streptomycètes , telles que Streptomyces azureus et Streptomyces laurentii . Le thiostrepton est un produit naturel de la classe des peptides synthétisés par le ribosome et modifiés post-traductionnellement (RiPP).
Histoire
Le thiostrepton a été découvert par Donovick et al. qui a décrit ses propriétés antibactériennes en 1955. Dorothy Crowfoot Hodgkin a résolu la structure du thiostrepton en 1970. Au début de 1978, Bycroft et Gowland ont proposé la biosynthèse du thiostrepton, qui n'était toujours pas claire jusqu'en 2009. Plusieurs études sur la biosynthèse des thiopeptides ont été publiées en 2009 et deux d'entre eux (Liao et al. et Kelly et al. ) comprenaient la biosynthèse similaire du thiostrepton : il est synthétisé par le ribosome à partir des gènes biosynthétiques du thiostrepton (gènes tsr) et une modification post-traductionnelle est nécessaire.
Une synthèse totale de thiostreptone a été complétée par KC Nicolaou , et al. en 2004.
Applications
Le thiostrepton a été utilisé en médecine vétérinaire dans les mammites causées par des organismes à Gram négatif et dans les troubles dermatologiques. Il est principalement utilisé dans les onguents complexes contenant de la néomycine , de la nystatine , du thiostrepton et des stéroïdes topiques . Il est également actif contre les bactéries à Gram positif. Il est à noter que les pommades à usage humain contiennent de la néomycine , de la nystatine et des stéroïdes topiques , mais pas de thiostrepton.
Il a été signalé (en 2008) que le thiostrepton présentait une activité contre les cellules cancéreuses du sein en ciblant le facteur de transcription forkhead box M1 ( FOXM1 ), également en 2011. Il a également été démontré qu'il contournait la résistance acquise au cisplatine dans les cellules cancéreuses du sein dans des conditions in vitro.
Le thiostrepton est utilisé en biologie moléculaire comme réactif à la fois pour la sélection positive et négative des gènes impliqués dans le métabolisme des nucléotides.
Biosynthèse
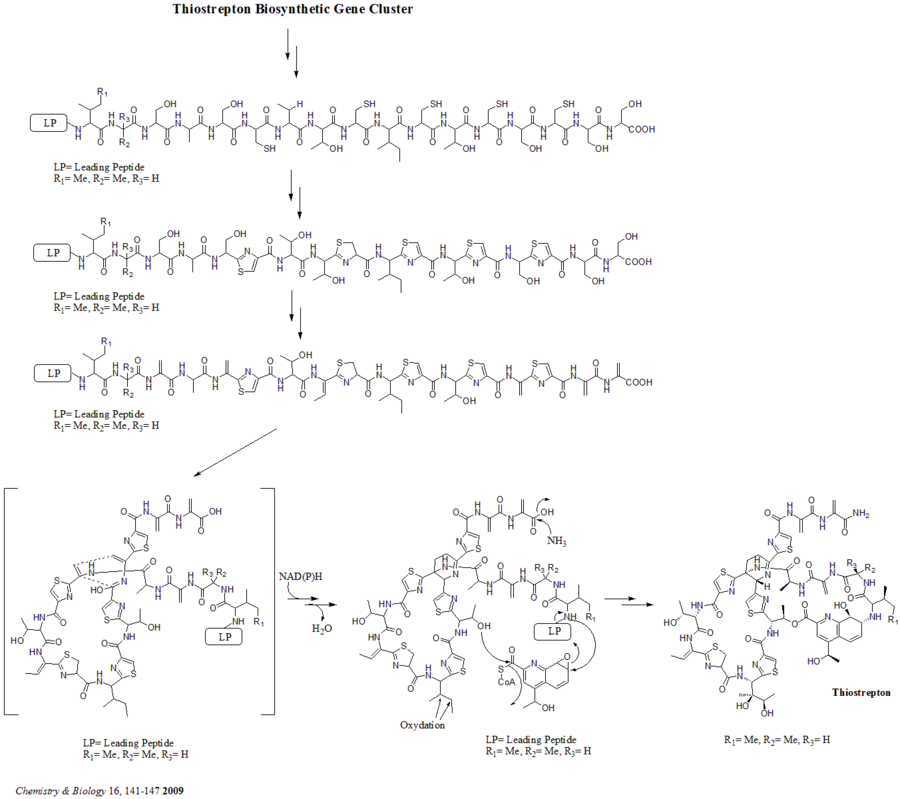
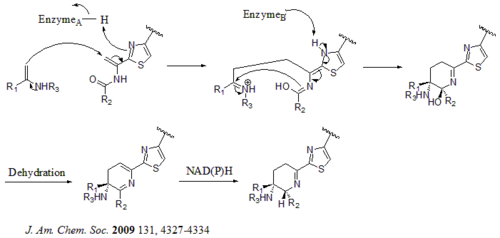
Il y a au total 21 gènes (tsrA~tsrU) dans le groupe de gènes biosynthétiques. Le précurseur du thiostrepton contient 58 acides aminés dans la chaîne peptidique, qui comprend le peptide leader 41-aa (LP) et le peptide structurel 17-aa (IASASCTTCICTCSCSS). Une fois le précurseur synthétisé, la cyclodéshydratase tsrO et la déshydrogénase tsrM catalysent la formation de thiazole ou de thiazoline à partir de tous les résidus cystéine de la chaîne peptidique. Après formation de thiazole/thiazoline, les déshydratases tsrJ, K et S convertissent alors tous les résidus sérine en déhydroalanines. Une cyclisation hétéro Diels-Alder de la déshydropipéridine centrale (en S5, C13 et S14) a été suggérée par Bycroft depuis 1978 et a été utilisée dans la synthèse chimique de cette structure centrale par Nicolaou et al. en 2005. Un mécanisme alternatif de formation de déshydropipéridine a également été suggéré par Kelly et al . en 2009. Néanmoins, sur la base de preuves expérimentales, il est suggéré que tsrN et L sont responsables de la cyclisation hétéro Diels-Alder. Il est suggéré que la fraction acide quinaldique est synthétisée par les neuf gènes tsrFAEBDUPQI du tryptophane et entraîne ensuite la fermeture du macrocycle de l'acide quinaldique. Enfin, tsrR sert de candidat pour l'oxydation du résidu Ile pour donner le thiostrepton.
Mécanisme alternatif pour la formation du noyau de déhydropipéridine
Synthèse totale
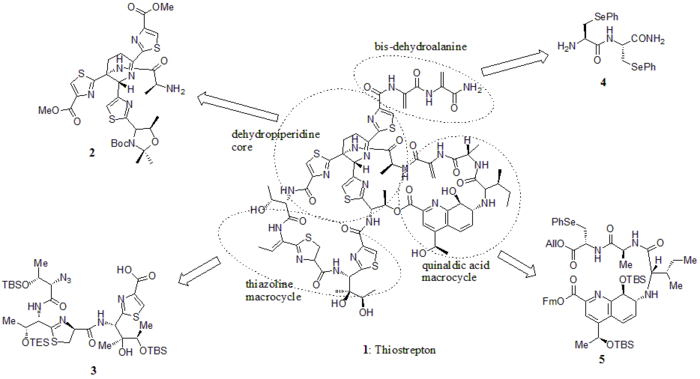
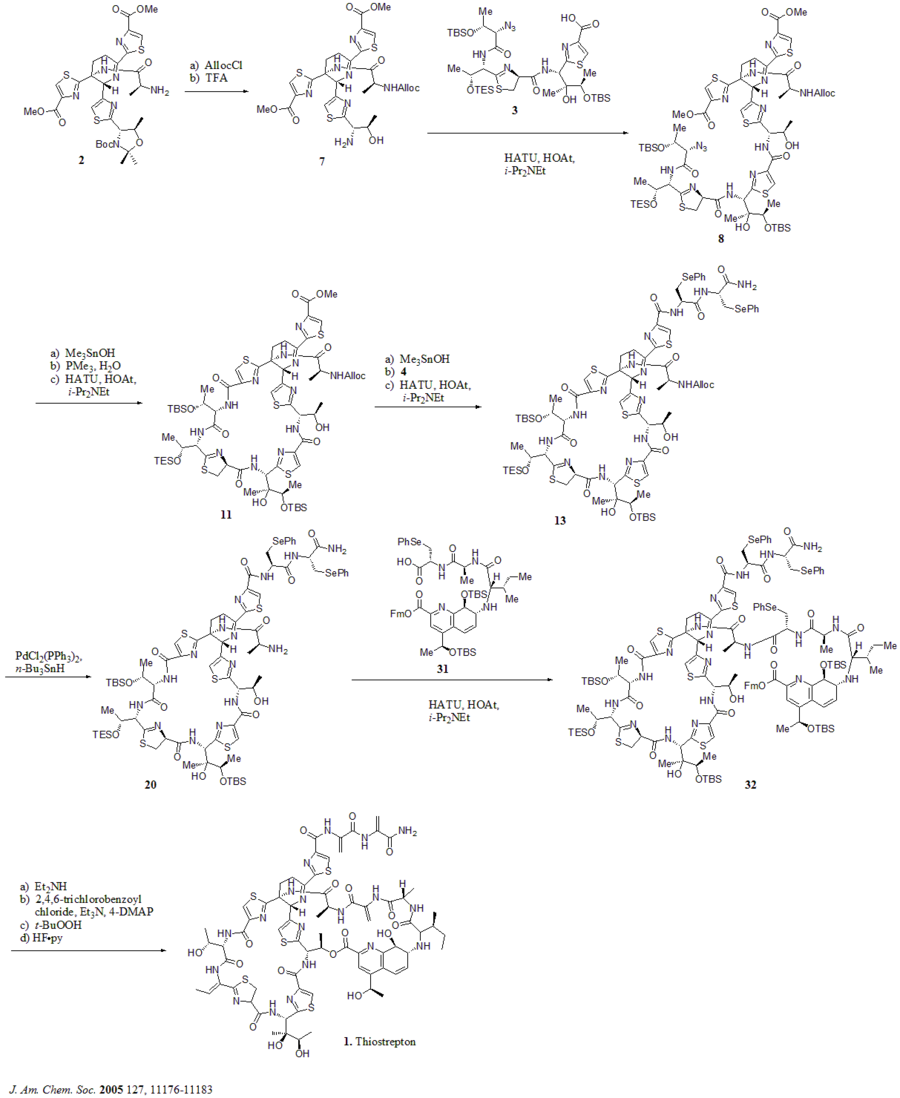
En 2005, Nicolaou et al. ont publié la synthèse totale du thiostrepton. Au début, ils ont construit les éléments constitutifs clés du thiostrepton (1) : le noyau de déhydropipéridine (2), le macrocycle de thiazoline (3), la queue de bis-déhydroalanine (4) et le macrocycle d'acide quinaldique (5). Ensuite, ils ont assemblé les blocs de construction de manière séquentielle, comme indiqué dans le schéma synthétique (les numéros composés proviennent de la référence).