Thromboxane-A synthase - Thromboxane-A synthase
La thromboxane A synthase 1 (plaquette, cytochrome P450, famille 5, sous-famille A) , également connue sous le nom de TBXAS1 , est une enzyme du cytochrome P450 qui, chez l'homme, est codée par le gène TBXAS1 .
Fonction
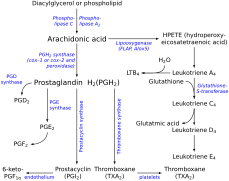
Ce gène code pour un membre de la superfamille d'enzymes du cytochrome P450. Les protéines du cytochrome P450 sont des monooxygénases qui catalysent de nombreuses réactions impliquées dans le métabolisme des médicaments et la synthèse du cholestérol, des stéroïdes et d'autres lipides. Cependant, cette protéine est considérée comme un membre de la superfamille du cytochrome P450 sur la base de la similarité de séquence plutôt que de la similitude fonctionnelle. Cette protéine de la membrane du réticulum endoplasmique catalyse la conversion de la prostaglandine H 2 en thromboxane A 2 , un puissant vasoconstricteur et inducteur de l'agrégation plaquettaire , ainsi qu'en acide 12-hydroxyheptadécatriénoïque (c'est-à-dire 12- ( S ) -hydroxy-5 Z , 8 E , 10 Acide E- heptadécatriénoïque ou 12-HHT ) un agoniste des récepteurs des leucotriènes B4 (c'est-à- dire des récepteurs BLT2 ) et médiateur de certaines actions des récepteurs BLT2 . L'enzyme joue un rôle dans plusieurs processus physiopathologiques, notamment l'hémostase, les maladies cardiovasculaires et les accidents vasculaires cérébraux. Le gène exprime deux variantes de transcription.
Les inhibiteurs
Les inhibiteurs de la thromboxane synthase sont utilisés comme médicaments antiplaquettaires . Ifetroban est un antagoniste puissant et sélectif des récepteurs de la thromboxane. Le dipyridamole antagonise également ce récepteur, mais possède également divers autres mécanismes d'activité antiplaquettaire. Le picotamide a une activité à la fois comme inhibiteur de la thromboxane synthase et comme antagoniste des récepteurs de la thromboxane .
Structure
La thromboxane A (TXA) synthase humaine est une protéine du cytochrome P450 de 60 kDa avec 533 acides aminés et un groupe prothétique hème . Cette enzyme, ancrée au réticulum endoplasmique, se trouve dans les plaquettes, les monocytes et plusieurs autres types de cellules. L'extrémité NH2 contient deux segments hydrophobes dont on pense que la structure secondaire est hélicoïdale. Les preuves suggèrent que les peptides servent d'ancrage membranaire pour l'enzyme. De plus, l'étude des clones d'ADNc rendue possible par les techniques de réaction en chaîne par polymérase a encore élucidé la structure primaire de la TXA synthase. Semblable à d'autres membres de la famille du cytochrome P450, la TXA synthase a un groupe hème coordonné au groupe thiolate d'un résidu cystéine, en particulier la cystéine 480. Les études de mutagenèse qui ont effectué des substitutions à cette position ont entraîné une perte d'activité catalytique et une liaison minimale à l'hème. D'autres résidus qui ont eu des résultats similaires étaient W133, R478, N110 et R413. Situés à proximité des groupes propionate d'hème ou de la face distale de l'hème, ces résidus sont également importants pour une intégration correcte de l'hème dans l'apoprotéine. Malheureusement, les chercheurs ont trouvé difficile d'obtenir une structure cristalline de la TXA synthase en raison de l'exigence d'extraction par traitement détergent de la membrane, mais ils ont utilisé la modélisation d'homologie pour créer une structure 3D. Un modèle a montré deux domaines, un domaine riche en hélice alpha et un domaine riche en feuilles bêta. L'hème s'est avéré être pris en sandwich entre les hélices I et L.
Mécanisme
Le thromboxane A (TXA) est dérivé de la molécule de prostaglandine H2 (PGH2). PGH2 contient une liaison épidioxy relativement faible, et un mécanisme possible est connu pour impliquer un clivage homolytique de l'épidioxyde et un réarrangement en TXA. Un groupe hème dans le site actif de la TXA synthase joue un rôle important dans le mécanisme. Des études cinétiques à écoulement interrompu avec un analogue de substrat et une TXA synthase recombinante ont révélé que la liaison au substrat se produit en deux étapes. Tout d'abord, il y a une liaison initiale rapide à la protéine, puis une ligature ultérieure au fer hémique. Dans la première étape du mécanisme, le fer hémique se coordonne avec l'oxygène de l'endoperoxyde C-9. Il participe au clivage homolytique de la liaison OO dans l'endoperoxyde, qui représente l'étape limitant la vitesse, et subit un changement d'état redox de Fe (III) à Fe (IV). Un radical oxygène libre se forme en C-11, et cet intermédiaire subit un clivage du cycle. Avec le radical libre maintenant en C-12, l'hème de fer oxyde alors ce radical en un carbocation. La molécule est maintenant prête pour la formation d'anneaux intramoléculaires. L'oxygène chargé négativement attaque le carbonyle et les électrons de l'une des doubles liaisons sont attirés vers le carbocation, fermant ainsi le cycle.
Importance biologique
Le maintien d'un équilibre entre les prostacyclines et les thromboxanes est important dans l'organisme, notamment parce que ces deux eicosanoïdes exercent des effets opposés. En catalysant la synthèse des thromboxanes, la TXA synthase est impliquée dans une voie de flux qui peut moduler la quantité de thromboxane produite. Ce contrôle devient un facteur important dans plusieurs processus, tels que la régulation de la pression artérielle, la coagulation et les réponses inflammatoires. On pense qu'une dérégulation de la TXA synthase et un déséquilibre du rapport prostacycline-thromboxane sous-tendent de nombreuses conditions pathologiques, telles que l'hypertension pulmonaire . Les thromboxanes jouant un rôle dans la vasoconstriction et l'agrégation plaquettaire, leur dominance peut perturber l'homéostasie vasculaire et provoquer des événements vasculaires thrombotiques . En outre, l'importance des thromboxanes et de leurs synthèses dans l'homéostasie vasculaire est illustrée par des découvertes selon lesquelles les patients dont les plaquettes ne répondaient pas au TXA présentaient des anomalies hémostatiques et qu'une déficience de la production plaquettaire de TXA conduisait à des troubles hémorragiques.
En outre, il a été trouvé que l'expression de la TXA synthase peut être d'une importance critique pour le développement et la progression du cancer. Une augmentation globale de l'expression de la TXA synthase a été observée dans divers cancers, tels que le carcinome papillaire de la thyroïde , le cancer de la prostate et le cancer du rein . Les cellules cancéreuses sont connues pour leur potentiel de réplication cellulaire illimité, et il a été émis l'hypothèse que les changements dans le profil des eicosanoïdes affectent la croissance du cancer. La recherche a conduit à la proposition que la TXA synthase contribue à une gamme de voies de survie tumorale, y compris la croissance, l' inhibition de l' apoptose , l' angiogenèse et les métastases .
Sentier
Voir également
Références
Lectures complémentaires
- Shen RF, Tai HH (1998). "Thromboxanes: synthase et récepteurs". J. Biomed. Sci . 5 (3): 153–172. doi : 10.1007 / BF02253465 . PMID 9678486 .
- Smith G, Stubbins MJ, Harries LW, Wolf CR (1999). "Génétique moléculaire de la superfamille humaine de monooxygénase du cytochrome P450". Xenobiotica . 28 (12): 1129-1165. doi : 10.1080 / 004982598238868 . PMID 9890157 .
- Wang LH, Kulmacz RJ (2003). "Thromboxane synthase: structure et fonction de protéine et de gène". Prostaglandines Autres Médiat lipidique . 68–69: 409–422. doi : 10.1016 / S0090-6980 (02) 00045-X . PMID 12432933 .
- Itoh S, Yanagimoto T, Tagawa S et al. (1992). "Organisation génomique du gène (s) lié (s) spécifique (s) de P-450IIIA7 (cytochrome P-450HFLa) fœtal humain (s) et interaction du facteur de régulation transcriptionnel avec son élément d'ADN dans la région flanquante 5 '". Biochim. Biophys. Acta . 1130 (2): 133–8. doi : 10.1016 / 0167-4781 (92) 90520-a . PMID 1562592 .
- Yokoyama C, Miyata A, Ihara H et coll. (1991). "Le clonage moléculaire de la thromboxane plaquettaire humaine A synthase". Biochem. Biophys. Res. Commun . 178 (3): 1479-1484. doi : 10.1016 / 0006-291X (91) 91060-P . PMID 1714723 .
- Ohashi K, Ruan KH, Kulmacz RJ et coll. (1992). "La structure primaire de la thromboxane synthase humaine déterminée à partir de la séquence d'ADNc". J. Biol. Chem . 267 (2): 789–93. PMID 1730669 .
- Jones DA, Fitzpatrick FA, Malcolm KC (1991). "Synthèse de Thromboxane A2 dans les cellules érythroleucémiques humaines". Biochem. Biophys. Res. Commun . 180 (1): 8–14. doi : 10.1016 / S0006-291X (05) 81247-1 . PMID 1930241 .
- Wang LH, Ohashi K, Wu KK (1991). "Isolement d'ADN complémentaire partiel codant pour la thromboxane synthase humaine". Biochem. Biophys. Res. Commun . 177 (1): 286-291. doi : 10.1016 / 0006-291X (91) 91980-Q . PMID 2043115 .
- Nüsing R, Schneider-Voss S, Ullrich V (1990). "Purification d'immunoaffinité de la thromboxane synthase humaine". Cambre. Biochem. Biophys . 280 (2): 325–330. doi : 10.1016 / 0003-9861 (90) 90337-X . PMID 2195994 .
- Mestel F, Oetliker O, Beck E et al. (1980). "Saignement sévère associé à une thromboxane synthétase défectueuse" . Lancette . 1 (8160): 157. doi : 10.1016 / S0140-6736 (80) 90642-X . PMID 6101498 . S2CID 29803926 .
- Miyata A, Yokoyama C, Ihara H et coll. (1994). "Caractérisation du gène humain (TBXAS1) codant pour la thromboxane synthase". EUR. J. Biochem . 224 (2): 273-279. doi : 10.1111 / j.1432-1033.1994.00273.x . PMID 7925341 .
- Wang LH, Tazawa R, Lang AQ, Wu KK (1995). "Épissage alterné de l'ARNm de thromboxane synthase humaine". Cambre. Biochem. Biophys . 315 (2): 273-278. doi : 10.1006 / abbi.1994.1500 . PMID 7986068 .
- Maruyama K, Sugano S (1994). "Oligo-coiffage: une méthode simple pour remplacer la structure de coiffe des ARNm eucaryotes par des oligoribonucléotides". Gene . 138 (1–2): 171–174. doi : 10.1016 / 0378-1119 (94) 90802-8 . PMID 8125298 .
- Lee KD, Baek SJ, Shen RF (1994). "Clonage et caractérisation du promoteur du gène de la thromboxane synthase humaine". Biochem. Biophys. Res. Commun . 201 (1): 379-387. doi : 10.1006 / bbrc.1994.1712 . PMID 8198598 .
- Chase MB, Baek SJ, Purtell DC et coll. (1993). "Cartographie du gène de la thromboxane synthase humaine (TBXAS1) au chromosome 7q34-q35 par hybridation in situ de fluorescence bicolore". Génomique . 16 (3): 771–773. doi : 10.1006 / geno.1993.1264 . PMID 8325653 .
- Ruan KH, Wang LH, Wu KK, Kulmacz RJ (1993). "Topologie amino-terminale de la thromboxane synthase dans le réticulum endoplasmique". J. Biol. Chem . 268 (26): 19483–90. PMID 8366093 .
- Tazawa R, Green ED, Ohashi K et coll. (1996). "Caractérisation de la structure génomique complète du gène de la thromboxane synthase humaine et analyse fonctionnelle de son promoteur". Cambre. Biochem. Biophys . 334 (2): 349–356. doi : 10.1006 / abbi.1996.0464 . PMID 8900410 .
- Baek SJ, Lee KD, Shen RF (1996). "La structure génomique et le polymorphisme du gène codant pour la thromboxane synthase humaine". Gene . 173 (2): 251–256. doi : 10.1016 / 0378-1119 (95) 00881-0 . PMID 8964509 .
- Suzuki Y, Yoshitomo-Nakagawa K, Maruyama K et coll. (1997). "Construction et caractérisation d'une bibliothèque d'ADNc enrichie en pleine longueur et enrichie en extrémité 5 '". Gene . 200 (1–2): 149–156. doi : 10.1016 / S0378-1119 (97) 00411-3 . PMID 9373149 .
Liens externes
- Thromboxane-A + Synthase à la US National Library of Medicine Medical Subject Headings (MeSH)