Ticarcilline - Ticarcillin
 | |
| Donnée clinique | |
|---|---|
| AHFS / Drugs.com | Monographie |
| MedlinePlus | a685037 |
Catégorie grossesse |
|
| Voies d' administration |
Intraveineux |
| code ATC | |
| Statut légal | |
| Statut légal | |
| Données pharmacocinétiques | |
| Liaison protéique | 45% |
| Demi-vie d' élimination | 1,1 heures |
| Excrétion | Rénal |
| Identifiants | |
| |
| Numero CAS | |
| CID PubChem | |
| Banque de médicaments | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Tableau de bord CompTox ( EPA ) | |
| Carte d'information de l'ECHA |
100.047.451 |
| Données chimiques et physiques | |
| Formule | C 15 H 16 N 2 O 6 S 2 |
| Masse molaire | 384,42 g·mol -1 |
| Modèle 3D ( JSmol ) | |
| |
| |
| (Vérifier) | |
La ticarcilline est une carboxypénicilline . Il est presque toujours vendu et utilisé en association avec du clavulanate sous forme de ticarcilline/acide clavulanique . Parce qu'il s'agit d'une pénicilline, il appartient également à la classe plus large des antibiotiques bêta-lactamines . Sa principale utilisation clinique est en tant qu'antibiotique injectable pour le traitement des bactéries à Gram négatif , en particulier Pseudomonas aeruginosa et Proteus vulgaris . C'est aussi l'un des rares antibiotiques capables de traiter les infections à Stenotrophomonas maltophilia .
Il se présente sous forme de poudre blanche ou jaune pâle. Il est très soluble dans l'eau, mais ne doit être dissous qu'immédiatement avant utilisation pour éviter la dégradation.
Il a été breveté en 1963.
Mécanisme d'action
Les propriétés antibiotiques de la ticarcilline découlent de sa capacité à empêcher la réticulation du peptidoglycane lors de la synthèse de la paroi cellulaire , lorsque les bactéries tentent de se diviser , provoquant la mort cellulaire.
La ticarcilline, comme la pénicilline , contient un cycle β-lactame qui peut être clivé par les bêta-lactamases , entraînant l'inactivation de l'antibiotique. Les bactéries qui peuvent exprimer les -lactamases sont donc résistantes aux antibiotiques -lactames. En raison, au moins en partie, de l'anneau -lactame commun, la ticarcilline peut provoquer des réactions chez les patients allergiques à la pénicilline. La ticarcilline est également souvent associée à un inhibiteur de la -lactamase tel que l'acide clavulanique ( co-ticarclav ).
Autres utilisations
En biologie moléculaire , la ticarcilline est utilisée comme alternative à l' ampicilline pour tester l'absorption de gènes marqueurs dans les bactéries. Il empêche l'apparition de colonies satellites qui se produisent lorsque l'ampicilline se décompose dans le milieu. Il est également utilisé en biologie moléculaire végétale pour tuer Agrobacterium , qui est utilisé pour transmettre des gènes aux cellules végétales.
Dosage et administration
La ticarcilline n'est pas absorbée par voie orale, elle doit donc être administrée par injection intraveineuse ou intramusculaire.
Noms commerciaux et préparations
- Ticarcilline : Ticar était auparavant commercialisée par Beecham , puis SmithKline Beecham jusqu'en 1999, date à laquelle elle a fusionné avec Glaxo pour former GlaxoSmithKline ; il n'est plus disponible au Royaume-Uni. La distribution aux États-Unis a cessé en 2004. Ticar a été remplacé par Timentin.
Cependant Timentin contient du clavulanate contrairement au Ticar
- Ticarcilline/clavulanate : Timentin, en Australie, au Royaume-Uni et aux États-Unis, a été commercialisé par Beecham, puis GlaxoSmithKline.
Synthèse
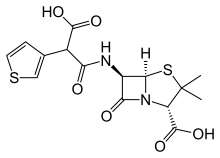
La carbénicilline est utilisée en clinique principalement en raison de sa faible toxicité et de son utilité dans le traitement des infections des voies urinaires dues aux espèces sensibles de Pseudomonas . Sa faible puissance, sa faible activité orale et sa sensibilité aux bêta-lactamases bactériennes le rendent vulnérable au remplacement par des agents sans ces déficits. Un concurrent dans cette course est la ticaricilline. Son origine dépendait du fait bien connu qu'un soufre divalent est à peu près équivalent à un groupe vinyle (cf méthiopropamine , sufentanil , pizotyline etc.).
Une synthèse a commencé par fabriquer l'ester monobenzylique de l'acide 3-thiénylmalonique, en le convertissant en chlorure d'acide avec du SOCI2 et en le condensant avec l'acide 6-aminopénicillanique ( 6-APA ). L'hydrogénolyse (Pd/C) a complété la synthèse de la ticarcilline.