Oxyde d'étain(II) - Tin(II) oxide
|
|

|
|

|
|
| Noms | |
|---|---|
|
Nom IUPAC
Oxyde d'étain(II)
|
|
| Autres noms
Oxyde stanneux, monoxyde d'étain
|
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| Carte d'information de l'ECHA |
100.040.439 |
| Numéro CE | |
|
CID PubChem
|
|
| Numéro RTECS | |
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| SnO | |
| Masse molaire | 134,709 g/mol |
| Apparence | poudre noire ou rouge lorsqu'elle est anhydre, blanche lorsqu'elle est hydratée |
| Densité | 6,45 g / cm 3 |
| Point de fusion | 1 080 °C (1 980 °F; 1 350 K) |
| insoluble | |
| −19,0·10 −6 cm 3 /mol | |
| Structure | |
| tétragonal | |
| Thermochimie | |
|
Entropie molaire standard ( S |
56 J·mol -1 ·K -1 |
|
Std enthalpie de
formation (Δ f H ⦵ 298 ) |
−285 kJ·mol −1 |
| Dangers | |
| Fiche de données de sécurité | ICSC 0956 |
| point de rupture | Ininflammable |
| NIOSH (limites d'exposition pour la santé aux États-Unis) : | |
|
PEL (Autorisé)
|
rien |
|
REL (recommandé)
|
TWA 2 mg/m 3 |
|
IDLH (Danger immédiat)
|
ND |
| Composés apparentés | |
|
Autres anions
|
Sulfure d' étain Séléniure d' étain Tellurure d'étain |
|
Autres cations
|
Monoxyde de carbone Monoxyde de silicium Oxyde de germanium(II) Oxyde de plomb(II) |
| Dioxyde d'étain | |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Références de l'infobox | |
L'oxyde d'étain (II) ( oxyde stanneux ) est un composé de formule SnO. Il est composé d' étain et d' oxygène où l'étain a l'état d'oxydation +2. Il existe deux formes, une forme stable bleu-noir et une forme rouge métastable .
Préparation et réactions
Le SnO bleu-noir peut être produit en chauffant l'hydrate d'oxyde d'étain (II), SnO.xH 2 O (x<1) précipité lorsqu'un sel d'étain (II) réagit avec un hydroxyde alcalin tel que NaOH.
Le SnO rouge métastable peut être préparé par chauffage doux du précipité produit par l'action de l'ammoniaque sur un sel d'étain (II).
Le SnO peut être préparé en tant que substance pure en laboratoire, par chauffage contrôlé d'oxalate d'étain(II) ( oxalate stanneux ) en l'absence d'air ou sous atmosphère de CO 2 . Cette méthode est également appliquée à la production d' oxyde ferreux et d' oxyde manganeux .
- SnC 2 O 4 ·2H 2 O → SnO + CO 2 + CO + 2 H 2 O
L'oxyde d'étain(II) brûle dans l'air avec une faible flamme verte pour former du SnO 2 .
- 2 SnO + O 2 → 2 SnO 2
Lorsqu'il est chauffé dans une atmosphère inerte, il se produit initialement une dismutation donnant du Sn métal et du Sn 3 O 4 qui réagit en outre pour donner du SnO 2 et du Sn métal.
- 4SnO → Sn 3 O 4 + Sn
- Sn 3 O 4 → 2SnO 2 + Sn
SnO est amphotère , se dissolvant dans un acide fort pour donner des sels d'étain(II) et dans une base forte pour donner des stannites contenant Sn(OH) 3 − . Il peut être dissous dans des solutions acides fortes pour donner les complexes ioniques Sn(OH 2 ) 3 2+ et Sn(OH)(OH 2 ) 2 + , et dans des solutions moins acides pour donner Sn 3 (OH) 4 2+ . A noter que les stannites anhydres, par exemple K 2 Sn 2 O 3 , K 2 SnO 2 sont également connus. Le SnO est un agent réducteur et on pense qu'il réduit le cuivre(I) en amas métalliques dans la fabrication de ce que l'on appelle le « verre à rubis de cuivre ».
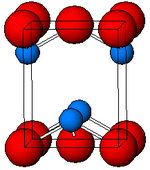
Structure
Noir, α-SnO adopte la structure de couche tétragonale PbO contenant quatre atomes d'étain pyramidaux carrés coordonnés. Cette forme se trouve dans la nature comme le minéral rare romarchite . L'asymétrie est généralement simplement attribuée à une paire isolée stériquement active; cependant, les calculs de densité électronique montrent que l'asymétrie est causée par une interaction antiliante des orbitales Sn(5s) et O(2p). La structure électronique et la chimie de la paire isolée déterminent la plupart des propriétés du matériau.
Une non-stœchiométrie a été observée dans SnO.
La bande interdite électronique a été mesurée entre 2,5 eV et 3 eV .
Les usages
L'utilisation dominante de l'oxyde stanneux est comme précurseur dans la fabrication d'autres composés ou sels d'étain, typiquement divalents. L'oxyde stanneux peut également être utilisé comme agent réducteur et dans la création de verre rubis . Il a une utilisation mineure comme catalyseur d' estérification .
L'oxyde de cérium(III) sous forme céramique , ainsi que l'oxyde d'étain(II) (SnO) sont utilisés pour l'éclairage avec la lumière UV.

