Ubiquitine carboxy-terminal hydrolase L1 - Ubiquitin carboxy-terminal hydrolase L1
L' ubiquitine carboxy-terminal hydrolase L1 ( EC 3.1.2.15 , ubiquitine C-terminal hydrolase , UCH-L1 ) est une enzyme désubiquitinante .
| Ubiquitine Carboxy-terminal Hydrolase L1 (UCH-L1) | |
|---|---|
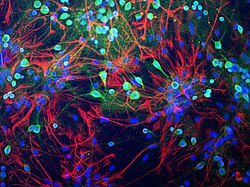
Les neurones du tissu cérébral du rat sont colorés en vert avec un anticorps anti-ubiquitine C-terminal hydrolase L1 (UCH-L1) qui met fortement en évidence le corps cellulaire et la cellule traite plus faiblement. Les astrocytes sont colorés en rouge avec des anticorps contre la protéine GFAP trouvée dans les filaments cytoplasmiques. Les noyaux de tous les types de cellules sont colorés en bleu avec un colorant liant l'ADN. Anticorps, préparation cellulaire et image générées par EnCor Biotechnology Inc.
| |
|
Termes anatomiques de la microanatomie |
Fonction
UCH-L1 est un membre d'une famille de gènes dont les produits hydrolysent les petits adduits C-terminaux de l'ubiquitine pour générer le monomère d'ubiquitine. L'expression d'UCH-L1 est hautement spécifique des neurones et des cellules du système neuroendocrinien diffus et de leurs tumeurs. Il est abondamment présent dans tous les neurones (représente 1 à 2 % des protéines cérébrales totales), exprimé spécifiquement dans les neurones et les testicules/ovaires.
La triade catalytique de UCH-L1 contient une cystéine en position 90, un aspartate en position 176 et une histidine en position 161 qui sont responsables de son activité hydrolase.
Pertinence pour les troubles neurodégénératifs
Une mutation ponctuelle (I93M) dans le gène codant pour cette protéine est impliquée comme cause de la maladie de Parkinson dans une famille allemande, bien que cette découverte soit controversée, car aucun autre patient atteint de la maladie de Parkinson avec cette mutation n'a été trouvé.
De plus, un polymorphisme (S18Y) dans ce gène s'est avéré associé à un risque réduit de maladie de Parkinson. Il a été spécifiquement démontré que ce polymorphisme a une activité antioxydante.
Une autre fonction potentiellement protectrice de l' UCH-L1 est sa capacité à stabiliser la mono ubiquitine , un composant important du système ubiquitine protéasome . On pense qu'en stabilisant les monomères d'ubiquitine et en empêchant ainsi leur dégradation, UCH-L1 augmente le pool d'ubiquitine disponible à marquer sur des protéines destinées à être dégradées par le protéasome.
Le gène est également associé à la maladie d'Alzheimer et requis pour une fonction synaptique et cognitive normale . La perte d'Uchl1 augmente la sensibilité des cellules bêta pancréatiques à la mort cellulaire programmée, indiquant que cette protéine joue un rôle protecteur dans les cellules neuroendocrines et illustrant un lien entre le diabète et les maladies neurodégénératives.
Les patients atteints de neurodégénérescence précoce dans laquelle la mutation causale était dans le gène UCHL1 (en particulier, le domaine de liaison à l'ubiquitine, E7A) présentent une cécité, une ataxie cérébelleuse, un nystagmus, un dysfonctionnement de la colonne dorsale et un dysfonctionnement des motoneurones supérieurs.
Expression ectopique
Bien que l'expression de la protéine UCH-L1 soit spécifique aux neurones et aux tissus des testicules/ovaires, elle s'est avérée être exprimée dans certaines lignées cellulaires tumorales pulmonaires. Cette expression anormale d'UCH-L1 est impliquée dans le cancer et a conduit à la désignation d'UCH-L1 comme oncogène . En outre, il existe des preuves que UCH-L1 pourrait jouer un rôle dans la pathogenèse de la glomérulonéphrite membraneuse, car l'expression de novo de UCH-L1 dans les podocytes a été observée dans la PHN, le modèle rat de mGN humain. On pense que cette expression UCH-L1 induit au moins en partie une hypertrophie des podocytes.
Structure des protéines
L'UCH-L1 humaine et la protéine étroitement apparentée UCHL3 ont l'une des structures de nœuds les plus complexes jamais découvertes pour une protéine, avec cinq croisements de nœuds. Il est supposé qu'une structure de nœud peut augmenter la résistance d'une protéine à la dégradation dans le protéasome .
La conformation de la protéine UCH-L1 peut également être une indication importante de neuroprotection ou de pathologie. Par exemple, il a été démontré que le dimère UCH-L1 présente l'activité de ligase potentiellement pathogène et peut conduire à l'augmentation susmentionnée de l'agrégation de la -synucléine. Le polymorphisme S18Y de UCH-L1 s'est avéré moins sujet à la dimérisation.
Interactions
Il a été démontré que l'ubiquitine carboxy-terminal hydrolase L1 interagit avec la sous-unité homologue photomorphogène constitutive de COP9 5 .
Il a également été démontré que l'UCH-L1 interagit avec l'-synucléine , une autre protéine impliquée dans la pathologie de la maladie de Parkinson . Il est rapporté que cette activité est le résultat de son activité ubiquityl ligase qui peut être associée à la mutation pathogène I93M dans le gène.
Plus récemment, il a été démontré que UCH-L1 interagit avec la ligase E3, parkin . Il a été démontré que Parkin se lie et ubiquitinylate UCH-L1 pour favoriser la dégradation lysosomale de UCH-L1.
Voir également
- Ubiquitine carboxyl-terminal estérase L3 —le gène UCHL3
- Alpha synucléine
- maladie de Parkinson
- protéasome
Les références
Lectures complémentaires
- Healy DG, Abou-Sleiman PM, Wood NW (octobre 2004). « Les causes génétiques de la maladie de Parkinson : UCHL-1 ». Recherche sur les cellules et les tissus . 318 (1) : 189-94. doi : 10.1007/s00441-004-0917-3 . PMID 15221445 . S2CID 22530636 .
- Rasmussen HH, van Damme J, Puype M, Gesser B, Celis JE, Vandekerckhove J (décembre 1992). « Microséquences de 145 protéines enregistrées dans la base de données de protéines de gel bidimensionnelles de kératinocytes épidermiques humains normaux ». Électrophorèse . 13 (12) : 960-9. doi : 10.1002/elps.11501301199 . PMID 1286667 . S2CID 41855774 .
- Edwards YH, Fox MF, Povey S, Hinks LJ, Thompson RJ, Day IN (octobre 1991). « Le gène de l'hydrolase C-terminale de l'ubiquitine spécifique des neurones humains (UCHL1, PGP9.5) est mappé sur le chromosome 4p14 ». Annales de génétique humaine . 55 (Pt 4) : 273–8. doi : 10.1111/j.1469-1809.1991.tb00853.x . PMID 1840236 . S2CID 25763146 .
- Honoré B, Rasmussen HH, Vandekerckhove J, Celis JE (mars 1991). "Le produit du gène de la protéine neuronale 9.5 (IEF SSP 6104) est exprimé dans des fibroblastes humains MRC-5 cultivés d'origine normale et est fortement régulé à la baisse dans leurs homologues transformés SV40" . Lettres FEBS . 280 (2) : 235-40. doi : 10.1016/0014-5793(91)80300-R . PMID 1849484 . S2CID 40473683 .
- Day IN, Hinks LJ, Thompson RJ (juin 1990). « La structure du gène humain codant le produit du gène de la protéine 9.5 (PGP9.5), une hydrolase C-terminale de l'ubiquitine spécifique aux neurones » . Le Journal Biochimique . 268 (2) : 521-4. doi : 10.1042/bj2680521 . PMC 1131465 . PMID 2163617 .
- Jour IN, Thompson RJ (janvier 1987). "Clonage moléculaire de l'ADNc codant pour la protéine PGP 9.5 humaine. Un nouveau marqueur cytoplasmique pour les neurones et les cellules neuroendocrines" . Lettres FEBS . 210 (2) : 157-60. doi : 10.1016/0014-5793(87)81327-3 . PMID 2947814 . S2CID 39218297 .
- Doran JF, Jackson P, Kynoch PA, Thompson RJ (juin 1983). « Isolement de PGP 9.5, une nouvelle protéine spécifique des neurones humains détectée par électrophorèse bidimensionnelle à haute résolution ». Journal de neurochimie . 40 (6) : 1542–7. doi : 10.1111/j.1471-4159.1983.tb08124.x . PMID 6343558 . S2CID 24386913 .
- Onno M, Nakamura T, Mariage-Samson R, Hillova J, Hill M (mars 1993). « L'oncogène humain TRE17 est généré à partir d'une famille de séquences polymorphes homologues par des changements de base unique ». ADN et biologie cellulaire . 12 (2) : 107-18. doi : 10.1089/dna.1993.12.107 . PMID 8471161 .
- Larsen CN, Price JS, Wilkinson KD (mai 1996). « Liaison au substrat et catalyse par les hydrolases C-terminales d'ubiquitine : identification de deux résidus de site actif ». Biochimie . 35 (21) : 6735-44. doi : 10.1021/bi960099f . PMID 8639624 .
- Meilleur CL, Pudney J, Welch WR, Burger N, Hill JA (avril 1996). "Localisation et caractérisation des populations de globules blancs dans l'ovaire humain tout au long du cycle menstruel et de la ménopause" . Reproduction humaine . 11 (4) : 790-7. doi : 10.1093/oxfordjournals.humrep.a019256 . PMID 8671330 .
- D'Andrea V, Malinovsky L, Berni A, Biancari F, Biassoni L, Di Matteo FM, Corbellini L, Falvo L, Santoni F, Spyrou M, De Antoni E (octobre 1997). « L'immunolocalisation de PGP 9.5 dans le rein humain normal et le carcinome à cellules rénales ». Il Giornale di Chirurgia . 18 (10) : 521-4. PMID 9435142 .
- Larsen CN, Krantz BA, Wilkinson KD (mars 1998). « Spécificité du substrat des enzymes désubiquitinantes : hydrolases C-terminales d'ubiquitine ». Biochimie . 37 (10) : 3358-68. doi : 10.1021/bi972274d . PMID 9521656 .
- Leroy E, Boyer R, Auburger G, Leube B, Ulm G, Mezey E, Harta G, Brownstein MJ, Jonnalagada S, Chernova T, Dehejia A, Lavedan C, Gasser T, Steinbach PJ, Wilkinson KD, Polymeropoulos MH (octobre 1998 ). « La voie de l'ubiquitine dans la maladie de Parkinson ». Nature . 395 (6701) : 451-2. Bibcode : 1998Natur.395..451L . doi : 10.1038/26652 . PMID 9774100 . S2CID 204997455 .
- Wada H, Kito K, Caskey LS, Yeh ET, Kamitani T (octobre 1998). « Clivage du C-terminal de NEDD8 par UCH-L3 ». Communications de recherche biochimique et biophysique . 251 (3) : 688-92. doi : 10.1006/bbrc.1998.9532 . PMID 9790970 .
- Leroy E, Boyer R, Polymeropoulos MH (décembre 1998). "Structure intron-exon de l'ubiquitine c-terminal hydrolase-L1" . Recherche ADN . 5 (6) : 397-400. doi : 10.1093/dnares/5.6.397 . PMID 10048490 .
- Lincoln S, Vaughan J, Wood N, Baker M, Adamson J, Gwinn-Hardy K, Lynch T, Hardy J, Farrer M (février 1999). « Basse fréquence des mutations pathogènes dans le gène de l'hydrolase carboxy-terminale de l'ubiquitine dans la maladie de Parkinson familiale ». NeuroReport . 10 (2) : 427-9. doi : 10.1097/00001756-199902050-00040 . PMID 10203348 .
- Harhangi BS, Farrer MJ, Lincoln S, Bonifati V, Meco G, De Michele G, Brice A, Dürr A, Martinez M, Gasser T, Bereznai B, Vaughan JR, Wood NW, Hardy J, Oostra BA, Breteler MM (juillet 1999). « La mutation Ile93Met dans le gène de l'ubiquitine carboxy-terminal-hydrolase-L1 n'est pas observée dans les cas européens de la maladie de Parkinson familiale ». Lettres de neurosciences . 270 (1) : 1–4. doi : 10.1016/S0304-3940(99)00465-6 . PMID 10454131 . S2CID 26352360 .
- Saigoh K, Wang YL, Suh JG, Yamanishi T, Sakai Y, Kiyosawa H, Harada T, Ichihara N, Wakana S, Kikuchi T, Wada K (septembre 1999). « Délétion intragénique dans le gène codant pour l'hydrolase carboxy-terminale d'ubiquitine chez les souris gad ». Génétique de la nature . 23 (1) : 47-51. doi : 10.1038/12647 . PMID 10471497 . S2CID 34253163 .
- Mellick GD, Silburn PA (octobre 2000). « Le polymorphisme S18Y du gène S18Y de l'hydrolase carboxy-terminale de l'ubiquitine ne confère pas de protection contre la maladie de Parkinson idiopathique ». Lettres de neurosciences . 293 (2) : 127-30. doi : 10.1016/S0304-3940(00)01510-X . PMID 11027850 . S2CID 25234210 .
- Sharma N, McLean PJ, Kawamata H, Irizarry MC, Hyman BT (octobre 2001). "L'alpha-synucléine a une conformation altérée et montre une interaction intermoléculaire étroite avec l'ubiquitine dans les corps de Lewy". Acta Neuropathologica . 102 (4) : 329-34. doi : 10.1007/s004010100369 . PMID 11603807 . S2CID 33892290 .
Liens externes
- Ubiquitine+Carboxy-Terminal+Hydrolase à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis
- Aperçu de toutes les informations structurelles disponibles dans le PDB pour UniProt : P09936 (Ubiquitin carboxyl-terminal hydrolase isozyme L1) au PDBe-KB .