Thermogénine - Thermogenin
La thermogénine (appelée protéine de découplage par ses découvreurs et maintenant connue sous le nom de protéine de découplage 1 ou UCP1 ) est une protéine porteuse mitochondriale présente dans le tissu adipeux brun (BAT). Il est utilisé pour générer de la chaleur par thermogenèse sans frisson , et apporte une contribution quantitativement importante à la lutte contre les pertes de chaleur chez les bébés qui se produiraient autrement en raison de leur rapport surface-volume élevé.
Mécanisme
Les UCP sont des protéines transmembranaires qui diminuent le gradient de protons généré lors de la phosphorylation oxydative. Ils le font en augmentant la perméabilité de la membrane mitochondriale interne, permettant aux protons qui ont été pompés dans l'espace intermembranaire de retourner dans la matrice mitochondriale. La génération de chaleur médiée par UCP1 dans la graisse brune découple la chaîne respiratoire, permettant une oxydation rapide du substrat avec un faible taux de production d'ATP. UCP1 est lié à d'autres transporteurs de métabolites mitochondriaux tels que le translocateur de nucléotides adénine, un canal de protons dans la membrane interne mitochondriale qui permet la translocation de protons de l'espace intermembranaire mitochondrial vers la matrice mitochondriale . UCP1 est limité au tissu adipeux brun , où il fournit un mécanisme pour l'énorme capacité de génération de chaleur du tissu.
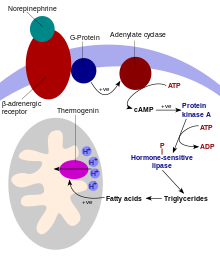
UCP1 est activé dans la cellule adipeuse brune par les acides gras et inhibé par les nucléotides. Les acides gras sont libérés par la cascade de signalisation suivante : Les terminaux sympathiques du système nerveux libèrent la norépinéphrine sur un récepteur adrénergique bêta-3 sur la membrane plasmique . Cela active l' adénylyl cyclase , qui catalyse la conversion de l'ATP en AMP cyclique (AMPc). L'AMPc active la protéine kinase A , libérant ses sous-unités C actives de ses sous-unités R régulatrices. La protéine kinase A active, à son tour, phosphoryle la triacylglycérol lipase , l'activant ainsi. La lipase convertit les triacylglycérols en acides gras libres, qui activent UCP1, outrepassant l'inhibition causée par les nucléotides puriques ( GDP et ADP ). Au cours de la fin de la thermogenèse, la thermogénine est inactivée et les acides gras résiduels sont éliminés par oxydation, permettant à la cellule de reprendre son état normal de conservation d'énergie.
UCP1 est très similaire à la protéine porteuse ATP/ADP, ou Adenine Nucleotide Translocator ( ANT ). Le modèle d'accès alternatif proposé pour UCP1 est basé sur le mécanisme ANT similaire. Le substrat entre dans la protéine UCP1 à moitié ouverte du côté cytoplasmique de la membrane, la protéine ferme le côté cytoplasmique de sorte que le substrat est enfermé dans la protéine, puis le côté matrice de la protéine s'ouvre, permettant au substrat d'être libéré dans la matrice mitochondriale . L'ouverture et la fermeture de la protéine sont accomplies par le resserrement et le relâchement des ponts salins à la surface de la membrane de la protéine. La justification de cette modélisation d'UCP1 sur ANT se trouve dans les nombreux résidus conservés entre les deux protéines qui sont activement impliquées dans le transport du substrat à travers la membrane. Les deux protéines sont des protéines membranaires intégrales , localisées dans la membrane mitochondriale interne, et elles ont un schéma similaire de ponts salins, de résidus proline et d' acides aminés hydrophobes ou aromatiques qui peuvent se fermer ou s'ouvrir lorsqu'ils sont à l'état cytoplasmique ou matriciel.
Évolution
UCP1 est exprimé dans le tissu adipeux brun, qui ne se trouve fonctionnellement que chez les eutheriens . Le gène UCP1, ou thermogénine, est probablement apparu dans un ancêtre des vertébrés modernes , mais n'a pas permis initialement à notre ancêtre vertébré d'utiliser la thermogenèse sans frisson pour se réchauffer. Ce n'est que lorsque la génération de chaleur a été sélectionnée de manière adaptative pour les descendants de mammifères placentaires de cet ancêtre commun que UCP1 a développé sa fonction actuelle dans le tissu adipeux brun pour fournir une chaleur supplémentaire. Alors que UCP1 joue un rôle thermogénique clé chez les mammifères placentaires à large répartition, en particulier ceux de petite taille et ceux qui hibernent, le gène UCP1 a perdu sa fonctionnalité dans plusieurs lignées de grande taille (par exemple les chevaux , les éléphants , les vaches marines , les baleines et les damans ) et lignées à faible métabolisme (par exemple pangolins , tatous , paresseux et fourmiliers ). Des découvertes récentes d' orthologues non générateurs de chaleur d'UCP1 chez les poissons et les marsupiaux , autres descendants de l'ancêtre des vertébrés modernes, montrent que ce gène a été transmis à tous les vertébrés modernes, mais à part les mammifères placentaires, aucun n'a la capacité de produire de la chaleur. Cela suggère en outre que UCP1 avait un objectif original différent et, en fait, les analyses phylogénétiques et de séquence indiquent que UCP1 est probablement une forme mutée d'une protéine porteuse dicarboxylate qui s'est adaptée à la thermogenèse chez les mammifères placentaires.
Histoire
Dans les années 1960, des chercheurs enquêtant sur le tissu adipeux brun ont découvert qu'en plus de produire plus de chaleur que ce qui est typique des autres tissus, le tissu adipeux brun semblait court-circuiter, ou découpler, le couplage respiratoire. La protéine de découplage 1 a été découverte en 1978 par David Nicholls, Vibeke Bernson et Gillian Heaton et s'est avérée être la protéine responsable de cet effet de découplage. UCP1 a ensuite été purifié pour la première fois en 1980 et a été cloné pour la première fois en 1988.
La protéine de découplage deux (UCP2), un homologue de l'UCP1, a été identifiée en 1997. L'UCP2 se localise dans une grande variété de tissus et serait impliquée dans la régulation des espèces réactives de l'oxygène (ROS). Au cours de la dernière décennie, trois homologues supplémentaires d'UCP1 ont été identifiés, notamment UCP3 , UCP4 et UCP5 (également connu sous le nom de BMCP1 ou SLC25A14).
Pertinence clinique
Les méthodes d'administration d'UCP1 aux cellules par thérapie de transfert génique ou les méthodes de sa régulation positive ont été une piste de recherche importante dans la recherche sur le traitement de l'obésité, en raison de leur capacité à dissiper les réserves métaboliques en excès.
Voir également
- 2,4-Dinitrophénol (Une navette de protons à petites molécules synthétiques avec des effets similaires)
Les références
Lectures complémentaires
- Macher, Gabriel; Koehler, Mélanie ; Rupprecht, Anne; Kreiter, Jürgen; Hinterdorfer, Peter; Pohl, Elena E. (mars 2018). "Inhibition des mitochondries UCP1 et UCP3 par les nucléotides puriques et le phosphate" . Biochimica et Biophysica Acta (BBA) - Biomembranes . 1860 (3) : 664-672. doi : 10.1016/j.bbamem.2017.12.001 . PMC 6118327 . PMID 29212043 .
- Urbankova, Eva; Voltchenko, Anna; Pohl, Pierre ; Ježek, Petr ; Pohl, Elena E. (29 août 2003). "Cinétique de transport des protéines de découplage" . Journal de chimie biologique . 278 (35) : 32497–32500. doi : 10.1074/jbc.M303721200 . PMID 12826670 .
- Ricquier D, Bouillaud F (janvier 2000). « Les homologues de protéines de découplage : UCP1, UCP2, UCP3, StUCP et AtUCP » . Le Journal Biochimique . 345 Pt 2 (2) : 161-79. doi : 10.1042/0264-6021:3450161 . PMC 1220743 . PMID 10620491 .
- Muzzin P (avril 2002). "Les protéines de découplage". Annales d'endocrinologie . 63 (2 Pt 1) : 106-10. PMID 11994670 .
- Del Mar Gonzalez-Barroso M, Ricquier D, Cassard-Doulcier AM (oct 2000). « Le gène humain de découplage de la protéine-1 (UCP1) : état actuel et perspectives dans la recherche sur l'obésité ». Avis sur l'obésité . 1 (2) : 61-72. doi : 10.1046/j.1467-789x.2000.00009.x . PMID 12119988 . S2CID 30231289 .
- Cassard AM, Bouillaud F, Mattei MG, Hentz E, Raimbault S, Thomas M, Ricquier D (juil 1990). « Gène de protéine de découplage humain : structure, comparaison avec le gène de rat et affectation au bras long du chromosome 4 ». Journal de biochimie cellulaire . 43 (3) : 255–64. doi : 10.1002/jcb.240430306 . PMID 2380264 . S2CID 31128860 .
- Bouillaud F, Villarroya F, Hentz E, Raimbault S, Cassard AM, Ricquier D (juil 1988). « Détection de l'ARNm de la protéine de découplage du tissu adipeux brun chez les patients adultes par une sonde génomique humaine ». Sciences Cliniques . 75 (1) : 21-7. doi : 10.1042/cs0750021 . PMID 3165741 .
- Oppert JM, Vohl MC, Chagnon M, Dionne FT, Cassard-Doulcier AM, Ricquier D, Pérusse L, Bouchard C (août 1994). « Le polymorphisme de l'ADN dans le gène de la protéine de découplage (UCP) et la graisse corporelle humaine ». International Journal of Obesity and Related Metabolic Disorders . 18 (8) : 526–31. PMID 7951471 .
- Clément K, Ruiz J, Cassard-Doulcier AM, Bouillaud F, Ricquier D, Basdevant A, Guy-Grand B, Froguel P (déc. 1996). "Effet additif de la variante A-->G (-3826) du gène de la protéine de découplage et de la mutation Trp64Arg du gène du récepteur bêta 3-adrénergique sur la prise de poids dans l'obésité morbide". International Journal of Obesity and Related Metabolic Disorders . 20 (12) : 1062–6. PMID 8968850 .
- Schleiff E, Shore GC, Goping IS (mars 1997). "Récepteur d'importation mitochondrial humain, Tom20p. Utilisation du glutathion pour révéler des interactions spécifiques entre Tom20-glutathion S-transférase et les protéines précurseurs mitochondriales". Lettres FEBS . 404 (2-3): 314-8. doi : 10.1016/S0014-5793(97)00145-2 . PMID 9119086 . S2CID 29177508 .
- Urhammer SA, Fridberg M, Sørensen TI, Echwald SM, Andersen T, Tybjaerg-Hansen A, Clausen JO, Pedersen O (décembre 1997). « Études de la variabilité génétique du gène de la protéine de découplage 1 chez des sujets caucasiens atteints d'obésité juvénile ». Le Journal d'endocrinologie clinique et du métabolisme . 82 (12) : 4069–74. doi : 10.1210/jc.82.12.4069 . PMID 9398715 .
- Jezek P, Urbánková E (janvier 2000). "Séquence spécifique de motifs de protéines de découplage mitochondrial" . IUBMB Vie . 49 (1) : 63-70. doi : 10.1080/713803586 . PMID 10772343 . S2CID 8541209 .
- Mori H, Okazawa H, Iwamoto K, Maeda E, Hashiramoto M, Kasuga M (mars 2001). "Un polymorphisme dans la région 5' non traduite et une variante Met229-->Leu dans l'exon 5 du gène humain UCP1 sont associés à une susceptibilité au diabète sucré de type II" . Diabétologie . 44 (3) : 373-6. doi : 10.1007/s001250051629 . PMID 11317671 .
- Nibbelink M, Moulin K, Arnaud E, Duval C, Pénicaud L, Casteilla L (déc. 2001). "La graisse brune UCP1 est spécifiquement exprimée dans les cellules musculaires lisses longitudinales utérines" . Le Journal de Chimie Biologique . 276 (50) : 47291-5. doi : 10.1074/jbc.M105658200 . PMID 11572862 .
- Echtay KS, Roussel D, St-Pierre J, Jekabsons MB, Cadenas S, Stuart JA, Harper JA, Roebuck SJ, Morrison A, Pickering S, Clapham JC, Brand MD (janvier 2002). « Le superoxyde active les protéines de découplage mitochondrial ». Nature . 415 (6867) : 96-9. Bibcode : 2002Natur.415 ... 96E . doi : 10.1038/415096a . PMID 11780125 . S2CID 4349744 .
- Rousset S, del Mar Gonzalez-Barroso M, Gelly C, Pecqueur C, Bouillaud F, Ricquier D, Cassard-Doulcier AM (mai 2002). "Un nouveau site polymorphe situé dans le gène humain UCP1 contrôle la liaison in vitro du facteur de type CREB" . International Journal of Obesity and Related Metabolic Disorders . 26 (5) : 735-8. doi : 10.1038/sj.ijo.0801973 . PMID 12032762 .
- Rim JS, Kozak LP (septembre 2002). « Motifs régulateurs de la protéine de liaison CREB et des facteurs de transcription Nfe2l2 dans l'amplificateur en amont du gène de la protéine 1 de découplage mitochondrial » . Le Journal de Chimie Biologique . 277 (37) : 34589-600. doi : 10.1074/jbc.M108866200 . PMID 12084707 .
- Kieć-Wilk B, Wybrańska I, Malczewska-Malec M, Leszczyńska-Gołabek L, Partyka L, Niedbał S, Jabrocka A, Dembińska-Kieć A (septembre 2002). « Corrélation du polymorphisme -3826A > G dans le promoteur du gène de la protéine de découplage 1 avec l'obésité et les troubles métaboliques dans les familles obèses du sud de la Pologne ». Journal de physiologie et de pharmacologie . 53 (3) : 477-90. PMID 12375583 .
Liens externes
- Comprimé anti-obésité aux algues espoir (BBC - Thermogénine mentionnée dans le cadre du processus)
- thermogénine à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis